Citrát vápenatý - Calcium citrate
 2D struktura citrátu vápenatého | |
 Citrát vápenatý tetrahydrát[1] | |
| Jména | |
|---|---|
| Název IUPAC Vápenatá sůl 2-hydroxy-l, 2,3-propan-trikarboxylové kyseliny (2: 3) | |
| Ostatní jména E333, trikalciumdicitrát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.011.265 |
| Číslo ES |
|
| Číslo E. | E333 (antioxidanty, ...) |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Ca.3(C6H5Ó7)2 | |
| Molární hmotnost | 498,4334 g / mol (bezvodý) 570,4945 g / mol (tetrahydrát) |
| Vzhled | bílý prášek |
| Zápach | bez zápachu |
| Hustota | 1,63 g / cm3 (bezvodý) 2,00 g / cm3 (tetrahydrát)[1] |
| Bod tání | Rozkládá se |
| Bod varu | Rozkládá se |
| 0,85 g / l (18 ° C) 0,95 g / l (25 ° C) | |
| Rozpustnost | nerozpustný v alkohol |
| Struktura | |
| Triklinická (tetrahydrát) | |
| P1, Č. 2 | |
A = 0,59466 (4) nm, b = 1,02247 (8) nm, C = 1,66496 (13) nm α = 72,213 (7) °, β = 79,718 (7) °, γ = 89,791 (6) °[1] | |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný kationty | Citrát sodný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Citrát vápenatý je vápenatá sůl z kyselina citronová. Běžně se používá jako potravinářská přídatná látka (E333 ), obvykle jako konzervační, ale někdy za příchuť. V tomto smyslu je to podobné jako citrát sodný. Citrát vápenatý se také nachází v některých dietních doplňcích vápníku (např. Citracal). Vápník tvoří 24,1% citronanu vápenatého (bezvodého) a 21,1% citrátu vápenatého (tetrahydrátu). Tetrahydrát se v přírodě vyskytuje jako minerál Earlandite.
Chemické vlastnosti
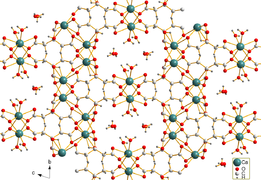
Citrát vápenatý je těžko rozpustný ve vodě. Jehlovité krystaly tetrahydrátu trikalciumdicitrátu [Ca3(C6H5Ó7)2(H2Ó)2] · 2H2O byly získány hydrotermální syntézou. Krystalová struktura obsahuje trojrozměrnou síť, ve které osmkrát koordinoval Ca2+ kationty jsou spojeny citrátovými anionty a vodíkovými vazbami mezi dvěma nekoordinujícími molekulami krystalové vody a dvěma koordinačními molekulami vody.[1]
Výroba
Citrát vápenatý je meziproduktem při izolaci kyselina citronová z kvašení proces, kterým se průmyslově vyrábí kyselina citronová.[2] Kyselina citronová v roztoku bujónu je neutralizována hydroxid vápenatý, sráží nerozpustný citrát vápenatý. Ten se poté odfiltruje od zbytku bujónu a promyje, čímž se získá čistý citrát vápenatý.
- 3 Ca (OH)2 (s) + 2 ° C6H8Ó7 (l) → Ca3(C6H5Ó7)2 (s) + 6 hodin2Ó(l)
Takto vyrobený citrát vápenatý může být prodáván tak, jak je, nebo může být převeden na kyselinu citronovou za použití zředěné kyseliny sírové.
Biologická role
U mnoha jedinců biologická dostupnost Bylo zjištěno, že citronanu vápenatého je stejné jako u levnějšího uhličitan vápenatý.[3] Změny v zažívacím traktu však mohou změnit způsob trávení a vstřebávání vápníku. Na rozdíl od uhličitanu vápenatého, který je zásaditý a neutralizuje žaludeční kyselinu, nemá citrát vápenatý žádný vliv na žaludeční kyselinu.[4] Uhličitan vápenatý je těžší strávitelný než citrát vápenatý,[4] a uhličitan vápenatý s sebou nese riziko "kyselého odrazu" (žaludek nadměrně kompenzuje produkcí více kyseliny),[4] jedinci, kteří jsou citliví na antacida nebo kteří mají potíže s produkcí odpovídající žaludeční kyseliny, si mohou jako doplněk zvolit citrát vápenatý před uhličitanem vápenatým. Podle nedávného výzkumu absorpce vápníku po operaci bypassu žaludku[5] citrát vápenatý může mít zlepšenou biologickou dostupnost oproti uhličitanu vápenatému u pacientů s bypassem žaludku Roux-en-Y, kteří užívají citrát vápenatý jako doplněk stravy po operaci. To je způsobeno hlavně změnami souvisejícími s tím, kde dochází k absorpci vápníku v zažívacím traktu těchto jedinců.
Reference
- ^ A b C d Herdtweck, Eberhardt; Kornprobst, Tobias; Sieber, Roland; Straver, Leo; Plank, Johann (2011). „Krystalová struktura, syntéza a vlastnosti tri-kalcium-di-citrát-tetrahydrátu [Ca3(C6H5Ó7)2(H2Ó)2] · 2H2Ó". Zeitschrift für anorganische und allgemeine Chemie. 637 (6): 655–659. doi:10.1002 / zaac.201100088.
- ^ „Použití vápna v chemickém průmyslu“. Národní asociace vápna. Archivovány od originál dne 29. 9. 2006. Citováno 2006-11-25.
- ^ Heaney RP, Dowell MS, Bierman J, Hale CA, Bendich A (2001). "Absorbovatelnost a efektivita nákladů při doplňování vápníku". Journal of the American College of Nutrition. 20 (3): 239–46. doi:10.1080/07315724.2001.10719038. PMID 11444420. S2CID 206488.
- ^ A b C „Co potřebujete vědět o vápníku“. Harvardské zdravotní publikace. Citováno 4. srpna 2014.
- ^ Tondapu P, Provost D, Adams-Huet B, Sims T, Chang C, Sakhaee K (červen 2009). "Srovnání absorpce uhličitanu vápenatého a citrátu vápenatého po bypassu žaludku Roux-en-Y". Chirurgie obezity. 19 (9): 1256–1261. doi:10.1007 / s11695-009-9850-6. PMC 4469176. PMID 19437082.

