Šťavelan vápenatý - Calcium oxalate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Šťavelan vápenatý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.008.419 |
| Číslo ES |
|
| KEGG | |
PubChem CID | |
| UNII |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CaC2H2Ó5 (monohydrát) CaC2Ó4 (bezvodý) | |
| Vzhled | bílá pevná látka |
| Hustota | 2,20 g / cm3monohydrát[1] |
| Bod tání | 200 ° C (392 ° F; 473 K) se rozkládá (monohydrát) |
| 0,67 mg / L (20 ° C) | |
| Nebezpečí | |
| Hlavní nebezpečí | Škodlivý, dráždivý |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H302, H312 | |
| P280 | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | Uhličitan vápenatý Octan vápenatý Mravenčan vápenatý |
jiný kationty | Šťavelan sodný Šťavelan berylnatý Šťavelan hořečnatý Šťavelan strontnatý Šťavelan barnatý Šťavelan radia Oxalát železitý Oxalát železitý |
Související sloučeniny | Kyselina šťavelová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |


Šťavelan vápenatý (v archaické terminologii, šťavelan vápna) je vápník sůl z šťavelan s chemickým vzorcem CaC2Ó4· (H2Ó)X, kde x se pohybuje od 0 do 3. Všechny formy jsou bezbarvé nebo bílé. Monohydrát se přirozeně vyskytuje jako minerál surový satelit, tvořící krystalovité krystaly, známé v rostlinách jako raphides. Vzácnější dihydrát (minerál: weddellite ) a trihydrát (minerál: caoxit ) jsou také uznávány. Oxaláty vápníku jsou hlavní složkou člověka ledvinové kameny. Šťavelan vápenatý se také nachází v pivní kameni, měřítku, které se tvoří na nádobách používaných v pivovary.
Výskyt
Mnoho rostlin akumuluje oxalát vápenatý, jak bylo popsáno u více než 1000 různých rodů rostlin.[2] Akumulace oxalátu vápenatého souvisí s detoxikací vápníku (Ca2+) v rostlině.[3]
The jedovatý zasadit hloupou hůl (Dieffenbachia ) obsahuje látku a při požití může zabránit řeči a dusit se. To je také nalezené v šťovík, rebarbora (ve velkém množství v listech), skořice, kurkuma a druhy Oxalis, Araceae, Arum italicum, taro, kiwi, čaj listy, agáve, Liána virginská (Parthenocissus quinquefolia ), a Alocasia a v špenát v různých množstvích. Rostliny rodu Filodendron obsahují dostatek šťavelanu vápenatého, takže konzumace částí rostliny může mít za následek nepříjemné příznaky. Nerozpustné krystaly oxalátu vápenatého se nacházejí ve stoncích, kořenech a listech rostlin a produkují se v nich idioblasty.
Šťavelan vápenatý jako „pivní kámen“ je nahnědlá sraženina, která má tendenci se hromadit v kádích, sudech a jiných nádobách používaných v vaření z pivo. Pokud není odstraněn během čisticího procesu, pivní kámen zanechá nehygienický povrch, který může obsahovat mikroorganismy.[4] Pivní kámen se skládá z vápenatých a hořečnatých solí a různých organických sloučenin, které zbyly z procesu vaření; podporuje růst nežádoucích mikroorganismů, které mohou nepříznivě ovlivnit nebo dokonce zničit chuť šarže piva.
Krystaly oxalátu vápenatého v moči jsou nejčastější složkou člověka ledvinové kameny a tvorba krystalů oxalátu vápenatého je také jedním z toxických účinků otrava ethylenglykolem.
Chemické vlastnosti
Šťavelan vápenatý je kombinací iontů vápníku a konjugované báze kyselina šťavelová oxalátový anion. Vodný roztok je mírně zásaditý, kvůli zásaditosti oxalátového iontu. Jeho základnost je slabší než šťavelan sodný, kvůli rozpustnosti sloučeniny.
Lékařský význam
Šťavelan vápenatý může při požití způsobit vředy a otupělost a může být dokonce smrtelný.
Morfologie a diagnostika
Monohydrát a dihydrát lze rozlišit podle tvaru příslušných krystalů.
- Šťavelan vápenatý dihydrát krystaly jsou osmistěn. Velká část krystalů v močovém sedimentu bude mít tento typ morfologie, protože mohou růst při jakémkoli pH a přirozeně se vyskytují v normální moči.
- Šťavelan vápenatý monohydrát krystaly se liší ve tvaru a mohou být tvarovány jako činky, vřetena, ovály nebo plotové ploty, z nichž poslední je nejčastěji vidět kvůli otrava ethylenglykolem.[5]

Mikroskopie moči ukazující krystaly oxalátu vápenatého v moči. The osmistěn krystalická morfologie je jasně viditelná.

Mikroskopie moči ukazující a monohydrát oxalátu vápenatého krystal (ve tvaru činky) a a dihydrát oxalátu vápenatého krystal (ve tvaru obálky) spolu s několika erytrocyty.

Mikroskopie moči ukazuje několik monohydrát oxalátu vápenatého krystaly (ve tvaru činky, některé shlukové) a a dihydrát oxalátu vápenatého krystal (ve tvaru obálky) spolu s několika erytrocyty.
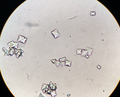
Močový sediment ukazující několik krystalů oxalátu vápenatého. 40X
Ledvinové kameny
Asi 80% ledvinových kamenů je částečně nebo zcela typu oxalátu vápenatého. Vznikají, když je moč trvale nasycena vápníkem a oxalátem. Část šťavelanu v moči je produkována tělem. Vápník a šťavelan ve stravě hrají roli, ale nejsou jedinými faktory, které ovlivňují tvorbu kamenů šťavelanu vápenatého. Oxalát v potravě je organický iont nacházející se v mnoha druzích zeleniny, ovoce a ořechů. Vápník z kostí může také hrát roli při tvorbě ledvinových kamenů.
Průmyslové aplikace
Šťavelan vápenatý se používá při výrobě keramických glazur.[6]
Viz také
Reference
- ^ A b S. Deganello (1981). „Struktura Whewellitu, CaC2Ó4.H2O, při 328 K ". Acta Crystallogr. B. 37 (4): 826–829. doi:10.1107 / S056774088100441X.
- ^ Francesci, V.R .; Nakata (2005). "Šťavelan vápenatý v rostlinách: tvorba a funkce". Annu Rev Plant Biol. 56 (56): 41–71. doi:10.1146 / annurev.arplant.56.032604.144106.
- ^ Martin, G; Matteo Guggiari; Daniel Bravo; Jakob Zopfi; Guillaume Cailleau; Michel Aragno; Daniel Job; Eric Verrecchia; Pilar Junier (2012). „Houby, bakterie a pH půdy: oxalát – karbonátová cesta jako model metabolické interakce“. Mikrobiologie prostředí. 14 (11): 2960–2970. doi:10.1111 / j.1462-2920.2012.02862.x. PMID 22928486.
- ^ Ryan, James (27. května 2018). „Co je to beerstone (a jak jej odstranit)“. Citováno 28. května 2018.
- ^ "Krystaly moči". ahdc.vet.cornell.edu/. Cornell University. Citováno 12. července 2014.
- ^ "Datový list oxalátu vápenatého". Hummel Croton Inc.. Citováno 23. dubna 2017.







