Fosforečnan vápenatý - Dicalcium phosphate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC hydrogenfosforečnan vápenatý | |
| Ostatní jména hydrogenfosforečnan vápenatý, vápenatá sůl kyseliny fosforečné (1: 1) | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.028.933 |
| Číslo E. | E341 (ii) (antioxidanty, ...) |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CaHPO4 | |
| Molární hmotnost | 136,06 g / mol (bezvodý) 172,09 (dihydrát) |
| Vzhled | bílý prášek |
| Zápach | bez zápachu |
| Hustota | 2,929 g / cm3 (bezvodý) 2,31 g / cm3 (dihydrát) |
| Bod tání | rozkládá se |
| 0,02 g / 100 ml (bezvodý) 0,02 g / 100 ml (dihydrát) | |
| Struktura | |
| triclinic | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný anionty | Pyrofosforečnan vápenatý |
jiný kationty | Fosforečnan hořečnatý Monokalciumfosfát Fosforečnan trivápenatý Fosforečnan strontnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fosforečnan vápenatý je fosforečnan vápenatý se vzorcem CaHPO4 a jeho dihydrát. Předpona „di“ v obecném názvu vzniká z důvodu vzniku HPO42– anion zahrnuje odstranění dvou protonů z kyselina fosforečná, H3PO4. Je také známý jako hydrogenfosforečnan vápenatý nebo monohydrogenfosforečnan vápenatý. Fosforečnan vápenatý se používá jako a potravinářská přídatná látka, to je nalezené v některých zubní pasty jako leštění agent a je biomateriál.[1][2]
Příprava
Dibázický fosforečnan vápenatý se vyrábí neutralizací hydroxid vápenatý s kyselina fosforečná, který vysráží dihydrát ve formě pevné látky. Při 60 ° C se vysráží bezvodá forma:[3]
- H3PO4 + Ca (OH)2 → CaHPO4
Aby se zabránilo degradaci, která by se vytvořila hydroxyapatit, pyrofosforečnan sodný nebo oktahydrát fosforečnanu horečnatého se přidávají, když se například jako leštidlo v zubní pastě použije dihydrát hydrogenfosforečnanu vápenatého.[1]
V nepřetržitém procesu CaCl2 lze léčit (NH4)2HPO4 za vzniku dihydrátu:
- CaCl2 + (NH4)2HPO4 → CaHPO4• 2H2Ó
Suspenze dihydrátu se poté zahřeje na přibližně 65–70 ° C za vzniku bezvodého CaHPO4 jako krystalická sraženina, typicky jako ploché krystaly diamantoidu, které jsou vhodné pro další zpracování.[4]
Dihydrát dihydrogenfosforečnanu vápenatého se tvoří v „kartáčových“ cementech na bázi fosforečnanu vápenatého (CPC), které mají lékařské použití. Příklad reakce celkového nastavení při tvorbě „β-TCP / MCPM“ (β-fosforečnan vápenatý /monocalcium fosfát ) cementy na bázi fosforečnanu vápenatého jsou:[5]
- Ca.3(PO4)2 + Ca (H2PO4)2• H2O + 7 H2O → 4 CaHPO4• 2H2Ó

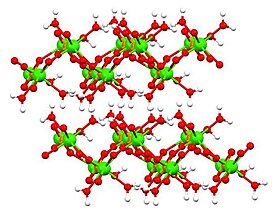
Struktura
Jsou známy tři (3) formy fosforečnanu vápenatého:
- dihydrát, CaHPO4• 2H2O („DPCD“), minerál kartáč
- monohydrát, CaHPO4• H2O ('DCPM')
- bezvodý CaHPO4(„DCPA“), minerál monetit. Pod pH 4,8 jsou nejstabilnější (nerozpustné) fosforečnany vápenaté dihydrátové a bezvodé formy fosforečnanu vápenatého.
Struktura bezvodých a dihydrátových forem byla stanovena pomocí Rentgenová krystalografie a struktura monohydrátu byla určena pomocí elektronová krystalografie. Dihydrát[6] (zobrazené v tabulce výše) a také monohydrát[7] přijmout vrstvené struktury.
Použití a výskyt
Dibázický fosforečnan vápenatý se používá hlavně jako a doplněk stravy v připravených snídaňových cereáliích, pamlskech pro psy, obohacené mouce a nudlích. Používá se také jako tabletovací prostředek v některých farmaceutických přípravcích, včetně některých produktů určených k eliminaci tělesný zápach. Dibázický fosforečnan vápenatý se také nachází v některých doplňcích vápníku ve stravě (např. Bonexcin). Používá se jako krmivo pro drůbež. Používá se také v některých zubních pastách jako a zubní kámen kontrolní agent.[8]
Ohřev fosforečnanu vápenatého dává difosforečnan vápenatý, užitečné leštidlo:
- 2 CaHPO4 → Ca2P2Ó7 + H2Ó
Ve formě dihydrátu (kartit) se nachází v některých ledvinové kameny a v zubní kameny.[9][3]
Viz také
Reference
- ^ A b Corbridge, D. E. C. (1995). "Fosfáty". Fosfor - nástin jeho chemie, biochemie a použití. Studium v anorganické chemii. 20. 169–305. doi:10.1016 / B978-0-444-89307-9.50008-8. ISBN 9780444893079.
- ^ Salinas, Antonio J .; Vallet-Regí, María (2013). „Bioaktivní keramika: Od kostních štěpů po tkáňové inženýrství“. RSC zálohy. 3 (28): 11116. doi:10.1039 / C3RA00166K.
- ^ A b Rey, C .; Combes, C .; Drouet, C .; Grossin, D. (2011). „Bioaktivní keramika: fyzikální chemie“. Komplexní biomateriály. 187–221. doi:10.1016 / B978-0-08-055294-1.00178-1. ISBN 9780080552941.
- ^ Ropp, R.C. (2013). „Skupina 15 (N, P, As, Sb a Bi) sloučeniny alkalických zemin“. Encyklopedie sloučenin alkalické Země. 199–350. doi:10.1016 / B978-0-444-59550-8.00004-1. ISBN 9780444595508.
- ^ Tamimi, Faleh; Šejk, Zeeshan; Barralet, Jake (2012). "Cementy na bázi fosforečnanu vápenatého: brushit a monetit". Acta Biomaterialia. 8 (2): 474–487. doi:10.1016 / j.actbio.2011.08.005. PMID 21856456.
- ^ Curry, N. A .; Jones, D. W. (1971). „Krystalová struktura kartitu, dihydrátu hydrogenfosforečnanu vápenatého: neutronový difrakční výzkum“. Journal of the Chemical Society A: Anorganic, Physical, Theoretical: 3725. doi:10.1039 / J19710003725.
- ^ Lu, Bing-Qiang; Willhammar, Tom; Slunce, Ben-Ben; Hedin, Niklas; Gale, Julian D .; Gebauer, Denis (2020-03-24). „Představujeme krystalickou fázi monohydrátu fosforečnanu vápenatého“. Příroda komunikace. 11 (1): 1546. Bibcode:2020NatCo..11.1546L. doi:10.1038 / s41467-020-15333-6. ISSN 2041-1723. PMC 7093545. PMID 32210234.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Kyselina fosforečná a fosfáty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ Pak, Charles Y.C; Poindexter, John R .; Adams-Huet, Beverley; Pearle, Margaret S. (2003). „Prediktivní hodnota složení ledvinových kamenů při detekci metabolických abnormalit“. American Journal of Medicine. 115 (1): 26–32. doi:10.1016 / S0002-9343 (03) 00201-8. PMID 12867231.

