Kyanid vápenatý - Calcium cyanide - Wikipedia
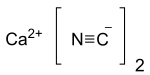 | |
| Jména | |
|---|---|
| Název IUPAC dikyanid vápenatý | |
| Systematický název IUPAC dikyanid vápenatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.856 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Ca (CN)2 | |
| Molární hmotnost | 92,1 128 g / mol |
| Vzhled | bílý prášek |
| Zápach | kyanovodík |
| Hustota | 1,853 (20 ° C) |
| Bod tání | 640 ° C (1184 ° F; 913 K) (rozkládá se) |
| rozpustný | |
| Rozpustnost | rozpustný v alkohol, slabé kyseliny |
| Struktura | |
| rhombohedric | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Nehořlavé | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyanid vápenatý také známý jako černý kyanid,[2] je vápník sůl z kyanid, an anorganická sloučenina s vzorec Ca (CN)2. Čistá forma je bílá pevná látka, i když jen zřídka pozorovaná; komerční vzorky mohou být černošedé. To hydrolyzuje snadno (i v vlhký vzduch ) k uvolnění kyanovodíku. Stejně jako ostatní podobné kyanidy je to velmi toxický.[3]
Příprava
Kyanid vápenatý lze připravit zpracováním v prášku oxid vápenatý s varem bezvodý kyselina kyanovodíková v přítomnosti akcelerátoru, jako je amoniak nebo voda, aby se minimalizoval úbytek kyseliny kyanovodíkové o polymerizace. Může být také připraven reakcí kapalné kyseliny kyanovodíkové s karbid vápníku. Alternativně může být kyanid vápenatý připraven reakcí plynu kyseliny kyanovodíkové s páleným vápnem (CaO) při vysokých teplotách kolem 400 ° C. Při vyšších teplotách kolem 600 ° C vápník kyanimid místo toho se tvoří.[4] Připravený materiál je často kontaminován polymerními deriváty kyanovodíku, proto černá barva.
Reaktivita
Kyanid vápenatý hydrolyzuje snadno za vzniku plynného kyanovodíku. Přítomnost někoho kyselina zrychlený vývoj kyanovodík plyn. Je reaktivní vůči oxidační činidla. Kyanid vápenatý se také někdy používá k výrobě kyanid amonný reakcí s uhličitan amonný.
- Ca (CN) 2 + (NH 4)2CO3 → 2 NH 4CN + CaCO3
Použití
Kyanid vápenatý se používá téměř výlučně v těžebním průmyslu. Slouží jako levný zdroj kyanid při mnoha louženích nebo při čištění kádě za účelem získání drahých kovů, jako jsou zlato a stříbrný z jejich rud.[5] Dělá to formováním koordinační komplexy s kovy, které je oddělují od rudy.[6]Je distribuován buď ve formě pevných vloček nebo v kapalné formě.[5] Vysoká toxicita kyanidu vápenatého při dotyku, vdechování nebo požití je užitečná jako rodenticid. Například se používá při řízení populace indických chocholatých dikobrazů (Hystrix indica ).[7] Jeho toxicita byla podobně využívána jako insekticid.[8] Jeho vysoká toxicita je však v mnoha případech nepříznivá a místo toho se často používají jiné méně škodlivé chemikálie.[7] Používá se také při výrobě kyanovodík, kyanid amonný, a ferokyanidy.
Bezpečnost
Stejně jako ostatní kyanidové soli je tato sloučenina vysoce toxická a její použití je přísně regulováno.
Reference
- ^ http://cameochemicals.noaa.gov/chemical/2775
- ^ . „Kyanid vápenatý.“ Slovník Merriam-Webster. 2001. http://www.merriam-webster.com/dictionary/calcium%20cyanide (zpřístupněno 22. dubna 2012).
- ^ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo a Manfred Sauer „Cyano Compounds, Anorganic“ Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. doi:10.1002 / 14356007.a08_159.pub2
- ^ . „Výroba kyseliny kyanovodíkové“ Patentový úřad Spojených států. 1933. (zpřístupněno 22. dubna 2012).
- ^ A b „Využití kyanidu pro průmysl zlata“ Mezinárodní kodex pro správu kyanidů pro použití kyanidu ve zlatě. 2011. http://www.cyanidecode.org/cyanide_use.php (zpřístupněno 22. dubna 2012).
- ^ . "koordinační sloučenina" Encyklopedie Britannica. Encyklopedie Britannica Online akademické vydání. 2012. http://www.britannica.com/EBchecked/topic/136410/coordination-compound.
- ^ A b . "Hodnocení fumigace fosfidu hlinitého pro kontrolu dikobraza chocholatého (Hystrix indica) v křovinách *. 2008.
- ^ . "KYANID VÁPENATÝ PRO KONTROLU CHINCH BUG" UNIVERSITY OF ILLINOIS Agricultural Experiment Station. 1924.

