Vanadyl sulfát - Vanadyl sulfate - Wikipedia
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Oxovanad (2+) sulfát | |
| Ostatní jména Základní síran vanadičitý Síran oxidu vanadičitého Oxysulfát vanadičitý | |
| Identifikátory | |
| |
| Informační karta ECHA | 100.044.214 |
PubChem CID | |
| Číslo RTECS |
|
| UNII |
|
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| H10Ó10SPROTI | |
| Molární hmotnost | 253.07 g · mol−1 |
| Vzhled | Modrá pevná látka |
| Bod tání | 105 ° C (221 ° F; 378 K) se rozkládá |
| Rozpustný | |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý |
| Bod vzplanutí | Nehořlavý |
| Související sloučeniny | |
jiný anionty | Vanadylchlorid Vanadyl dusičnan |
jiný kationty | Síran vanadičitý |
Související sloučeniny | Vanadylacetylacetonát |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
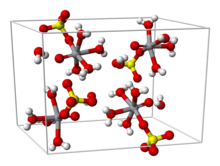
Vanadyl (IV) sulfát popisuje sbírku anorganické sloučeniny vanadu se vzorcem, VOSO4(H2Ó)X kde 0 ≤ x ≤ 6. Pentahydrát je běžný. Tato hygroskopická modrá pevná látka je jedním z nejběžnějších zdrojů vanadium v laboratoři, což odráží jeho vysokou stabilitu. Je vybaven vanadyl ion, VO2+, který byl volán the "nejstabilnější dvojatomový iont".[1]
Vanadyl sulfát je meziproduktem při extrakci vanadu z ropných zbytků, což je jeden z komerčních zdrojů vanadu.[2]
Syntéza, struktura a reakce
Vanadyl sulfát se nejčastěji získává redukcí oxid vanadičitý s oxid siřičitý:
- PROTI2Ó5 + 7 hodin2O + SO2 + H2TAK4 → 2 [V (O) (H2Ó)4]TAK4
Z vodného roztoku sůl krystaluje jako pentahydrát pátá voda není vázána na kov v pevné látce. Zobrazeno jako koordinační komplex, iont je osmistěn, s oxo, čtyřmi rovníkovými vodními ligandy a síranem monodentátovým.[1][3] Trihydrát byl také zkoumán krystalografií.[4] Hexahydrát existuje pod 13,6 ° C (286,8 K).[5] Dva polymorfy bezvodého VOSO4 jsou známy.[6]
Vzdálenost vazby V = O je 160odpoledne, asi o 50 hodin kratší než V – OH2 vazby. V roztoku se sulfátový ion rychle disociuje.
Protože je široce dostupný, je vanadylsulfát běžným předchůdcem jiných derivátů vanadylu, jako je např vanadylacetylacetonát:[7]
- [V (O) (H2Ó)4]TAK4 + 2 C5H8Ó2 + Na2CO3 → [V (O) (C5H7Ó2)2] + Na2TAK4 + 5 hodin2O + CO2
V kyselém roztoku poskytuje oxidace vanadylsulfátu žlutě zbarvené deriváty vanadylu (V). Redukce, např. podle zinek, dává deriváty vanadu (III) a vanadu (II), které jsou charakteristicky zelené a fialové.
Výskyt v přírodě
Jako většina ve vodě rozpustných síranů se vanadylsulfát v přírodě vyskytuje jen zřídka. Bezvodou formou je pauflerit,[8] minerál z fumarolický původ. Hydratované formy, také vzácné, zahrnují hexahydrát (stanleyit), pentahydráty (minasragrit, orthominasragrit,[9] a anorthominasragrit) a trihydrát - bobjonesit.[10]
Lékařský výzkum
Vanadyl sulfát je součástí doplňků stravy a experimentálních léků. Vanadylsulfát vykazuje účinky podobné inzulínu.[11]
Vanadyl sulfát byl rozsáhle studován v oblasti cukrovka výzkum jako potenciální prostředek zvyšování inzulín citlivost. Žádný důkaz nenaznačuje, že perorální suplementace vanadem zlepšuje kontrolu glykemie.[12][13] Léčba vanadem často vede především k gastrointestinálním vedlejším účinkům průjem.
Vanadyl sulfát se také prodává jako doplněk zdraví, často pro kulturistika. Nedostatky vanadu mají za následek snížený růst potkanů.[14] Jeho účinnost pro kulturistiku nebyla prokázána; některé důkazy naznačují, že sportovci, kteří to užívají, pouze zažívají a placebo efekt.[15]
Reference
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1984). Chemie prvků. Oxford: Pergamon Press. str. 1157. ISBN 978-0-08-022057-4.
- ^ Günter Bauer, Volker Güther, Hans Hess, Andreas Otto, Oskar Roidl, Heinz Roller, Siegfried Sattelberger (2005). "Vanad a sloučeniny vanadu". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a27_367. ISBN 3527306730.CS1 maint: používá parametr autoři (odkaz)
- ^ Tachez, M .; Theobald, F.R. (1980). "Struktura du Sulfate de Vanadyle Pentahydrát VO (H2Ó)5TAK4 beta (variete orthorhombique) ". Acta Crystallographica B. B36: 1757 – p1761. doi:10.1107 / S0567740880007170.CS1 maint: používá parametr autoři (odkaz)
- ^ Tachez, M .; Theobald, F. R. (1980). „Liaisons hydrogene dans les cristaux de sulfate de vanadyle trihydrát VOSO4(H2Ó)3: Comparaison structurale de quatre sulfates de vanadylehydrát ". Acta Crystallographica B. 36: 2873–2880. doi:10.1107 / S056774088001045X.CS1 maint: používá parametr autoři (odkaz)
- ^ M. Tachez, F. Theobald, G. Trouillot. Krystalová data pro hexahydrát vanadylsulfátu VOSO4.6H2O. J. Appl. Cryst. (1976). 9, 246
- ^ Boghosian, S .; Eriksen, K.M .; Fehrmann, R .; Nielsen, K. (1995). „Syntéza, nové určení krystalové struktury a vibrační spektrum beta-VOSO4". Acta Chemica Scandinavica. 49: 703–708. doi:10,3891 / acta.chem.scand.49-0703.CS1 maint: používá parametr autoři (odkaz)Longo, J. M .; Arnott, R. J. (1970). "Struktura a magnetické vlastnosti VOSO4". Journal of Solid State Chemistry. 1 (3–4): 394 – p398. Bibcode:1970JSSCh ... 1..394L. doi:10.1016/0022-4596(70)90121-0.CS1 maint: používá parametr autoři (odkaz)
- ^ Bryant, Burl E .; Fernelius, W. Conard (1957), „Vanad (IV) Oxy (acetylacetonát)“, Inorg. Synth. Anorganické syntézy, 5: 113–16, doi:10.1002 / 9780470132364.ch30, ISBN 9780470132364
- ^ Krivovichev, S. V .; Vergasová, L. P .; Britvin, S. N .; Filatov, S. K .; Kahlenberg, V .; Ananiev, V. V. (1. srpna 2007). „Pauflerite, -VO (SO4), nový minerální druh ze sopky Tolbachik, poloostrov Kamčatka, Rusko “. Kanadský mineralog. 45 (4): 921–927. doi:10,2113 / gscanmin. 45.4.921.
- ^ Hawthorne, F. C .; Schindler, M .; Grice, J. D .; Haynes, P. (1. října 2001). „Orthominasragrite, V4+O (SO4) (H2Ó)5„Nový minerální druh z Temple Mountain, Emery County, Utah, U.A.A.“. Kanadský mineralog. 39 (5): 1325–1331. doi:10,2113 / gscanmin. 39.5.1325.
- ^ Schindler, M .; Hawthorne, F. C .; Huminicki, D. M.C .; Haynes, P .; Grice, J. D .; Evans, H. T. (1. února 2003). „Bobjonesite, V4 + O (So4) (H2O) 3, A New Mineral Species from Temple Mountain, Emery County, Utah, U.s.a.“. Kanadský mineralog. 41 (1): 83–90. doi:10,2113 / gscanmin.41.1.83.
- ^ Crans, D. C .; Trujillo, A. M .; Pharazyn, P. S .; Cohen, M. D. (2011). „Jak životní prostředí ovlivňuje aktivitu léčiv: Lokalizace, rozčlenění a reakce sloučeniny zvyšující hladinu vanadového inzulínu, dipikolinatooxovanadu (V)“. Coord. Chem. Rev. 255 (19–20): 2178–2192. doi:10.1016 / j.ccr.2011.01.032.
- ^ Yeh, Gloria Y .; Eisenberg, David M .; Kaptchuk, Ted J .; Phillips, Russell S. (2003). "Systematický přehled bylin a doplňků stravy pro kontrolu glykémie u diabetu". Péče o cukrovku. 26 (4): 1277–1294. doi:10.2337 / diacare.26.4.1277. PMID 12663610.
- ^ Smith, D.M .; Pickering, R.M .; Lewith, G.T. (31. ledna 2008). „Systematický přehled orálních doplňků vanadu pro kontrolu glykemie u diabetes mellitus 2. typu“. QJM. 101 (5): 351–358. doi:10.1093 / qjmed / hcn003. PMID 18319296.
- ^ Schwarz, Klaus; Milne, David B. (1971). "Růstové účinky vanadu u krysy". Věda. 174 (4007): 426–428. Bibcode:1971Sci ... 174..426S. doi:10.1126 / science.174.4007.426. JSTOR 1731776. PMID 5112000. S2CID 24362265.
- ^ Talbott, Shawn M .; Hughes, Kerry (2007). "Vanadium". Průvodce zdravotnickými pracovníky po doplňcích stravy. Lippincott Williams & Wilkins. 419–422. ISBN 978-0-7817-4672-4.
