Rubidium hydrogensíran - Rubidium hydrogen sulfate
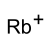 rubidiový ion | |
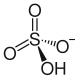 ion hydrogensíranu | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.036.029 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| RbHSO4 | |
| Molární hmotnost | 182,54 g / mol−1 |
| Vzhled | Krystaly bez barvy[1] |
| Hustota | 2,89 g · cm−3 |
| Bod tání | 214 ° C (417 ° F; 487 K)[2] |
| Související sloučeniny | |
jiný kationty | oxid rubidnatý hydroxid rubidný |
Související sloučeniny | sulfid rubidnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Rubidium hydrogensíran je rubidium sůl z kyselina sírová. Má vzorec RbHSO4.
Syntéza
Může být syntetizován s vodou a stechiometrickým množstvím disulfát rubidia. Reakce probíhá tam, kde není vlhkost:[3]
Existuje další způsob stvoření. Je to podobné jako syntéza síran sodný a síran draselný. Tato reakce vyžaduje chlorid rubidný a trochu teplé kyseliny sírové. Nějaký chlorovodík během reakce se také vytváří.
Vlastnosti
Je to hygroskopický sloučenina. Má to monoklinický krystalová struktura, její struktura je P21/ n. Rozměry jednotkové buňky jsou: a = 1440 pm, b = 462,2 pm, c = 1436 pm a β = 118,0 °. Jeho krystaly jsou izomorfy s hydrogensíran amonný krystaly.[4]
Své standardní entalpie je -1166 kJ / mol.[5] Během jeho rozpouštění ve vodě vzniká 15,62 kJ / mol energie.[6]
Po zahřátí se rozloží na disulfát rubidia a voda:[7]
Jako draslík a cesium, rubidium má také další sloučeninu hydrogensíranu: Rb3H (SO4)2.
Reference
- ^ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, skupina 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 692 (Taschenbuch für Chemiker und Physiker, str. 692, v Knihy Google ).
- ^ R. Fehrmann, S. Boghosian, H. Hamma-Cugny, J. Rogez: „Fázové diagramy, strukturní a termodynamické vlastnosti roztavených solných rozpouštědel pro průmyslové SO2-oxidační katalyzátor " Abstraktní
- ^ S. B. Rasmussen, H. Hamma, K. M. Eriksen, G. Hatem, M. Gaune-Escard, R. Fehrmann: „Fyzikálně-chemické vlastnosti a tvorba komplexu přechodného kovu v taveninách alkalických pyrosulfátů a hydrogensíranů“. VII Mezinárodní konference o tokech a solích roztavené strusky, Jihoafrický institut pro těžbu a metalurgii, 2004. Volltext (PDF; 661 kB)
- ^ J. P. Ashmore, H. E. Petch: „Struktura RbHSO4 ve své paraelektrické fázi "v Umět. J. Phys 1975, 53(24), S. 2694-2702. doi:10.1139 / p75-328
- ^ L. A. Cowan, R. M. Morcos, N. Hatada, A. Navrotsky, S. M. Haile: „Vysokoteplotní vlastnosti Rb3H (SO4)2 při okolním tlaku: Absence polymorfního, superprotonického přechodu "v Ionika v pevné fázi 2008, 179, S. 305-313. Volltext (PDF; 837 kB)
- ^ M. de Forcrand: "Sur les chlorures et sulfates de rubidium et de cesium" v Compt. Vykreslit. Hebd. 1906, 143, S. 98. Volltext
- ^ R. Abegg, F. Auerbach: „Handbuch der anorganischen Chemie“. Verlag S. Hirzel, Bd. 2, 1908. S. 432.Volltext



