Acetylaceton - Acetylacetone
 | |||
| |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Pentan-2,4-dion | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 741937 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.004.214 | ||
| Číslo ES |
| ||
| 2537 | |||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 2310 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H8Ó2 | |||
| Molární hmotnost | 100.117 g · mol−1 | ||
| Hustota | 0,975 g / ml[1] | ||
| Bod tání | −23 ° C (−9 ° F; 250 K) | ||
| Bod varu | 140 ° C (284 ° F; 413 K) | ||
| 16 g / 100 ml | |||
| -54.88·10−6 cm3/ mol | |||
| Nebezpečí | |||
| Piktogramy GHS |     | ||
| Signální slovo GHS | Nebezpečí | ||
| H226, H302, H311, H320, H331, H335, H341, H370, H402, H412 | |||
| P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P281, P301 + 312, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P307 + 311, P308 + 313, P311, P312 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 34 ° C (93 ° F; 307 K) | ||
| 340 ° C (644 ° F; 613 K) | |||
| Výbušné limity | 2.4–11.6% | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Acetylaceton je organická sloučenina se vzorcem CH3COCH2COCH3. Je to bezbarvá kapalina, klasifikovaná jako 1,3-diketon. Existuje v rovnováze s a tautomer CH3C (O) CH = C (OH) CH3. Tyto tautomery se za většiny podmínek tak rychle přeměňují, že se s nimi ve většině aplikací zachází jako s jedinou sloučeninou.[2] Jedná se o bezbarvou kapalinu, která je předchůdcem acetylacetonátového aniontu (obvykle zkráceně) acac−), a bidentate ligand. Je také stavebním kamenem pro syntézu heterocyklické sloučeniny.
Vlastnosti
Tautomerismus
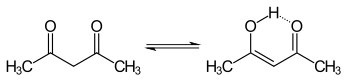
The keto a enol tautomery acetylacetonu koexistují v roztoku. Enolová forma má C2v symetrie, což znamená, že atom vodíku je sdílen rovnoměrně mezi dvěma atomy kyslíku.[3] V plynné fázi je rovnovážná konstanta, K.keto → enol, je 11,7, přičemž upřednostňuje formu enol. Tyto dvě tautomerní formy lze rozlišit podle NMR spektroskopie, IR spektroskopie a další metody.[4][5]
| Solventní | K.keto → enol |
|---|---|
| Plynná fáze | 11.7 |
| Cyklohexan | 42 |
| Toluen | 10 |
| THF | 7.2 |
| DMSO | 2 |
| Voda | 0.23 |
Rovnovážná konstanta má tendenci být vysoká v nepolárních rozpouštědlech; keto forma se stává příznivější v polárních rozpouštědlech vázajících vodík, jako je voda.[6] Enolová forma je a vinylogický analogie a karboxylová kyselina.
Acidobazické vlastnosti
| solventní | T / ° C | strK.A[7] |
|---|---|---|
| 40% ethanol /voda | 30 | 9.8 |
| 70% dioxan /voda | 28 | 12.5 |
| 80% DMSO /voda | 25 | 10.16 |
| DMSO | 25 | 13.41 |
Acetylaceton je a slabá kyselina:
- C5H8Ó2 ⇌ C
5H
7Ó−
2 + H+
IUPAC doporučeno strK.A hodnoty této rovnováhy ve vodném roztoku při 25 ° C jsou 8,99 ± 0,04 (Já = 0), 8.83 ± 0.02 (Já = 0,1 M NaClO4) a 9,00 ± 0,03 (Já = 1,0 M NaClO4; Já = Iontová síla ).[8] K dispozici jsou hodnoty pro směsná rozpouštědla. Velmi silné základy, jako např organolithium sloučeniny, bude deprotonovat acetylaceton dvakrát. Výsledné dilithio druhy pak mohou být alkylovány na C-1.
Příprava
Acetylaceton se průmyslově připravuje tepelným přesmykem sloučeniny isopropenylacetát.[9]
- CH2(CH3) COC (O) Me → MeC (O) CH2Přijít
Laboratorní cesty k acetylacetonu začínají také na aceton. Aceton a anhydrid kyseliny octové po přidání fluorid boritý (BF3) katalyzátor:[10]
- (CH3CO)2O + CH3C (O) CH3 → CH3C (O) CH2C (O) CH3
Druhá syntéza zahrnuje bazicky katalyzovanou kondenzaci acetonu a ethylacetát, následované okyselením:[10]
- NaOEt + EtO2CCH3 + CH3C (O) CH3 → NaCH3C (O) CHC (O) CH3 + 2 EtOH
- NaCH3C (O) CHC (O) CH3 + HCl → CH3C (O) CH2C (O) CH3 + NaCl
Kvůli snadnosti těchto syntéz je známo mnoho analogů acetylacetonátů. Některé příklady zahrnují C6H5C (O) CH2C (O) C6H5 (dbaH) a (CH3)3CC (O) CH2C (O) CC (CH3)3. Hexafluoroacetylacetonát je také široce používán pro generování komplexů těkavých kovů.
Reakce
Kondenzace
Acetylaceton je všestranný bifunkční předchůdce heterocyklů, protože obě keto skupiny procházejí kondenzace. Hydrazin reaguje na produkci pyrazoly. Močovina dává pyrimidiny. Kondenzací se dvěma aryl- a alkylaminy se získá NacNacs, kde atomy kyslíku v acetylacetonu jsou nahrazeny NR (R = aryl, alkyl).
Koordinační chemie

Acetylacetonát anion, acac−, tvoří komplexy s mnoha přechodový kov ionty. Obecnou metodou syntézy je zpracování kovové soli s acetylacetonem v přítomnosti a základna:[11]
- MBz + z Hacac ⇌ M (acac)z + z BH
Oba atomy kyslíku se vážou na kov a tvoří šestičlenný chelátový kruh. V některých případech chelátový efekt je tak silná, že k vytvoření komplexu není potřeba žádná přidaná báze.
Biologický rozklad
Enzym acetylaceton dioxygenáza štěpí vazbu uhlík-uhlík acetylacetonu za vzniku acetátu a 2-oxopropanal. Enzym je závislý na železu (II), ale bylo prokázáno, že se váže také na zinek. V bakterii byla charakterizována degradace acetylacetonu Acinetobacter johnsonii.[12]
- C5H8Ó2 + O.2 → C.2H4Ó2 + C.3H4Ó2
Reference
- ^ "05581: acetylaceton". Sigma-Aldrich.
- ^ Thomas M. Harris (2001). „2,4-Pentandion“. 2,4-pentandion. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002 / 047084289X.rp030. ISBN 0471936235.
- ^ Caminati, W .; Grabow, J.-U. (2006). „C2v Struktura enolického acetylacetonu ". J. Am. Chem. Soc. 128 (3): 854–857. doi:10.1021 / ja055333g. PMID 16417375.
- ^ Manbeck, Kimberly A .; Boaz, Nicholas C .; Bair, Nathaniel C .; Sanders, Allix M. S .; Marsh, Anderson L. (2011). „Substituční účinky na keto – enolové rovnováhy pomocí NMR spektroskopie“. J. Chem. Educ. 88 (10): 1444–1445. Bibcode:2011JChEd..88,1444 mil. doi:10.1021 / ed1010932.
- ^ Yoshida, Z .; Ogoshi, H .; Tokumitsu, T. (1970). „Intramolekulární vodíková vazba v enol formě 3-substituovaného-2,4-pentandionu“. Čtyřstěn. 26 (24): 5691–5697. doi:10.1016/0040-4020(70)80005-9.
- ^ Reichardt, Christian (2003). Rozpouštědla a účinky rozpouštědel v organické chemii (3. vyd.). Wiley-VCH. ISBN 3-527-30618-8.
- ^ Databáze IUPAC SC Komplexní databáze publikovaných údajů o rovnovážných konstantách kovových komplexů a ligandů
- ^ Stary, J .; Liljenzin J. J. (1982). „Kritické hodnocení rovnovážných konstant zahrnujících acetylaceton a jeho kovové cheláty“ (PDF). Čistá a aplikovaná chemie. 54 (12): 2557–2592. doi:10.1351 / pac198254122557.
- ^ Siegel, Hardo; Eggersdorfer, Manfred (2002). "Ketony". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a15_077. ISBN 9783527306732.
- ^ A b C. E. Denoon, Jr. „Acetylaceton“. Organické syntézy.; Kolektivní objem, 3, str. 16
- ^ O'Brien, Briane. „Co (tfa)3 & Co (acac)3 leták" (PDF). Vysoká škola Gustava Adolfa.
- ^ Straganz, G.D .; Glieder, A .; Brecker, L .; Ribbons, D.W .; Steiner, W. (2003). „Enzym štěpící acetylaceton Dke1: nový enzym štěpící vazby C – C z Acinetobacter johnsonii". Biochem. J. 369 (3): 573–581. doi:10.1042 / BJ20021047. PMC 1223103. PMID 12379146.





