Toxin AB5 - AB5 toxin - Wikipedia
| Enterotoxin (OB-fold B podjednotka) | |
|---|---|
| Identifikátory | |
| Symbol | Enterotoxin |
| InterPro | IPR008992 |
| SCOP2 | 2 bos / Rozsah / SUPFAM |
AB5 toxiny jsou šestikomponentní protein komplexy vylučované jistými patogenní bakterie je známo, že způsobuje lidské nemoci, jako je cholera, úplavice, a hemolyticko-uremický syndrom. Jedna složka je známá jako A podjednotka a zbývajících pět složek jsou B podjednotky. Všechny tyto toxiny sdílejí podobnou strukturu a mechanismus pro vstup do cílených hostitelských buněk. Podjednotka B je odpovědná za vazbu na receptory otevřít cestu pro podjednotku A pro vstup do buňky. Podjednotka A je poté schopna používat svoji katalytické strojní zařízení k převzetí pravidelných funkcí hostitelské buňky.[1][2]
Rodiny



Existují čtyři hlavní rodiny toxinu AB5. Tyto rodiny se vyznačují sekvence jejich A (katalytické) podjednotky, stejně jako jejich katalytické schopnosti.[4]
Cholera toxin
Tato rodina je také známá jako Ct nebo Ctx a zahrnuje také tepelně labilní enterotoxin, známý jako LT.[5] Objev toxinu cholery mnozí připisují Dr. Sambhu Nath De. Provedl svůj výzkum v Kalkatě (nyní Kalkata ) jeho objev v roce 1959, ačkoli to bylo poprvé očištěno Robert Koch v roce 1883. Toxin cholery se skládá z proteinového komplexu, který je vylučován bakterií Vibrio cholerae.[6] Některé příznaky tohoto toxinu zahrnují chronické a rozšířené vodnaté průjem a dehydratace, která v některých případech vede ke smrti.
Pertussis toxin
Tato rodina je také známá jako Ptx a obsahuje toxin zodpovědný za Černý kašel. Toxin z černého kašle je vylučován gramnegativní bakterie, Bordetella pertussis. Černý kašel je velmi nakažlivý a případů ve Spojených státech i přes očkování pomalu přibývá.[7] Mezi příznaky patří paroxysmální kašel s černým nebo dokonce zvracením.[8] Bakterie Bordetella pertussis byl poprvé identifikován jako příčina černého kašle a izolován Jules Bordet a Octave Gengou ve Francii v roce 1900.[9] Toxin sdílí svůj mechanismus s toxinem cholery.[5]
ArtAB toxin z Salmonella enterica má komponenty podobné těm, které se nacházejí ve dvou různých rodinách: ArtA (Q404H4) podjednotka je homologní s pertusovým toxinem A, zatímco ArtB (Q404H3) podjednotka je homologní s subB i s proteiny nalezenými v jiných Salmonella kmeny. Podle pravidla třídění podle typu se jedná o toxin z rodiny Ptx.[10][4]
Shiga toxin
Shiga toxin, také známý jako Stx, je toxin, který se produkuje ve tvaru tyčinky Shigella dysenteriae a Escherichia coli (STEC). Potraviny a nápoje kontaminované těmito bakteriemi jsou zdrojem infekce a tím, jak se tento toxin šíří.[11] Mezi příznaky patří bolest břicha a vodnatý průjem. Těžké život ohrožující případy se vyznačují hemoragická kolitida (HC).[12] Objev shiga toxinu je připisován Dr. Kiyoshi Shiga v roce 1898.
Subtilázový cytotoxin
Tato rodina je také známá jako SubAB[4] a byl objeven v průběhu 90. let.[13] Je produkován kmeny STEC, které nemají místo zmírnění enterocytů (ZÁVĚTŘÍ),[14] a je známo, že způsobuje hemolyticko-uremický syndrom (HUS). Nazývá se subtilázový cytotoxin, protože jeho podjednotková sekvence A je podobná sekvenci podobnou subtiláze serinová proteáza v Bacillus anthracis. Některé příznaky způsobené tímto toxinem jsou pokles destička počítat v krvi nebo trombocytopenie, nárůst v bílých krvinek počítat nebo leukocytóza, a ledvin poškození buněk.[15]
Subtiláza cytotoxin A podjednotka (subA, Q6EZC2) je proteáza, o které je známo, že se štěpí vazebný imunoglobulinový protein (BiP), vedoucí k endoplazmatické retikulum stres a buněčná smrt. B podjednotky (subB, Q6EZC3) vázat na Kyselina N-glykolylneuraminová (Neu5Gc) glykany na buňkách s vysokou afinitou.[16] Jen subB je dostatečný k tomu, aby způsobil vakuolizaci buněk vero.[17] Neu5GC není vyroben člověkem, ale je získáván z potravinových zdrojů, jako je červené maso a mléčné výrobky, také časté zdroje infekcí STEC, do lidské střevní výstelky.[18]
Struktura
Kompletní toxinový komplex AB5 obsahuje šest proteinových jednotek. Pět jednotek má podobnou nebo identickou strukturu a tvoří podjednotku B. Poslední proteinová jednotka je jedinečná a je známá jako podjednotka A.


Podjednotka
Podjednotka A toxinu AB5 je část zodpovědná za katalýzu specifických cílů. U rodiny toxinů Shiga je podjednotka A hostitelem a Trypsin -citlivá oblast, která při štěpení vydává dvě fragmentované domény. Tato oblast dosud nebyla potvrzena pro ostatní rodiny toxinů AB5.[2] Obecně jsou dvě domény podjednotky A, pojmenované A1 a A2, spojeny pomocí a disulfidová vazba. Doména A1 (přibližně 22 kDa v toxinu cholery nebo tepelně labilních enterotoxinech) je součástí toxinu odpovědného za jeho toxické účinky. Doména A2 (přibližně 5 kDa v toxinu cholery nebo tepelně labilním enterotoxinu) poskytuje a nekovalentní vazba na podjednotku B přes centrální póry podjednotky B.[5] Řetězec A1 pro toxin cholery katalyzuje přenos ADP-ribóza z Nikotinamid adenin dinukleotid (NAD) do arginin nebo jiný guanidin sloučeniny využitím Faktory ADP-ribosylace (ARF). V nepřítomnosti argininu nebo jednoduchých guanidinových sloučenin byl toxin zprostředkován NAD + nukleosidáza (NADase) aktivita probíhá za použití vody jako a nukleofil.[19]
B podjednotka
B podjednotky tvoří pětičlenný nebo pentamerický kruh, kde jeden konec podjednotky A vstupuje do a je držen. Tento podjednotkový kruh B je také schopen vázat se na a receptor, obvykle glykoprotein nebo glykolipid,[5] na povrchu hostitelské buňky.[20] Bez podjednotek B nemá podjednotka A žádný způsob, jak se připojit nebo vstoupit do buňky, a tedy žádný způsob, jak uplatnit svůj toxický účinek. Cholera toxin, shiga toxin a toxin SubAB mají všechny B podjednotky, které jsou složeny z pěti identických proteinových složek, což znamená, že jejich B podjednotky jsou homopentamery. Pertusový toxin je odlišný, pokud je jeho pentamerní kruh tvořen čtyřmi různými proteinovými složkami, přičemž jedna ze složek se opakuje za vzniku heteropentameru.[5]
Mechanismy
Cholera toxin, pertussis toxin a shiga toxin mají všechny své cíle v cytosol buňky. Poté, co se jejich podjednotka B váže na receptory na povrchu buňky, je toxin obalen buňkou a transportován dovnitř buď skrz na klatrinech závislá endocytóza nebo na klatrinech nezávislá endocytóza.[21]
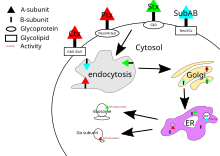
Pro toxin cholery hlavní glykolipid receptor pro toxin cholery je ganglioside GM1.[20] Po endocytóze do Golgiho aparát, toxin je přesměrován na endoplazmatické retikulum.[5] Aby podjednotka A dosáhla svého cíle, musí být přerušena disulfidová vazba mezi doménami A1 a A2. Toto poškození je katalyzováno a protein disulfid-izomeráza[22] to je v endoplazmatickém retikulu. Po oddělení se doména A1 rozloží a je přesměrována zpět do cytosolu, kde se znovu rozloží[5] a katalyzuje ADP-ribosylace jisté G protein alfa podjednotky. Přitom jsou vedlejší účinky G proteinu signální transdukční dráha je narušen[4] aktivací adenylátcykláza.[20] To způsobí vyšší koncentraci tábor v buňce, což narušuje regulaci iontových transportních mechanismů.[5]
Pertussis toxin nemá specifický receptor a váže se na sialylovaný glykoproteiny.[13] Po endocytóze je mechanismus toxinu černého kašle stejný jako toxin cholery.
Hlavním receptorem pro shiga toxin je globotriaosylceramid nebo Gb3.[23] Shiga toxin je také přiveden do golgiho aparátu, než je směrován do endoplazmatického retikula pro PDI za účelem štěpení disulfidové vazby. Podjednotka A Shiga toxinu je poté přivedena zpět do cytosolu a inhibuje syntézu eukaryotických proteinů RNA N-glykosidáza aktivita[4] štěpením specifické adeninové báze na 28S ribozomální RNA[5] to nakonec způsobí buněčnou smrt.
Cíl SubAB je v endoplazmatickém retikulu buňky a je do buňky přiveden skrz klatrinem zprostředkovaná endocytóza.[20] Glykanový receptor pro SubAB obvykle končí spojením a2-3 Kyselina N-glykolylneuraminová (Neu5Gc).[13] SubAB má podjednotku A, kde působí jako serinová proteáza a štěpí se Bip / GRP78, an endoplazmatické retikulum garde.[4] Štěpení tohoto chaperonu způsobuje buněčný stres prostřednictvím inhibice bílkovin,[14] a následně smrt buňky.[5]
Lékařské použití
Léčba rakoviny
B podjednotky toxinů AB5 mají afinitu k vazbě glykan které některé typy nádorů zřejmě mají, což z něj činí snadný cíl. Jedním příkladem je příklad StxB který se konkrétně váže s CD77 (Gb3), který ukazuje expresi na povrchu rakovinných buněk, jako je tlusté střevo, pankreas, prsa a mnoho dalších. Jakmile StxB zacílí na rakovinnou buňku, dodá A podjednotku toxinu, který nakonec rakovinnou buňku zabije.[5]
Ještě další metodou je použití léků vyvolávajících stres ER, které byly testovány na myších, aby prokázaly pozitivní synergické reakce. Toho je dosaženo fúzí epidermální růstový faktor (EGF) s podjednotkou A SubAB. Rakovinné buňky, které exprimují receptory pro EGF, pak zažijí toxicitu SubAB.[24]
Vakcíny
Další použití toxinů AB5 je použití členů rodiny LT jako adjuvans. To umožňuje toxinu podporovat imunologické reakce, jako je IgG2a, IgA, a Čt17 bojovat například se žaludkem Helicobacter pylori infekce, když vakcína je dáno.[25][26]
Kromě toho, že některé z těchto toxinů AB5 se používají k výrobě vakcín k prevenci bakteriální infekce, jsou také zkoumány, aby fungovaly jako sdružené k prevenci virových infekcí. Například systémová imunizace spolu se společně podávaným intra-nosním dodáním konjugované vakcíny virus-cholera a toxin vyvolala protilátkovou reakci specifickou pro virus a prokázala určitý stupeň ochrany horních cest dýchacích před Virus Sendai.[27]
Poslední oblasti výzkumu
Nový pokrok v biotechnologických experimentálních metodách, jako je použití Besselův paprsek letadlo osvětlovací mikroskopie a FRET molekuly senzoru na bázi mohou lépe demonstrovat dynamické struktury mezera křižovatka plakety. Pro tyto experimenty lze použít různé typy toxinů AB5 k vyvolání rychlé tvorby tCDR v buňkách E.Coli. Odezvu lze poté zaznamenat pomocí tábor fluktuace koncentrace v buňkách spřažených s mezerou pomocí konstrukcí senzorů založených na FRET. Výzkum naznačuje, že CDR mohou být pravděpodobně spojeny s rychlým přeskupením lipidů a bílkovin v konexin kanály v mezerových spojovacích placích. To nám může dále pomoci pochopit signální kaskádu, která následuje po buněčné ztrátě K + při vystavení bakteriální infekci.[28][29]
Bylo pozorováno, že toxin SubAB vykazuje specificitu k vazebnému proteinu, BiP. Tato charakteristika byla použita ke studiu role samotného buněčného BiP spolu s degradací spojenou s endoplazmatickým retikulem u stresovaných HeLa buňky.[5]
Viz také
Reference
- ^ Le Nours, J .; Paton, A. W .; Byres, E .; Troy, S .; Herdman, B. P .; Johnson, M. D .; Paton, J. C .; Rossjohn, J .; Beddoe, T. (6. srpna 2013). "Strukturní základ sestavy subAB subtilázového cytotoxinu". Journal of Biological Chemistry. 288 (38): 27505–27516. doi:10,1074 / jbc.M113.462622. PMC 3779744. PMID 23921389.
- ^ A b Middlebrook, JL; Dorland, RB (září 1984). „Bakteriální toxiny: buněčné mechanismy působení“. Mikrobiologické recenze. 48 (3): 199–221. PMC 373009. PMID 6436655.
- ^ Locht, C; Antoine, R (1995). „Navrhovaný mechanismus ADP-ribosylace katalyzovaný podjednotkou toxinu černého kašle S1“. Biochimie. 77 (5): 333–40. doi:10.1016/0300-9084(96)88143-0. PMID 8527486.
- ^ A b C d E F Wang, H; Paton, JC; Herdman, BP; Rogers, TJ; Beddoe, T; Paton, AW (březen 2013). „B podjednotka toxinu AB5 produkovaná serovarem Typhi ze Salmonella enterica reguluje chemokiny, cytokiny a adhezní molekuly v lidských makrofágových, tlustých epiteliálních a mozkových mikrovaskulárních endotelových buněčných liniích“. Infekce a imunita. 81 (3): 673–83. doi:10.1128 / IAI.01043-12. PMC 3584882. PMID 23250951.
- ^ A b C d E F G h i j k l Beddoe, Travis; Paton, Adrienne W .; Le Nours, Jérôme; Rossjohn, Jamie; Paton, James C. (červenec 2010). "Struktura, biologické funkce a aplikace toxinů AB5". Trendy v biochemických vědách. 35 (7): 411–418. doi:10.1016 / j.tibs.2010.02.003. PMC 2929601. PMID 20202851.
- ^ Bharati, K; Ganguly, N. K. (2011). „Cholera toxin: paradigma multifunkčního proteinu“. Indický žurnál lékařského výzkumu. 133 (2): 179–187. PMC 3089049. PMID 21415492.
- ^ Millen, S. H .; Schneider, O. D .; Miller, W. E .; Monaco, J. J .; Weiss, A. A. (2013). „Pertussis toxin B-pentamer zprostředkovává mezibuněčný přenos membránových proteinů a lipidů“. PLOS ONE. 8 (9): e72885. Bibcode:2013PLoSO ... 872885M. doi:10.1371 / journal.pone.0072885. PMC 3760862. PMID 24019885.
- ^ Carbonetti, N.H. (2010). „Toxin Pertussis a toxin adenylátcyklázy: Klíčové faktory virulence Bordetella pertussis a nástroje buněčné biologie“. Budoucí mikrobiologie. 5 (3): 455–469. doi:10,2217 / fmb.09.133. PMC 2851156. PMID 20210554.
- ^ Guiso N. 2009. Vakcíny Bordetella pertussis a pertussis. Clin. Infikovat. Dis. 49:1565–1569
- ^ „1.C.72 Rodina pertusových toxinů (PTX)“. TCDB. Citováno 21. března 2019.
- ^ Faruque, S. M .; Chowdhury, N; Khan, R; Hasan, M. R.; Nahar, J; Islam, M. J .; Yamasaki, S; Ghosh, A. N .; Nair, G. B .; Sack, D. A. (2003). „Shigella dysenteriae Type 1-specific Bacteriophage from Environmental Waters in Bangladesh“. Aplikovaná a environmentální mikrobiologie. 69 (12): 7028–7031. doi:10.1128 / AEM.69.12.7028-7031.2003. PMC 310026. PMID 14660345.
- ^ Beutin, L; Miko, A; Krause, G; Pries, K; Haby, S; Steege, K; Albrecht, N (2007). „Identifikace lidských patogenních kmenů bakterie Escherichia coli produkující Shiga toxiny z potravy kombinací sérotypizace a molekulární typizace genů Shiga toxinu“. Aplikovaná a environmentální mikrobiologie. 73 (15): 4769–75. doi:10.1128 / AEM.00873-07. PMC 1951031. PMID 17557838.
- ^ A b C Paton, AW; Paton, JC (1. února 2010). "Escherichia coli Subtilase Cytotoxin". Toxiny. 2 (2): 215–228. doi:10,3390 / toxiny2020215. PMC 2943149. PMID 20871837.
- ^ A b Michelacci, V .; Tozzoli, R .; Caprioli, A .; Martínez, R .; Scheutz, F .; Grande, L .; Sánchez, S .; Morabito, S .; Allerberger, F. (2013). „Nový ostrov patogenity nesoucí alelickou variantu subtilázového cytotoxinu je běžný mezi produkcí Shiga toxinů lidského a ovčího původu“. Klinická mikrobiologie a infekce. 19 (3): E149 – E156. doi:10.1111/1469-0691.12122. PMID 23331629.
- ^ Wang, Hui; Paton, James C .; Paton, Adrienne W. (říjen 2007). „Patologické změny u myší vyvolané subtilázovým cytotoxinem, novým silným toxinem AB, který cílí na endoplazmatické retikulum“. The Journal of Infectious Diseases. 196 (7): 1093–1101. doi:10.1086/521364. PMID 17763334.
- ^ Paton, AW; Paton, JC (1. února 2010). "Escherichia coli Subtilase Cytotoxin". Toxiny. 2 (2): 215–228. doi:10,3390 / toxiny2020215. PMC 2943149. PMID 20871837.
- ^ Morinaga, N; Yahiro, K; Matsuura, G; Watanabe, M; Nomura, F; Moss, J; Noda, M (leden 2007). „Dvě odlišné cytotoxické aktivity subtilázového cytotoxinu produkovaného shiga-toxigenní Escherichia coli“. Infekce a imunita. 75 (1): 488–96. doi:10.1128 / IAI.01336-06. PMC 1828409. PMID 17101670.
- ^ Byres, E; Paton, AW; Paton, JC; Löfling, JC; Smith, DF; Wilce, MC; Talbot, UM; Chong, DC; Yu, H; Huang, S; Chen, X; Varki, NM; Varki, A; Rossjohn, J; Beddoe, T (4. prosince 2008). „Začlenění jiného než lidského glykanu zprostředkovává citlivost člověka na bakteriální toxin“. Příroda. 456 (7222): 648–52. Bibcode:2008 Natur.456..648B. doi:10.1038 / nature07428. PMC 2723748. PMID 18971931.
- ^ Gutkind, editoval Toren Finkel, J. Silvio (2003). Transdukce signálu a lidská nemoc. Hoboken, NJ: John Wiley & Sons. ISBN 0471448370.CS1 maint: další text: seznam autorů (odkaz)
- ^ A b C d Lencer W, Saslowsky D (2005). "Vor obchodování s bakteriálními toxiny podjednotky AB5". Biochim Biophys Acta. 1746 (3): 314–21. doi:10.1016 / j.bbamcr.2005.07.007. PMID 16153723.
- ^ Smith, Richard D .; Willett, Rose; Kudlyk, Tetyana; Pokrovskaya, Irina; Paton, Adrienne W .; Paton, James C .; Lupashin, Vladimir V. (říjen 2009). „COG Complex, Rab6 a COPI definují novou retrográdní cestu obchodování s Golgi, která je využívána toxinem SubAB“. Provoz. 10 (10): 1502–1517. doi:10.1111 / j.1600-0854.2009.00965.x. PMC 2756830. PMID 19678899.
- ^ Teter, Ken (10. prosince 2013). „Nestabilita toxinů a její role v translokaci toxinů z endoplazmatického retikula do cytosolu“. Biomolekuly. 3 (4): 997–1029. doi:10,3390 / biom3040997. PMC 4030972. PMID 24970201. (PDI)
- ^ Thorpe, C. M. (1. května 2004). „Shiga toxin - produkující infekci Escherichia coli“. Klinické infekční nemoci. 38 (9): 1298–1303. doi:10.1086/383473. PMID 15127344.
- ^ Backer, JM; Krivoshein, AV; Hamby, CV; Pizzonia, J; Gilbert, KS; Ray, YS; Značka, H; Paton, AW; Paton, JC; Backer, MV (listopad 2009). „Cytotoxin zaměřený na chaperon a léčivo vyvolávající stres endoplazmatickým retikulem synergicky zabíjejí rakovinné buňky“. Neoplazie. 11 (11): 1165–73. doi:10.1593 / neo.09878. PMC 2767218. PMID 19881952.
- ^ Norton, E. B .; Lawson, L. B .; Mahdi, Z .; Freytag, L. C .; Clements, J. D. (23. dubna 2012). „Subjednotka Escherichia coli Heat-Labile Enterotoxin funguje jako slizniční adjuvans a podporuje reakce IgG2a, IgA a Th17 na antigeny vakcín“. Infekce a imunita. 80 (7): 2426–2435. doi:10.1128 / IAI.00181-12. PMC 3416479. PMID 22526674.
- ^ Weltzin, R; Guy, B; Thomas WD, Jr.; Giannasca, PJ; Monath, TP (květen 2000). „Parenterální adjuvantní aktivity tepelně labilního toxinu Escherichia coli a jeho podjednotky B pro imunizaci myší proti žaludeční infekci Helicobacter pylori“. Infekce a imunita. 68 (5): 2775–82. doi:10.1128 / iai.68.5.2775-2782.2000. PMC 97487. PMID 10768972.
- ^ Liang, XP; Lamm, ME; Nedrud, JG (1. září 1988). „Orální podání konjugátu toxinu cholery a viru Sendai potencuje imunitu střev a dýchacích cest proti viru Sendai.“ Journal of Immunology. 141 (5): 1495–501. PMID 2842395.
- ^ Majoul, IV; Gao, L; Betzig, E; Onichtchouk, D; Butkevich, E; Kozlov, Y; Bukauskas, F; Bennett, MV; Lippincott-Schwartz, J; Duden, R (29. října 2013). „Rychlé strukturální reakce domén membránových spojů na toxiny AB5“. Sborník Národní akademie věd Spojených států amerických. 110 (44): E4125–33. Bibcode:2013PNAS..110E4125M. doi:10.1073 / pnas.1315850110. PMC 3816413. PMID 24133139.
- ^ Börner, S; Schwede, F; Schlipp, A; Berisha, F; Calebiro, D; Lohse, MJ; Nikolaev, VO (duben 2011). "FRET měření intracelulárních koncentrací cAMP a propustnosti analogu cAMP v intaktních buňkách". Přírodní protokoly. 6 (4): 427–38. doi:10.1038 / nprot.2010.198. PMID 21412271.
externí odkazy
- Bakteriální toxiny AB5
- Drženo, Paule. „Úvod do technologie přenosu fluorescenční rezonanční energie (FRET) a její aplikace v biologických vědách“. BioTek Instruments, Inc.

