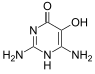
Božské - Divicine
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 2,6-diamino-4,5-dihydroxypyrimidin | |||
| Ostatní jména 2,6-diamino-4,5-pyrimidindiol; 2,6-diamin-5-hydroxy-4 (3H) -pyrimidinon; 2,4-diamino-5,6-dihydroxypyrimidin | |||
| Identifikátory | |||
3D model (JSmol ) |
| ||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H6N4Ó2 | |||
| Molární hmotnost | 142.118 g · mol−1 | ||
| Vzhled | Hnědé jehly | ||
| Rozpustnost v 10% KOH | Rozpustný[vágní ] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Božské (2,6-diamino-4,5-dihydroxypyrimidin) je oxidant a báze s alkaloidními vlastnostmi, které se nacházejí v Fava fazole a Lathyrus sativus. Je to aglykon z vicine. Běžným derivátem je diacetátová forma (2,6-diamino-1,6-dihydro-4,5-pyrimidindion).[1]
Výskyt
Divicine se nachází v Fava fazole a v luštěnině Lathyrus sativus, také známý jako khesari, což je levný a robustní zdroj potravy běžně pěstovaný v Asii a východní Africe.
Syntéza
V rostlinách vzniká redukovaný divicin hydrolýzou neaktivního β-glukosidu, vicine.[2]
Zjednodušený tříkrokový proces pro umělou božskou syntézu:
- Benzylová skupina 2-amino-5-benzyloxy-4-hydroxypyrimidinu se odstraní pomocí kyselá hydrolýza, čímž se získá 2-amino-4,5-dihydroxypyrimidin.
- Na tento meziprodukt se poté působí kyselinou dusitou, čímž se získá mírně rozpustný oranžový produkt 2-amino-6-nitrosopyrimidin-4,5-diol.
- Který je pak redukován s dithioničitan sodný dát božství.[3]
Reakce
Byly zkoumány některé chemické vlastnosti divicinu. Je známo, že energicky snižuje zásaditý roztoky 2,6-dichlorfenolindofenolu, fosfomolybdenanu nebo fosfotungstátu a při reakci s amoniakálním roztokem chloridu železitého produkuje intenzivní modré zabarvení, které se používá k identifikaci a prokázání přítomnosti enolické hydroxyl skupina.
Divicin je velmi nestabilní, pokud je přítomen kyslík a oxidace je nejrychlejší při alkalickém pH. Poločas rozpadu divicinu je při pokojové teplotě a neutrálním pH asi půl hodiny. Obě sloučeniny jsou téměř okamžitě zničeny varem a rozpad za běžných podmínek lze urychlit přítomností iontů těžkých kovů, zejména Cu2+.[4]
Toxicita
Divicine byl považován za hemotoxický součást Fava fazole a hraje roli ve vývoji favismus porucha, která zahrnuje hemolytickou reakci na konzumaci fazolí kvůli glukóza-6-fosfátdehydrogenáza (G6PD nebo G6PDH) nedostatek. Tento nedostatek, recesivní dědičné onemocnění vázané na X, je celosvětově nejběžnějším nedostatkem enzymů. Obzvláště běžné je to u afrického, asijského, středomořského a středovýchodního původu. Příznaky favismus zahrnout hemolýza, prodloužené žloutenka, kernicterus, a dokonce akutní selhání ledvin v extrémních případech.[5]
Divicine reaguje s kyslíkem v červených krvinkách, který vytváří reaktivní formy kyslíku jako peroxid vodíku a superoxidový anion. Tyto molekuly jsou silnými oxidačními činidly NADPH a glutathion.[6] Jednotlivci s nedostatkem G6PD nemohou regenerovat NADPH dostatečně rychle, aby zabránili vyčerpání glutathionu. Toto vyčerpání vede k tomu, že buňky nemají žádnou ochranu před oxidačním stresem způsobeným aglykony. Oxidační stres vede k poškození agregátů hemoglobinu a disulfidové vazby (Heinzova těla ), které vedou k hemolytické anémii zvané favismus.[7]
Divicine je také přítomen v a alespoň částečně zodpovědný za jedovaté působení Lathyrus sativus - luštěniny běžně pěstované v oblastech Asie a východní Afriky se sklonem k suchu a hladu jako „pojistná plodina“ pro lidskou spotřebu a krmivo pro hospodářská zvířata, když jiné plodiny nerostou, navzdory jejich známým zdravotním rizikům.[8]
Účinky na zvířata
Studie in vitro na potkanech ukázaly, že hemotoxická dávka divicinu 1,5 mM po přidání do suspenze červených krvinek vedla k rychlému poklesu buněčného glutathionu, tvorbě echinocyty a poškození kostry membrány. To mělo za následek pokles v hematokrit.[9]
Reference
- ^ Bendich, C. (1953). "Revize strukturní formulace vicinu a jeho pyrimidinový aglukon, divicin". Biochim. Biophys. Acta. 12 (1–2): 462–77. doi:10.1016/0006-3002(53)90166-8. PMID 13115456.
- ^ Baker, M .; Bosia, A. (1984). „Mechanismus účinku divicinu v bezbuněčném systému a v červených krvinkách s nedostatkem glukózy-6-fosfátdehydrogenázy“. Toxicol. Pathol. 12 (4): 331–336. doi:10.1177/019262338401200405. PMID 6099911.
- ^ Chesterfield, J .; et al. (1964). "194. Pyrimidiny. Část XIII. Elektrofilní substituce v poloze 6 a syntéza divicinu (2,4-diamino-5,6-dihydroxypyrimidin)". J. Chem. Soc.: 1001–1005. doi:10.1039 / jr9640001001.
- ^ Mager, J .; Razin, A .; Herschko, A. (1969). Liener, I. (ed.). Toxické složky rostlinných potravin. New York: Academic Press. str. 293–312.
- ^ Frank, J. (2005). "Diagnostika a řízení nedostatku G6PD". Dopoledne. Fam. Lékař. 72: 1277–1282.
- ^ Luzzatto, Lucio; Arese, Paolo (01.01.2018). Longo, Dan L. (ed.). "Favism a nedostatek glukózy-6-fosfátdehydrogenázy". New England Journal of Medicine. 378 (1): 60–71. doi:10.1056 / NEJMra1708111. ISSN 0028-4793. PMID 29298156.
- ^ Pulkkinen, Marjo; Zhou, Xiao; Lampi, Anna-Maija; Piironen, Vieno (prosinec 2016). "Stanovení a stabilita divicinu a isouramilu produkovaného enzymatickou hydrolýzou vicinu a konvicinu z fazole". Chemie potravin. 212: 10–19. doi:10.1016 / j.foodchem.2016.05.077. PMID 27374500.
- ^ http://www.biology-online.org/dictionary/Divicine
- ^ McMillan, D. C. (2001-08-01). „Favism: Vliv divicinu na stav krysího erytrocytového sulfhydrylu, aktivita zkratu hexafosforečnanem, morfologie a membránové kosterní proteiny“. Toxikologické vědy. 62 (2): 353–359. doi:10.1093 / toxsci / 62.2.353.