Fluorescenční mikroskopie na světelném listu - Light sheet fluorescence microscopy - Wikipedia

Fluorescenční mikroskopie na světelném listu (LSFM) je fluorescenční mikroskopie technika se střední až vysokou[1] optické rozlišení, ale dobře optické krájení schopnosti a vysoká rychlost. Na rozdíl od epifluorescenční mikroskopie pouze tenký plátek (obvykle několik stovek nanometrů až několik mikrometrů) vzorku je osvětlen kolmo ke směru pozorování. Pro osvětlení, a laser používá se světelný plech, tj. laserový paprsek, který je zaostřen pouze v jednom směru (např. pomocí válcové čočky). Druhá metoda používá k vytvoření světelného listu kruhový paprsek naskenovaný v jednom směru. Protože je osvětlen pouze skutečně pozorovaný úsek, snižuje tato metoda fotodámky a napětí vyvolané na živém vzorku. Dobrá schopnost optického krájení také snižuje signál pozadí a vytváří tak obrázky s vyšším kontrastem, srovnatelným s konfokální mikroskopie. Protože LSFM skenuje vzorky pomocí světelné roviny namísto bodu (jako v konfokální mikroskopii), může získávat obrázky rychlostí 100 až 1 000krát vyšší, než jaké nabízejí metody bodového skenování.

Tato metoda se používá v buněčná biologie[2] a pro mikroskopii neporušených, často chemicky vyčištěných orgánů, embryí a organismů.[3]
Počínaje rokem 1994 byl LSFM vyvinut jako ortogonální rovina fluorescenční optické řezání mikroskopie nebo tomografie (OPFOS)[4] hlavně pro velké vzorky a později jako selektivní / jednoplošná osvětlovací mikroskopie (SPIM) také s subcelulárním rozlišením.[5] To zavedlo do fluorescenční mikroskopie osvětlovací schéma, které již bylo úspěšně použito mikroskopie tmavého pole pod jménem ultramikroskopie.[6]
Nastavení LSFM
Základní nastavení

V tomto typu mikroskopie[7] osvětlení se provádí kolmo ke směru pozorování (viz schematický obrázek v horní části článku). Rozšířený paprsek a laser je zaostřen pouze v jednom směru válcovou čočkou nebo kombinací a válcová čočka a a objektiv mikroskopu protože druhý je k dispozici v lepší optické kvalitě as vyšší numerická clona než první. Tímto způsobem se v ohniskové oblasti vytvoří tenká vrstva světla nebo světelná vrstva, kterou lze použít k excitaci fluorescence pouze v tenkém plátku (obvykle tenkém několik mikrometrů) vzorku.
The fluorescenční světlo vyzařovaný ze světelné tabule se poté sbírá kolmo standardním objektivem mikroskopu a promítá se na zobrazovací senzor (obvykle CCD, elektronové násobení CCD nebo CMOS kamera ). Aby byl dostatek prostoru pro budicí optiku / světelnou tabuli, používá se pozorovací objekt s vysokou pracovní vzdáleností. Ve většině LSFM jsou detekční objektiv a někdy i excitační objektiv plně ponořeny do vzorkového pufru, takže obvykle jsou optika vzorku a excitační / detekční optiky zabudovány do komůrky na vzorek naplněné pufrem, kterou lze také použít ke kontrole podmínek prostředí ( teplota, hladina oxidu uhličitého ...) během měření. The montáž vzorku v LSFM je popsán níže podrobněji.
Protože jak excitační světelný list, tak ohnisková rovina detekční optiky se musí shodovat, aby vytvořil obraz, zaostření různých částí vzorku nelze provést překládáním detekčního objektivu, ale obvykle se místo toho přeloží a otočí celý vzorek.
Rozšíření základní myšlenky LSFM
V posledních letech bylo vyvinuto několik rozšíření tohoto schématu:
- Použití dvou pultových světelných listů pomáhá snížit typické artefakty SPIM, jako je stínování (viz první z-stack výše)[8]
- V roce 2012 bylo kromě kontrarozšířených světelných listů navrženo také nastavení s detekcí ze dvou protilehlých stran.[9][10] To umožňuje měření z a rotačních komínů pro rychlejší úplnou 3D rekonstrukci vzorku.
- Světlo lze také vytvořit skenováním normálního laserového zaostření nahoru a dolů.[11] To také umožňuje použití samočinně se rekonstruujících paprsků (např Besselovy paprsky nebo Vzdušné paprsky ) pro osvětlení, které zlepšuje penetraci světelného listu do tlustých vzorků, protože je snížen negativní účinek rozptylu na světelném listu.[12][13][14] Tyto samočinné rekonstrukční paprsky lze upravit tak, aby působily proti ztrátám intenzity pomocí technik kompenzace útlumu, což dále zvyšuje signál shromážděný z tlustých vzorků.[15]
- v mikroskopie v šikmé rovině (OPM)[16] detekční objektiv se používá také k vytvoření světelného plátu: světelný plát je nyní vyzařován z tohoto objektivu pod úhlem přibližně 60 °. Dodatečná optika se používá také k naklonění ohniskové roviny používané k detekci o stejný úhel.
- LSFM byl také kombinován s dvoufotonová (2P) excitace, což zlepšuje penetraci do hustých a rozptylových vzorků.[17] Použití 2P excitace v blízkých infračervených vlnových délkách bylo použito k nahrazení 1P excitace v modře viditelných vlnových délkách v experimentech zobrazování mozku zahrnujících reakci na vizuální podněty.[18]
- SPIM lze také kombinovat s technikami, jako je fluorescenční korelační spektroskopie, umožnit prostorově rozlišená měření mobility fluoreskujících částic (např. fluorescenčních kuliček, kvantové tečky nebo fluorescenčně značené proteiny) uvnitř živých biologických vzorků.[19][20]
- Rovněž byla popsána kombinace mikroskopu SPIM s kamerou zesilovače obrazu s bránou, která umožňovala měřit mapu životnosti fluorescence (celoživotní zobrazování fluorescence, FLIM).[21]
- LSFM byl kombinován s mikroskopie se super rozlišením techniky ke zlepšení jeho rozlišení nad Abbův limit.[22][23] Také kombinace mikroskopie stimulovaného vyčerpání emisí (STED) a SPIM byl publikován, což vede ke snížení tloušťky světelného listu v důsledku efektu STED.[24] Viz také část o moc rozlišení LSFM níže.
- LSFM byl upraven tak, aby byl kompatibilní se všemi objektivy, dokonce i objektivy založené na krycím sklíčku a olejové imerzi s vysokou numerickou aperturou, aby se zvýšilo nativní prostorové rozlišení a účinnost detekce fluorescence.[25] Tato technika zahrnuje naklonění světelné tabule vzhledem k detekčnímu objektu pod přesným úhlem, aby se světelná tabule mohla vytvořit na povrchu skleněných krycích sklíček.
- LSFM byl kombinován s Adaptivní optika techniky v roce 2012 ke zlepšení hloubky zobrazování v tlustých a nehomogenních vzorcích v hloubce 350 um.[26] Na detekční dráze byl umístěn senzor Shack Hartmann wavefront a vodicí hvězdy jsou použity v úzké zpětnovazební smyčce. Ve své diplomové práci[27] autor pojednává o výhodě adaptivní optiky v dráze osvětlení a detekce LSFM k opravě aberací vyvolaných vzorkem.
Ukázka montáže

Oddělení dráhy paprsků osvětlení a detekce v LSFM (kromě mikroskopie v šikmé rovině ) vytváří potřebu specializovaných metod montáže vzorků. K dnešnímu dni je většina LSFM postavena tak, že osvětlovací a detekční dráha paprsku leží ve vodorovné rovině (viz obrázky výše), takže vzorek obvykle visí shora do komory pro vzorek nebo spočívá na svislé podpěře uvnitř vzorku komora. Pro připojení nejrůznějších vzorků bylo vyvinuto několik metod:
- Pevný (a potenciálně také vyčištěné) vzorky lze nalepit na jednoduchou podložku nebo držák a mohou během zobrazování zůstat v jejich fixačním řešení.
- Větší živé organismy jsou obvykle pod sedativy a namontovány do měkkého gelového válce, který je vytlačován ze (skleněné nebo plastové) kapiláry visící shora do komory pro vzorky.
- Adherentní buňky lze pěstovat na malých skleněných deskách, které visí v komoře na vzorky.
- Rostliny lze pěstovat v čirých gelech obsahujících růstové médium. Gely jsou odříznuty v poloze zobrazování, takže nesnižují světelnou vrstvu a kvalitu obrazu rozptylem a absorpcí.[28]
- Tekuté vzorky (např fluorescenční korelační spektroskopie ) lze připevnit do malých sáčků vyrobených z tenké plastové fólie odpovídající index lomu okolního ponorného média ve vzorkovací komoře.[20]
Některé LSFM byly vyvinuty tam, kde je vzorek připevněn jako ve standardní mikroskopii (např. Buňky rostou vodorovně na dně Petriho miska ) a excitační a detekční optika jsou konstruovány ve svislé rovině shora. To také umožňuje kombinovat LSFM se standardem obrácený mikroskop a vyhýbá se požadavku na speciální postupy montáže vzorků.[19][29][30][31]
Vlastnosti obrázku LSFM
Typické zobrazovací režimy
Většina LSFM se používá k výrobě 3D obrazů vzorku pohybem vzorku rovinou obrazu. Pokud je vzorek větší než zorné pole obrazového snímače, musí být také posunut laterálně. Alternativním přístupem je pohyb obrazové roviny vzorkem a vytvoření obrazového zásobníku.[31]
Lze provádět dlouhé experimenty, například s komíny zaznamenanými každých 10 s – 10 min v časovém rozmezí dnů. To umožňuje studium změn v čase ve 3D nebo takzvané 4D mikroskopii.
Po získání obrazu jsou různé stohy obrázků registrovaný vytvořit jednu jedinou 3D datovou sadu. Lze shromáždit více pohledů na vzorek, a to buď záměnou rolí cílů[31] nebo otáčením vzorku.[8] Mít více pohledů může přinést více informací než jeden zásobník; lze například překonat okluzi některých částí vzorku. Vícenásobné zobrazení také zlepšuje rozlišení 3D obrazu překonáním špatného axiálního rozlišení, jak je popsáno níže.
Některé studie také používají SPIM k zobrazení pouze jednoho řezu vzorku, ale při mnohem vyšším časovém rozlišení. To umožňuje např. sledovat v reálném čase tlukot srdce embrya ryby zebra.[32] Spolu s fázemi rychlého překladu pro vzorek bylo implementováno vysokorychlostní 3D sledování částic.[33]
Síla rozlišení
Laterální rozlišení SPIM je srovnatelné s rozlišením standardního (epi) fluorescenčního mikroskopu, protože je plně určeno objektivem detekce a vlnovou délkou detekovaného světla (viz Abbův limit ). Např. pro detekci v zelené spektrální oblasti kolem 525 nm lze dosáhnout rozlišení 250–500 nm.[7] Axiální rozlišení je horší než boční (přibližně 4krát), ale lze ho zlepšit použitím tenčí světelné tabulky, v takovém případě je možné téměř izotropní rozlišení.[19] Tenčí světlé listy jsou buď tenké pouze v malé oblasti (pro Gaussovy paprsky ) nebo je třeba použít speciální profily paprsků, jako jsou Besselovy paprsky (kromě větší složitosti tato schémata přidávají boční laloky, které mohou být škodlivé[13]). Alternativně lze izotropního rozlišení dosáhnout výpočtovou kombinací zásobníků 3D obrazů pořízených ze stejného vzorku pod různými úhly. Poté jsou informace o hloubkovém rozlišení, které chybí v jednom zásobníku, dodávány z jiného zásobníku; například se dvěma ortogonálními stohy je axiální směr (špatného rozlišení) v jednom stohu laterálním směrem (s vysokým rozlišením) v druhém stohu.
Boční rozlišení LSFM lze vylepšit za Abbův limit pomocí mikroskopie se super rozlišením techniky, např. s využitím skutečnosti, že jednotlivé fluorofory lze lokalizovat s mnohem vyšší prostorovou přesností, než je nominální rozlišení použitého optického systému (viz stochastické lokalizační mikroskopické techniky ).[22] Taky techniky strukturovaného osvětlení byly použity k dalšímu zlepšení optické kapacity dělení LSFM.[23]
Proužkové artefakty

Protože osvětlení typicky proniká vzorkem z jedné strany, překážky ležící v cestě světelné tabuli mohou narušit její kvalitu rozptylem a / nebo absorpcí světla. To obvykle vede k tmavým a jasným pruhům na obrázcích. Pokud mají části vzorků významně vyšší index lomu (např. Lipidové vezikuly v buňkách), mohou také vést k zaostřovacímu efektu, jehož výsledkem jsou světlé pruhy za těmito strukturami. K překonání tohoto artefaktu mohou světelné tabulky např. být „otočný“. To znamená, že směr dopadu světelného listu se rychle mění (rychlost ~ 1 kHz) o několik stupňů (~ 10 °), takže světlo dopadá také na oblasti za překážkami. Osvětlení lze také provést dvěma (otočnými) světelnými listy (viz výše), aby se tyto artefakty ještě zmenšily.[8]Alternativně byl vyvinut algoritmus s názvem VSNR (Variational Stationary Noise Remover), který je k dispozici jako bezplatný plugin pro Fidži. [34]
Dějiny
Na začátku 20. století R. A. Zsigmondy představil ultramikroskop jako nové schéma osvětlení do mikroskopie tmavého pole. Zde se k osvětlení přesné štěrbiny používá sluneční světlo nebo bílá lampa. Štěrbina je poté zobrazena kondenzátorovou čočkou do vzorku za vzniku světelné vrstvy. Rozptyl (subdifrakční) částice lze pozorovat kolmo pod mikroskopem. Toto nastavení umožnilo pozorování částic o velikosti menší než rozlišení mikroskopu a v roce 1925 vedlo k Nobelově ceně pro Zsigmondy.[35]
První aplikace tohoto osvětlovacího schématu pro fluorescenční mikroskopii byla publikována v roce 1993 autorem Voie a kol. pod názvem ortogonální rovina fluorescenční optické řezání (OPFOS).[4] pro zobrazení vnitřní struktury kochlea. Rozlišení v té době bylo omezeno na 10 um v příčném směru a 26 um v podélném směru, ale při velikosti vzorku v rozmezí milimetrů. Mikroskop OPFOS používal k osvětlení jednoduchou válcovou čočku. Další vývoj a zdokonalování SPIM začal v roce 2004.[5] Po této publikaci Huisken et al. technika našla široké uplatnění a je stále přizpůsobena novým situacím měření dnes (viz výše). Od roku 2010 první ultramikroskop s fluorescenční excitací a omezeným rozlišením[36] a od roku 2012 je první SPIM komerčně dostupný.[37] Dobrý přehled o vývoji SPIM je uveden v ref.[38] V průběhu roku 2012 také otevřený zdroj začaly se objevovat projekty, které volně publikují kompletní stavební plány pro LSFM a také požadované softwarové balíčky.[39][40][41][42]
Aplikace
SPIM / LSFM se často používá ve vývojové biologii, kde umožňuje dlouhodobé (několikadenní) pozorování embryonálního vývoje (i při úplné rekonstrukci rodokmenu).[5][43] SPIM lze také kombinovat s technikami, jako je fluorescenční korelační spektroskopie umožnit prostorově rozlišená měření mobility fluoreskujících částic (např. fluorescenčních kuliček, kvantové tečky nebo fluorescenční proteiny) uvnitř živých biologických vzorků.[19][20]
Silně rozptylující biologická tkáň, jako je mozek nebo ledvina, musí být chemicky fixována a vyčištěna, než bude možné ji zobrazit v SPIM.[44] Pro tento účel byly vyvinuty speciální techniky čištění tkáně, např. 3DISCO, KRYCHLOVÝ a JASNOST. Záleží na index lomu vymazaného vzorku, shoda ponorné kapaliny a během zobrazování musí být použity speciální objektivy na velké vzdálenosti.
SPIM zobrazování živého sféroidu exprimujícího H2B-HcRed. Každé tři minuty byly zaznamenávány stohy Z 100 řezů s roztečí řezů 1 μm (10 × objektiv, NA = 0,3). Pro každý časový bod je zobrazena maximální projekce z-stacků.[45]
Obrázky volně se pohybujících améb značených DiI, získané pomocí ezDSLM.[46]
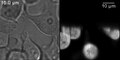
HeLa buňky exprimující tetramery zelený fluorescenční protein. Vlevo je zobrazen osvětlovací obraz přenosu a na pravých je LSFM obraz. Typické artefakty SPIM, jako jsou stíny, lze jasně vidět. Světlo bylo nasměrováno zdola nahoru.
Objemová rekonstrukce z-stacku na obrázku výše.

Myší mozek (Thy-1 GFP-M) se vyčistil pomocí 3DISCO metoda a zobrazena mikroskopií na světelném listu.
Reference
- ^ Fadero, T.C .; et al. (2018). „LITE mikroskopie: Naklonění modelových organismů na nakloněné světelné vrstvě nabízí vysoké rozlišení a nízké bělení fotografií“. The Journal of Cell Biology. 217 (5): 1869–1882. doi:10.1083 / jcb.201710087. PMC 5940309. PMID 29490939.
- ^ Keller, Philipp J .; Stelzer, Ernst H. K. (2006). „Lichtscheiben-Mikroskopie in der molekularen Zellbiophysik“ (PDF). Laborwelt. 7 (5): 18–21.
- ^ Tomer, Raju; Lovett-Barron, Matthew; Kauvar, Isaac; Andalman, Áron; Burns, Vanessa M .; Sankaran, Sethuraman; Grosenick, Logan; Broxton, Michael; Yang, Samuel; Deisseroth, Karl (2015). "SPED Light Sheet Microscopy: Fast Mapping of Biological System Structure and Function". Buňka. 163 (7): 1796–1806. doi:10.1016 / j.cell.2015.11.061. ISSN 0092-8674. PMC 4775738. PMID 26687363.
- ^ A b A. H. Voie; D. H. Burns; F. A. Spelman (červen 1993). „Fluorescenční optické řezy v ortogonální rovině: trojrozměrné zobrazování makroskopických biologických vzorků“. Journal of Microscopy. 170 (3): 229–236. doi:10.1111 / j.1365-2818.1993.tb03346.x. ISSN 0022-2720. PMID 8371260. S2CID 2901024.
- ^ A b C Huisken, J .; Swoger, J .; Del Bene, F .; Wittbrodt, J .; Stelzer, E. H. (2004). "Optické řezy hluboko uvnitř živých embryí pomocí mikroskopie selektivního osvětlení roviny". Věda. 305 (5686): 1007–1009. Bibcode:2004Sci ... 305.1007H. CiteSeerX 10.1.1.456.2250. doi:10.1126 / science.1100035. PMID 15310904. S2CID 3213175.
- ^ Timo Mappes; Norbert Jahr; Andrea Csaki; Nadine Voglerová; Juergen Popp; Wolfgang Fritzsche (5. listopadu 2012). „Vynález ponorné ultramikroskopie v roce 1912 - Zrození nanotechnologie?“. Angewandte Chemie International Edition. 51 (45): 11208–11212. doi:10,1002 / anie.201204688. ISSN 1433-7851. PMID 23065955.
- ^ A b Greger, K; Swoger, J; Stelzer, EH (únor 2007). "Základní stavební jednotky a vlastnosti fluorescenčního jednoplošného osvětlovacího mikroskopu". Rev Sci Instrum. 78 (2): 023705–023705–7. Bibcode:2007RScI ... 78b3705G. doi:10.1063/1.2428277. PMID 17578115.
- ^ A b C Huisken, Jan; Stainier, Didier Y. R. (2007). „Rovnoměrná fluorescenční excitace pomocí vícesměrné mikroskopie pro selektivní osvětlování v rovině (mSPIM)“. Optická písmena. 32 (17): 2608–10. Bibcode:2007OptL ... 32.2608H. doi:10.1364 / OL.32.002608. ISSN 0146-9592. PMID 17767321. S2CID 15231468.(vyžadováno předplatné)
- ^ Tomer, Raju; Khairy, Khaled; Amat, Fernando; Keller, Philipp J (3. června 2012). „Kvantitativní vysokorychlostní zobrazování celých vyvíjejících se embryí se simultánní multiview mikroskopií se světelnými listy“. Přírodní metody. 9 (7): 755–763. doi:10.1038 / nmeth.2062. ISSN 1548-7091. PMID 22660741. S2CID 14191130.(vyžadováno předplatné)
- ^ Krzic, Uros; Gunther, Stefan; Saunders, Timothy E; Streichan, Sebastian J; Hufnagel, Lars (3. června 2012). "Multiview light-sheet microscope for quick in toto imaging". Přírodní metody. 9 (7): 730–733. doi:10.1038 / nmeth.2064. ISSN 1548-7091. PMID 22660739. S2CID 13388657.(vyžadováno předplatné)
- ^ Keller, P. J .; Schmidt, A.D .; Wittbrodt, J .; Stelzer, E.H.K. (14. listopadu 2008). „Rekonstrukce raného embryonálního vývoje Zebrafish pomocí mikroskopie skenovaného světelného listu“ (PDF). Věda. 322 (5904): 1065–1069. Bibcode:2008Sci ... 322.1065K. doi:10.1126 / science.1162493. ISSN 0036-8075. PMID 18845710. S2CID 7594561.
- ^ Fahrbach, F. O .; Rohrbach, A. (listopad 2010). "Řádkově skenovaný světelný mikroskop s fázově tvarovanými samočinně se rekonstruujícími paprsky". Optika Express. 18 (23): 24229–24244. Bibcode:2010Oexpr..1824229F. doi:10.1364 / oe.18.024229. PMID 21164769.
- ^ A b Planchon, T. A .; Gao, L .; Milkie, D. E .; Davidson, M. W .; Galbraith, J. A .; Galbraith, C. G .; Betzig, E. (2011). „Rychlé trojrozměrné izotropní zobrazování živých buněk pomocí osvětlení Besselovy roviny paprsku“. Přírodní metody. 8 (5): 417–423. doi:10.1038 / nmeth.1586. PMC 3626440. PMID 21378978.
- ^ Vettenburg, Tom; Dalgarno, Heather I C; Nylk, Jonathan; Coll-Lladó, Clara; Ferrier, David EK; Čižmár, Tomáš; Gunn-Moore, Frank J; Dholakia, Kishan (2014). "Mikroskopie světelných listů pomocí vzdušného paprsku" (PDF). Přírodní metody. 11 (5): 541–544. doi:10.1038 / nmeth.2922. hdl:10023/5521. PMID 24705473. S2CID 205422713.
- ^ Nylk, Jonathan; McCluskey, Kaley; Preciado, Miguel A .; Mazilu, Michael; Yang, Zhengyi; Gunn-Moore, Frank J .; Aggarwal, Sanya; Tello, Javier A .; Ferrier, David E. K. (1. dubna 2018). "Mikroskopie světelných listů s paprsky kompenzovanými útlumem a invariantními paprsky". Vědecké zálohy. 4 (4): eaar4817. arXiv:1708.02612. Bibcode:2018SciA .... 4.4817N. doi:10.1126 / sciadv.aar4817. PMC 5938225. PMID 29740614.
- ^ Dunsby, C. (2008). "Optické řezy mikroskopií v šikmé rovině". Optika Express. 16 (25): 20306–16. Bibcode:2008Oexpr..1620306D. doi:10.1364 / OE.16.020306. hdl:10044/1/53595. ISSN 1094-4087. PMID 19065169.
- ^ Zeno Lavagnino; Francesca Cella Zanacchi; Emiliano Ronzitti; Alberto Diaspro (2013). "Dvoufotonová excitační mikroskopie pro selektivní rovinné osvětlení (2PE-SPIM) vysoce rozptylových vzorků: charakterizace a aplikace". Optika Express. 21 (5): 5998–6008. Bibcode:2013Obj. 21.5998L. doi:10.1364 / OE.21.005998. ISSN 1094-4087. PMID 23482168.
- ^ Wolf S, Supatto W, Debregeas G, Mahou P, Kruglik SG, Sintes J, Beaurepaire E, Candelier R (květen 2015). "Funkční zobrazování celého mozku pomocí mikroskopie se dvěma fotonovými světelnými listy". Korespondence. Přírodní metody. 12 (5): 379–80. doi:10.1038 / nmeth.3371. PMID 25924070. S2CID 19746295.
- ^ A b C d Capoulade, J .; Wachsmuth, M .; Hufnagel, L .; Knop, M. (2011). "Kvantitativní fluorescenční zobrazování difúze a interakce proteinů v živých buňkách". Přírodní biotechnologie. 29 (9): 835–839. doi:10.1038 / nbt.1928. PMID 21822256. S2CID 10493584.
- ^ A b C Wohland, T .; Shi, X .; Sankaran, J .; Stelzer, E. H. (květen 2010). „Osvětlení jedné roviny fluorescenční korelační spektroskopie (SPIM-FCS) sondy nehomogenní trojrozměrné prostředí“. Optika Express. 18 (10): 10627–10641. Bibcode:2010Expr..1810627W. doi:10.1364 / oe.18.010627. PMID 20588915.
- ^ Klaus Greger; Manuel J. Neetz; Emmanuel G. Reynaud; Ernst H.K. Stelzer (2011). „Trojrozměrné fluorescenční celoživotní zobrazování s mikroskopem s jednou rovinou osvětlení poskytuje vylepšený poměr signálu k šumu.“ Optika Express. 19 (21): 20743–50. Bibcode:2011Expr..1920743G. doi:10.1364 / OE.19.020743. ISSN 1094-4087. PMID 21997084.
- ^ A b Francesca Cella Zanacchi; Zeno Lavagnino; Michela Perrone Donnorso; Alessio Del Bue; Laura Furia; Mario Faretta; Alberto Diaspro (9. října 2011). "3D zobrazení živých buněk v super rozlišení v tlustých biologických vzorcích". Přírodní metody. 8 (12): 1047–1049. doi:10.1038 / nmeth.1744. ISSN 1548-7091. PMID 21983925. S2CID 205420075.
- ^ A b Jerome Mertz; Jinhyun Kim (2010). "Skenování světelné mikroskopie v celém mozku myši s HiLo odmítnutím pozadí". Journal of Biomedical Optics. 15 (1): 016027–016027–7. Bibcode:2010JBO .... 15a6027M. doi:10.1117/1.3324890. ISSN 1083-3668. PMC 2917465. PMID 20210471.
- ^ Friedrich, Mike; Gan, Qiang; Ermolayev, Vladimir; Harms, Gregory S. (2011). „STED-SPIM: Stimulované snižování emisí zlepšuje rozlišení mikroskopie osvětlení listu“. Biofyzikální deník. 100 (8): L43–5. Bibcode:2011BpJ ... 100L..43F. doi:10.1016 / j.bpj.2010.12.3748. PMC 3077687. PMID 21504720..
- ^ Fadero TC a kol. 2017. „Mikroskopie LITE: technika pro vysokou numerickou aperturu, fluorescenční zobrazování s nízkým fotobělením“ bioRxiv doi: https://doi.org/10.1101/181644 https://www.biorxiv.org/content/early/2017/10/04/181644.1
- ^ Jorand R a kol. 2012. „Hluboké a jasné optické zobrazování silných nehomogenních vzorků“ PLOS one doi:https://doi.org/10.1371/journal.pone.0035795
- ^ Jorand R, 2013. „Amélioration des voies de détection et d'illumination d'un mikroskop SPIM pour l'imagerie 3D des sphéroïdes“ theses.fr https://www.theses.fr/180545140
- ^ Alexis Maizel, Daniel von Wangenheim, Fern n Federici, Jim Haseloff, Ernst H.K. Stelzer (říjen 2011). „Živé zobrazení růstu rostlin ve vysokém rozlišení v téměř fyziologických jasných podmínkách pomocí fluorescenční mikroskopie na světle listu“. The Plant Journal. 68 (2): 377–385. doi:10.1111 / j.1365-313X.2011.04692.x. ISSN 0960-7412. PMID 21711399.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Terrence F. Holekamp; Diwakar Turaga; Timothy E. Holy (13. března 2008). „Rychlé trojrozměrné fluorescenční zobrazování aktivity v nervových populacích pomocí objektivně spojené mikroskopie planárního osvětlení“. Neuron. 57 (5): 661–672. doi:10.1016 / j.neuron.2008.01.011. ISSN 0896-6273. PMID 18341987. S2CID 9571663.
- ^ Y. Wu; A. Ghitani; R. Christensen; A. Santella; Z. Du; G. Rondeau; Z. Bao; D. Colon-Ramos; H. Shroff (25. října 2011). „Invertovaná mikroskopie se selektivním osvětlením roviny (iSPIM) umožňuje liniovou linii spojené buněčné identity a neurodevelopmentální zobrazování u Caenorhabditis elegans“. Sborník Národní akademie věd. 108 (43): 17708–17713. Bibcode:2011PNAS..10817708W. doi:10.1073 / pnas.1108494108. ISSN 0027-8424. PMC 3203761. PMID 22006307.
- ^ A b C Wu, Yicong; Wawrzusin, Peter; Senseney, Justin; Fischer, Robert S; Christensen, Ryan; Santella, Anthony; York, Andrew G; Winter, Peter W; Waterman, Clare M; Bao, Zhirong; Colón-Ramos, Daniel A; McAuliffe, Matthew; Shroff, Hari (2013). „Prostorově izotropní čtyřrozměrné zobrazování s mikroskopií rovinného osvětlení s dvojitým pohledem“. Přírodní biotechnologie. 31 (11): 1032–1038. doi:10.1038 / nbt.2713. ISSN 1087-0156. PMC 4105320. PMID 24108093.
- ^ „Webová stránka Huisken Lab“. Archivovány od originál dne 7. července 2014.
- ^ Jörg G. Ritter; Roman Veith; Jan-Peter Siebrasse; Ulrich Kubitscheck (2008), „Vysoce kontrastní sledování jedné částice pomocí selektivní mikroskopie osvětlení v ohniskové rovině“, Optika Express, 16 (10), s. 7142–52, Bibcode:2008Oexpr..16.7142R, doi:10.1364 / OE.16.007142, ISSN 1094-4087, PMID 18545417
- ^ Jerome Fehrenbach; Pierre Weiss; Corinne Lorenzo (2012). „Variační algoritmy k odstranění stacionárního šumu: aplikace pro mikroskopické zobrazování“ (PDF). Transakce IEEE na zpracování obrazu. 21 (10): 4420–4430. Bibcode:2012ITIP ... 21.4420F. doi:10.1109 / TIP.2012.2206037. ISSN 1057-7149. PMID 22752131. S2CID 6828193.
- ^ Nobelova přednáška R. A. Zsigmondyho: Vlastnosti koloidů (včetně krátkého vysvětlení ultramikroskopu)
- ^ tisková zpráva LaVision Biotech Archivováno 24. prosince 2013 v Wayback Machine (zpřístupněno 4. 11. 2012)
- ^ Tisková zpráva společnosti Carl Zeiss o mikroskopickém systému Lightsheet Z.1 Light Sheet (přístupné 2012-11-15)
- ^ P. A. Santi (1. února 2011). „Fluorescenční mikroskopie na světelném listu: recenze“. Journal of Histochemistry & Cytochemistry. 59 (2): 129–138. doi:10.1369/0022155410394857. ISSN 0022-1554. PMC 3201139. PMID 21339178.
- ^ Webová stránka projektu OpenSPIM (zpřístupněno 8. 6. 2013)
- ^ Peter G Pitrone; Johannes Schindelin; Luke Stuyvenberg; Stephan Preibisch; Michael Weber; Kevin W Eliceiri; Jan Huisken; Pavel Tomancak (9. června 2013). „OpenSPIM: otevřená mikroskopická platforma pro světelné archy“. Přírodní metody. 10 (7): 598–9. arXiv:1302.1987. doi:10.1038 / nmeth.2507. ISSN 1548-7091. PMC 7450513. PMID 23749304.
- ^ Webová stránka projektu OpenSPIN (zpřístupněno 8. 6. 2013)
- ^ Emilio J Gualda, Tiago Vale, Pedro Almada, Jos A Feij, Gabriel G Martins, Nuno Moreno (9. června 2013). „OpenSpinMicroscopy: open-source integrated microscopy platform“. Přírodní metody. 10 (7): 599–600. doi:10.1038 / nmeth.2508. ISSN 1548-7091. PMID 23749300. S2CID 27935584.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Verveer, P. J .; Swoger, J .; Pampaloni, F .; Greger, K .; Marcello, M .; Stelzer, E. H. (2007). „Trojrozměrné zobrazování velkých vzorků s vysokým rozlišením pomocí mikroskopie na bázi lehkého archu“. Přírodní metody. 4 (4): 311–313. doi:10.1038 / nmeth1017. PMID 17339847. S2CID 12440781.
- ^ Jährling, Nina; Becker, Klaus; Wegenast-Braun, Bettina M .; Grathwohl, Stefan A .; Jucker, Mathias; Dodt, Hans-Ulrich (27. května 2015). Vitorica, Javier (ed.). „Mozková β-amyloidóza u myší vyšetřovaná ultramikroskopií“. PLOS ONE. 10 (5): e0125418. Bibcode:2015PLoSO..1025418J. doi:10.1371 / journal.pone.0125418. ISSN 1932-6203. PMC 4446269. PMID 26017149.
- ^ Corinne Lorenzo; Céline Frongia; Raphael Jorand; Jérome Fehrenbach; Pierre Weiss; Amina Maandhui; Guillaume Gay; Bernard Ducommun; Valérie Lobjois (2011). "Monitorování dynamiky dělení živých buněk ve 3D modelech velkých sféroidních nádorů pomocí mikroskopie světelného listu". Buněčné dělení. 6 (1): 22. doi:10.1186/1747-1028-6-22. ISSN 1747-1028. PMC 3274476. PMID 22152157.
- ^ Daisuke Takao; Atsushi Taniguchi; Takaaki Takeda; Seiji Sonobe; Shigenori Nonaka; Alexandre J. Kabla (5. prosince 2012), „Vysokorychlostní zobrazování pohybů améboidů pomocí mikroskopie se světelnými listy“, PLOS ONE, 7 (12), s. e50846, Bibcode:2012PLoSO ... 750846T, doi:10.1371 / journal.pone.0050846, ISSN 1932-6203, PMC 3515486, PMID 23227214
Další čtení
- Posouzení: P. A. Santi (1. února 2011). „Fluorescenční mikroskopie na světelném listu: recenze“. Journal of Histochemistry & Cytochemistry. 59 (2): 129–138. doi:10.1369/0022155410394857. ISSN 0022-1554. PMC 3201139. PMID 21339178.
- Přehled různých modalit LSFM a výsledků ve vývojové biologii: Huisken, J .; Stainier, D.Y.R. (22. května 2009). „Techniky selektivní mikroskopie osvětlení ve vývojové biologii“. Rozvoj. 136 (12): 1963–1975. doi:10.1242 / dev.022426. ISSN 0950-1991. PMC 2685720. PMID 19465594.
- Recenze LSFM pro zobrazování anatomických struktur: Buytaert, J .; Descamps, Emilie; Adriaens, Dominique; Dirckx, Joris J. J. (12. srpna 2011). „Rodina mikroskopů OPFOS: optické řezy biomedicínských vzorků s vysokým rozlišením“. Anatomy Research International. 2012: 206238–(1–9). arXiv:1106.3162. Bibcode:2011arXiv1106.3162B. doi:10.1155/2012/206238. PMC 3335623. PMID 22567307.
- Redakční: „Metoda roku 2014“. Přírodní metody. 12 (1): 1. 30. prosince 2014. doi:10.1038 / nmeth.3251. PMID 25699311.

externí odkazy
- Video typického experimentu ve vývojové biologii pomocí SPIM na Youtube: Propojené video ukazuje vývoj embrya ovocné mušky, který byl zaznamenán během 20 hodin. Jsou zobrazeny dvě projekce celé 3D datové sady.
- Iniciativa mesoSPIM. Open-source světelné mikroskopy pro zobrazování vymazané tkáně.