Uremie - Uremia
| Uremie | |
|---|---|
| Ostatní jména | Urémie |
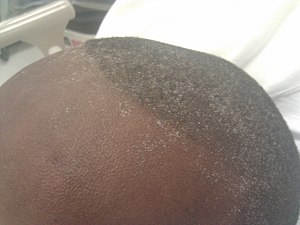 | |
| Uremický mráz přítomný na čele a pokožce hlavy mladého muže, který si stěžoval na anorexie a únava, s dusík močoviny v krvi a sérum kreatinin hladiny přibližně 100, respektive 50 mg / dl. | |
| Specialita | Nefrologie |
Uremie je podmínkou vysoké úrovně močovina v krvi. Močovina je jednou z hlavních složek moči. Lze jej definovat jako přebytek aminokyselina a metabolismus bílkovin konečné výrobky, jako např močovina a kreatinin v krvi, která by se normálně vylučovala močí. Uremický syndrom lze definovat jako terminální klinický projev selhání ledvin (také zvaný selhání ledvin).[1] Jedná se o příznaky, příznaky a výsledky laboratorních testů, které jsou výsledkem nedostatečné vylučovací, regulační a endokrinní funkce ledvin.[2] Oba uremie a uremický syndrom byly použity zaměnitelně k označení velmi vysoké koncentrace močoviny v plazmě, která je výsledkem selhání ledvin.[1] Původní označení bude použito pro zbytek článku.
Azotemie je podobný, méně závažný stav s vysokou hladinou močoviny, kde lze abnormalitu měřit chemicky, ale ještě není tak závažný, aby vyvolal příznaky. Uremia popisuje patologické a symptomatické projevy těžké azotemie.[1]
Neexistuje žádný konkrétní čas pro nástup uremie u lidí s progresivní ztrátou funkce ledvin. Lidé s funkcí ledvin pod 50% (tj rychlost glomerulární filtrace [GFR] mezi 50 a 60 ml / min) a ve věku nad 30 let může mít uremii do určité míry. To znamená, že přibližně 8 milionů lidí ve Spojených státech s GFR nižším než 60 ml / min má uremické příznaky.[3] Příznaky, jako je únava, mohou být velmi vágní, což ztěžuje diagnostiku zhoršené funkce ledvin. Léčba může být dialýza nebo a transplantace ledvin, ačkoli někteří pacienti se místo toho rozhodnou pro kontrolu příznaků a konzervativní péči.[3]
Příznaky a symptomy
Klasickými příznaky uremie jsou: progresivní slabost a snadná únava, ztráta chuti k jídlu způsobená nevolností a zvracením, svalová atrofie třes, abnormální duševní funkce, časté mělké dýchání a metabolická acidóza. Bez zásahu dialýzou nebo transplantací ledvin bude uremie způsobená selháním ledvin postupovat a způsobovat strnulost, kómu a smrt.[2] Protože uremie je většinou důsledkem selhání ledvin, její příznaky se často vyskytují souběžně s dalšími příznaky a příznaky selhání ledvin.
Rychlost glomerulární filtrace (GFR) měří množství plazmy v mililitrech, které je každou minutu filtrováno ledvinami. Jak GFR klesá, prognóza se zhoršuje. Některé z účinků lze zvrátit, i když dočasně, dialýzou.
| GFR (ml / min) | Účinky |
|---|---|
| 100–120 | Normální GFR |
| <60 | Mohou být přítomny uremické příznaky, snížená pohoda |
| 30–60 | Kognitivní porucha |
| 55 | Únava a snížená výdrž |
| <50 | Rezistence na inzulín |
| <30 | Zvyšování pravděpodobnosti příznaků |
| ≤15 | Selhání ledvin |
Reziduální syndrom
Lidé na dialýze získávají tzv. Reziduální syndrom.[5] Reziduální syndrom je život neohrožující onemocnění, které se projevuje jako toxické účinky způsobující mnoho stejných známek a příznaků jako uremie. Existuje několik hypotéz, proč je reziduální syndrom přítomen. Jsou to: hromadění velkých molekulární váha rozpuštěné látky, které jsou špatně dialyzovány (např. β2-mikroglobulin ); akumulace rozpuštěných látek s malou molekulovou hmotností vázaných na bílkoviny, které jsou špatně dialyzovány (např. p-krylsulfát a indoxylsulfát ); akumulace dialyzovatelných rozpuštěných látek, které jsou neúplně odstraněny (např. oddělené rozpuštěné látky, jako je fosfát v buňkách, nebo nedostatečná eliminace jiných toxičtějších rozpuštěných látek); nepřímé jevy jako např karbamylace bílkovin, kalcifikace tkání nebo toxický účinek hormonální nerovnováhy (např. parathormon ) a; toxické účinky samotné dialýzy (např. odstranění neznámých důležitých vitamínů nebo minerálů).[5][6] Dialýza prodlužuje délku života, ale pacienti mohou mít omezenější funkce. Trpí fyzickými omezeními, mezi něž patří narušení rovnováhy, rychlosti chůze a senzorických funkcí. Trpí také kognitivními poruchami, jako je porucha pozornosti, paměti a plnění úkolů vyššího řádu.[3] Pacienti byli udržováni déle než tři desetiletí na dialýze, ale průměrná úmrtnost a hospitalizace jsou vysoké. Rehabilitace pacientů a kvalita života jsou také špatné.[3][5]
Příčiny
Stavy způsobující zvýšenou hladinu močoviny v krvi spadají do tří různých kategorií: prerenální, renální a postrenální.
Prerenální azotemie může být způsobena sníženým průtokem krve ledvinami (např. nízký krevní tlak, městnavé srdeční selhání, šokovat, krvácející, dehydratace ) nebo zvýšenou produkcí močoviny v játrech prostřednictvím stravy s vysokým obsahem bílkovin nebo zvýšenou proteinový katabolismus (např. stres, horečka, závažné onemocnění, kortikosteroidy nebo gastrointestinální krvácení).[1]
Příčiny ledvin lze připsat snížené funkci ledvin. Patří mezi ně akutní a chronické selhání ledvin akutní a chronické glomerulonefritida, tubulární nekróza, a další onemocnění ledvin.[1]
Postrenální příčiny mohou být způsobeny sníženou eliminací močoviny. Může to být způsobeno obstrukcí odtoku moči, například kameny, nádory močového měchýře nebo prostaty, nebo závažnou infekcí.[1]
Diagnóza
Podrobná a přesná historie a fyzikální nálezy vám pomohou určit, zda je uremie akutní nebo chronická. V případě akutní uremie mohou být příčiny identifikovány a odstraněny, což vede k vyšší šanci na obnovení normální funkce ledvin, pokud je léčena správně.[7]
Krevní testy
Primární testy prováděné pro diagnostiku uremie jsou základní metabolický panel se sérem vápník a fosfor vyhodnotit GFR, dusík močoviny v krvi a kreatinin stejně jako sérum draslík, fosfát, vápník a sodík úrovně. Hlavní abnormalita je velmi nízká GFR (<30 ml / min). Uremia prokáže zvýšení močoviny i kreatininu, pravděpodobně zvýšené hladiny draslíku, vysokého fosfátu a normálního nebo mírně vysokého obsahu sodíku, jakož i pravděpodobné snížení hladiny vápníku. Jako základní zpracování lékař vyhodnotí také anémie a funkce štítné žlázy a příštítných tělísek. Chronická anémie může být zlověstným známkou prokázaného selhání ledvin. Panely štítné žlázy a příštítných tělísek pomohou zvládnout jakékoli příznaky únavy a také určí abnormality vápníku, které se vztahují k uremii versus dlouhodobé nebo nesouvisející onemocnění metabolismu vápníku.
Testy moči
Alternativou může být 24hodinový odběr moči pro stanovení clearance kreatininu, i když ne velmi přesný test vzhledem k postupu odběru. Další laboratorní test, který by měl být zvážen, je analýza moči s mikroskopickým vyšetřením na přítomnost bílkovin, odlitků, krve a pH.[7]
Radioizotopové testy
Nejdůvěryhodnějším testem pro stanovení GFR je iothalamate odbavení. Může to však být nákladné a časově náročné. Klinické laboratoře obecně vypočítávají GFR pomocí úprava stravy při onemocnění ledvin (MDRD) vzorec nebo Cockcroft-Gaultův vzorec.[7]
jiný
Navíc, koagulační studie může indikovat prodlouženou dobu krvácení s jinak normálními hodnotami
Mechanismus
Výsledkem uremie je zadržování mnoha různých sloučenin v těle. Při selhání ledvin se mohou tyto sloučeniny hromadit na nebezpečné úrovně. Bylo identifikováno více než 90 různých sloučenin. Některé z těchto sloučenin mohou být pro tělo toxické.
| Skupina solute | Příklad | Zdroj[poznámka 1] | Vlastnosti |
|---|---|---|---|
| Peptidy a malé bílkoviny | β2-mikroglobulin | přístřešek z hlavní komplex histokompatibility | špatně dialyzovaný kvůli velké velikosti |
| Guanidiny | kyselina guanidinosukcinová | arginin | zvýšená produkce uremie |
| Fenoly | ρ-krylsulfát | fenylalanin, tyrosin | vázané na bílkoviny, produkované střevními bakteriemi |
| Indolové | indián | tryptofan | vázané na bílkoviny, produkované střevními bakteriemi |
| Alifatické aminy | dimethylamin | cholin | velký distribuční objem produkovaný střevními bakteriemi |
| Polyoly | CMPF | neznámý | pevně vázán na bílkoviny |
| Ucleosidy | pseudouridin | tRNA | nejvýznamnější z několika pozměněných druhů RNA |
| Dikarboxylové kyseliny | šťavelan | kyselina askorbová | tvorba usazenin krystalů |
| Karbonyly | glyoxal | glykolytické meziprodukty | reakce s proteiny za vzniku konečných produktů pokročilé glykace |
Uremické toxiny
Uremické toxiny jsou jakékoli biologicky aktivní sloučeniny, které jsou zadržovány v důsledku poškození ledvin.[4] Mnoho uremických solí může být také uremický toxin.
Močovina byla jedním z prvních identifikovaných metabolitů. Jeho odstranění přímo souvisí s přežitím pacienta, ale jeho účinek na tělo není dosud jasný. Přesto není jisté, že příznaky spojené s uremií jsou ve skutečnosti způsobeny nadbytkem močoviny, protože jedna studie prokázala, že uremické příznaky byly zmírněny zahájením dialýzy, i když byla do dialyzátu přidána močovina k udržení hladiny dusíku v moči v krvi přibližně 90 mg na deciliter (tj. přibližně 32 mmol na litr).[3] Močovina může být předchůdcem toxičtějších molekul, ale je pravděpodobnější, že poškození těla je způsobeno kombinací různých sloučenin, které mohou působit jako inhibitory enzymů nebo šílenství membránový transport.[2] Indoxylsulfát je jedním z lépe charakterizovaných uremických toxinů. Bylo prokázáno, že indoxylsulfát zhoršuje vaskulární zánět v ateroskleróza modulací makrofág chování.[8][9]
| Toxin | Účinek | Reference |
|---|---|---|
| Močovina | Při vysokých koncentracích [> 300 mg / dl (> 50 mmol / l)]: bolesti hlavy, zvracení, únava, karbamylace proteinů | [2] |
| Kreatinin | Možná ovlivňuje glukózovou toleranci a přežití erytrocytů | [2] |
| Kyanát | Ospalost a hyperglykémie, karbamylace bílkovin a změněné funkce bílkovin v důsledku toho, že jsou produktem rozpadu močoviny | [2] |
| Polyoly (např., myoinositol ) | Periferní neuropatie | [2] |
| Fenoly | Mohou být vysoce toxické, protože jsou rozpustné v tucích, a proto mohou snadno procházet buněčnými membránami | [2] |
| "Střední molekuly"[poznámka 2] | Pacienti na peritoneální dialýze čistí střední molekuly účinněji než pacienti na hemodialýze. Vykazují méně známek neuropatie než hemodialyzovaní pacienti | [2] |
| β2-Mikroglobulin | Renální amyloid | [2] |
| Indoxylsulfát | Indukuje renální dysfunkce a kardiovaskulární dysfunkce; spojený s chronické onemocnění ledvin a kardiovaskulární onemocnění | [8] [9] [10] |
| ρ-krylsulfát | Hromadí se a předpovídá chronické onemocnění ledvin | [10] |
Biochemické vlastnosti
Je ovlivněna řada regulačních funkcí těla. Regulace tělesných tekutin, retence solí, vylučování kyselin a dusíkatých metabolitů jsou narušeny a mohou značně kolísat. Regulace tělesných tekutin je narušena v důsledku selhání vylučování tekutin nebo v důsledku ztráty tekutin při zvracení nebo průjmu. Regulace soli je narušena, když je příjem soli nízký nebo je nedostatečný cévní objem. Vylučování kyselin a vylučování dusíkatých metabolitů je narušeno ztrátou funkce ledvin.[2]
| Zadržené dusíkaté metabolity | Poruchy tekutin, kyselin a zásad a elektrolytů | Nesnášenlivost sacharidů | Anormální metabolismus lipidů | Změněná endokrinní funkce |
|---|---|---|---|---|
| Močovina | Opravená osmolalita moči | Rezistence na inzulín (může také dojít k hypoglykémii) | Hypertriglyceridemie | Sekundární hyperparatyreóza |
| Kyanát | Metabolická acidóza | Normální nebo zvýšený plazmatický inzulin | Snížený cholesterol s vysokou hustotou lipoproteinů | Změněný metabolismus tyroxinu |
| Kreatinin | Hyponatrémie nebo hypernatremie nebo hyperkalcémie | Zpožděná reakce na načtení sacharidů | Hyperlipoproteinemie | Hyperreninémie a hyperaldosteronismus |
| Sloučeniny guanidinu | Hyperchloremie | Hyperglukagonémie | Hyporeninémie | |
| "Střední molekuly"[poznámka 2] | Hypokalcémie | Hypoaldosteronismus | ||
| Kyselina močová | Hyperfosfatémie | Snížená produkce erytropoetinu | ||
| Hypermagnezémie | Gonadální dysfunkce (zvýšená prolaktin a luteinizační hormon, snížil testosteron ) | |||
| Snížení sodno-draselná ATPáza aktivita | Zvýšené sérum gastrin a melanocyty stimulující hormon |
Dějiny
Močovina byla krystalizována a identifikována v letech 1797 až 1808.[11] Během této doby se předpokládalo, že močovina bude zdrojem amoniaku v moči, a byla potvrzena v roce 1817. Předpokládalo se, že přebytek močoviny může vést ke specifickým poruchám. Později v roce 1821 se potvrdilo, že tělo produkovalo močovinu a že se vylučovalo ledvinami.[11] V roce 1827 byla močovina poprvé syntetizována v laboratoři, což potvrdilo její složení a stala se první syntetizovanou biologickou látkou. V roce 1856 byla vyrobena močovina in vitro oxidací proteinů. Bylo to v roce 1850 Thomas Dutrochet zavedl myšlenku dialýzy objevem oddělení menších molekul od větších molekul přes semipermeabilní membránu.[11] Bylo to v letech 1829 a 1831, kdy byl získán přesvědčivý důkaz, že u některých pacientů byla zvýšená hladina močoviny v krvi. Rovněž navrhli, že by tím mohlo dojít ke škodě. Pozdější výzkumy naznačují, že hlavní neurologické poruchy jako kóma a křeče nekorelují s fyzickými nálezy, které zahrnovaly generalizovaný otok mozku. To naznačuje, že uremie byla formou otravy krve.[11] V roce 1851, E.T. Frerich popsal klinický uremický syndrom a navrhl, že toxicita je mechanismem jeho příčiny. Bylo to v roce 1856, kdy J. Picard vyvinul citlivou metodu pro reprodukovatelné měření močoviny v krvi. Byl schopen detekovat 40% pokles koncentrace močoviny mezi renální tepnou a renální žílou. Tato práce upevnila skutečnost, že selhání ledvin se shodovalo se zvýšením močoviny v krvi. Byl to J. Picard s E.T. Frerichova práce, která tento termín vytvořila uremie populární.[11]
Ústní projevy
Orální příznaky uremie lze nalézt až u 90% pacientů s ledvinami. Pacienti mohou mít v ústech chuť a vůni podobnou amoniaku, stomatitida, zánět dásní, snížený tok slin, xerostomie a parotitis.[12]
Jedním z prvních příznaků selhání ledvin je uremický plod. Jedná se o zápach amoniaku v ústech způsobený vysokou koncentrací močoviny ve slinách, která se následně rozpadá na amoniak.[12] Jak se zvyšuje hladina dusíku v močovině v krvi (BUN), může se u pacienta objevit uremická stomatitida. Uremická stomatitida se jeví jako pseudomembrána nebo upřímné ulcerace se zarudnutím a pultovitou srstí v ústech. Tyto léze mohou souviset s vysokou hladinou BUN> 150 mg / dl a spontánně zmizí, když je hladina BUN snížena lékařským ošetřením. Předpokládá se, že je to způsobeno ztrátou tkáňového odporu a neschopností odolat traumatizujícím vlivům.[12] Kromě toho se u pacienta může objevit vzácný projev, který je uremický mráz. Je to bílý povlak nacházející se na kůži nebo v ústech, je způsoben zbytkovými krystaly močoviny, které zůstaly na povrchu epitelu po pocení a odpaření slin, nebo v důsledku sníženého toku slin.[12] Xerostomie je běžný orální nález, je výsledkem kombinace přímého postižení slinných žláz, chemického zánětu, dehydratace a dýchání ústy.[12] Může to být způsobeno omezeným příjmem tekutin, nepříznivými účinky farmakoterapie nebo nízkou rychlostí slin.[13] Někdy lze vidět otok slin.[12]
U pacientů s onemocněním ledvin bledost ústní sliznice lze někdy pozorovat kvůli anémii způsobené snížením erytropoetinu. Uremie může vést ke změně agregace krevních destiček. Tato situace v kombinaci s použitím heparin a další antikoagulancia při hemodialýze způsobují náchylnost pacientů ekchymóza, petechie, a krvácení v ústní dutině.[13] Může to také vést k mukozitida a glositida které mohou způsobit bolest a zánět jazyka a sliznice úst. Kromě toho mohou pacienti také zaznamenat změněné chuťové vjemy, dysgeuzie a být náchylní k bakteriálním a kandidózovým infekcím. Kandidóza je častější u pacientů po transplantaci ledvin z důvodu generalizované imunosuprese.[13]
U dětí s onemocněním ledvin hypoplázie skloviny byl pozorován primární a trvalý chrup. Abnormality zubního vývoje korelují s věkem, ve kterém dochází k metabolickým poruchám. Například hypoplázie skloviny ve formě bílého nebo hnědého zabarvení primárních zubů je běžně pozorována u malých dětí s časným nástupem onemocnění ledvin.[13] Špatná ústní hygiena, strava bohatá na sacharidy, oslabení související s chorobami, hypoplastická sklovina, nízký průtok slinami a dlouhodobá léčba přispívají ke zvýšenému riziku kaz formace.[13] Pacienti však obvykle mají nízkou aktivitu kazu, zejména u dětí.[12] To je způsobeno přítomností vysoce pufrovaných a alkalických slin způsobených vysokou koncentrací močovinového dusíku a fosfátu ve slinách. PH slin bude obvykle nad kritickou úrovní pH pro demineralizaci skloviny, což pomáhá předcházet tvorbě zubního kazu.[13] Kromě toho je u pacientů s onemocněním ledvin častým nálezem zúžení pulpů a kalcifikace.[13] U pacientů, kteří jsou na dialýze, nevolnost a zvracení způsobené dialýzou může vést k těžkým eroze zubů.[12]
Zubní úvahy
Při léčbě pacientů s renální insuficiencí by měl zubař shromáždit kompletní anamnézu, se zvláštním důrazem na nemoci související s ESRD, léky s předepsanými dávkami, parametry krve, načasování a typ dialýzy.[14] Tyto aspekty lze v případě potřeby přímo prodiskutovat s nefrologem. Jakékoli změny v lécích nebo jiné aspekty léčby musí být předem odsouhlaseny nefrologem.[15]
Zubní vyšetření u těchto pacientů spočívá v neinvazivním úplném posouzení zubních, parodontálních a slizničních tkání s rentgenovými snímky, které usnadňují diagnostický proces. Měly by být zachyceny všechny potenciální ohniska infekce; zahrnují parodontální a endodontické léze, zbytkové kořeny, částečně vybuchlé a nesprávně umístěné třetí stoličky, periimplantitidu a slizniční léze. Při podezření na paradentózu je třeba zaznamenat periodontální graf. Ortodontické pomůcky lze udržovat, pokud nenarušují ústní hygienu.[14]
Uremie se běžně vyskytuje u pacientů, kteří podstupují dialýzu kvůli renální nedostatečnosti. U hemodialyzovaných pacientů je důležité určit plán léčby. Zubní léčba by měla být zahájena den po hemodialýze z několika důvodů: nedochází k hromadění uremických toxinů v krvi a chybí cirkulující heparin. Léčba by neměla začít ve stejný den jako hemodialýza, protože pacienti se obvykle cítí špatně a jejich krev je heparinizována, což by mohlo způsobit nadměrné krvácení. U pacientů podstupujících peritoneální dialýzu neexistují žádné kontraindikace zubního ošetření, s výjimkou případů akutních peritoneálních infekcí, kdy by měl být odložen volitelný postup.[12][15]
Při polohování pacienta je třeba dbát zvláštní opatrnosti, aby nedošlo k stlačení paže s cévním přístupem pro hemodialýzu. Injekce nebo měření krevního tlaku by neměly být prováděny na paži s arteriovenózní (AV) píštělí. Pokud se AV místo nachází na noze, měl by se pacient dlouhodobě vyhýbat sedění, protože by mohlo dojít k ucpání žilního odtoku. Během dlouhých zubních zákroků by měl zubní lékař umožnit pacientům s AV místy na nohou krátkou procházku nebo chvíli stát každou hodinu.
V případě nadměrného krvácení, které se běžně vyskytuje u uremie a selhání ledvin, je třeba nasadit hemostatické pomůcky. K zvládnutí pooperačního krvácení by se rutinně měly používat techniky primárního uzavření a lokální hemostatické látky. Ke snížení krvácení během a po zákroku lze použít kyselinu tranexamovou, a to buď jako výplach nebo jako orální prostředek.[12][15]
Pacienti podstupující dialýzu jsou vystaveni četným transfuzi a imunosupresi související se selháním ledvin; jsou tedy vystaveni většímu riziku infekce virem lidské imunodeficience (HIV) a hepatitidou typu B a C. Je důležité přijmout opatření k tlumení infekce, aby se zabránilo křížové kontaminaci v zubní klinice a zabránilo riziku expozice zubnímu personálu.[15]
Většina léků je vylučována z těla alespoň částečně ledvinami. V důsledku selhání ledvin se plazmatické poločasy léčiv normálně vylučovaných močí prodlouží, což povede ke zvýšené toxicitě. Mnoho léků, které se normálně bezpečně podávají, nelze podávat pacientům se sníženou funkcí ledvin. Kromě toho lze podat některé léky, ale je nutné snížit dávku. U pacientů podstupujících dialýzu však bude pozorován snížený plazmatický poločas léčiv.[12] Antibiotika z rodin aminoglykosidů a tetracyklinů je třeba se vyhnout kvůli jejich nefrotoxicitě. Antibiotika volby jsou peniciliny, klindamycin a cefalosporiny, které lze podávat v normálních dávkách, i když se terapeutický rozsah rozšíří.[15] U analgetik je paracetamol volbou volby pro případy epizodické bolesti. Aspirin se vyznačuje protidoštičkovou aktivitou, a proto by se jeho použití nemělo používat u uremických pacientů.[15] Úkolem farmakoterapie u pacientů s onemocněním ledvin je udržet terapeutickou hladinu léku v úzkém rozmezí, aby se zabránilo subterapeutickému dávkování a toxicitě.[12]
Poznámky
- ^ Může existovat více zdrojů. Je uveden pouze jeden.
- ^ A b Mezi „střední molekuly“ patří: atriální natriuretický peptid, cystatin C., delta spánkový indukující peptid, interleukin-6, faktor nekrózy nádorů alfa, a parathormon.
Reference
- ^ A b C d E F Bishop, M.L .; Fody, E.P .; Schoeff, L.E. (2010). Klinická chemie: techniky, principy, korelace (6. vydání). Lippincott Williams a Wilkins. p.268.
- ^ A b C d E F G h i j k l Burtis, C. A.; Ashwood, E.R .; Bruns, D.E. Tietz (2006). Učebnice klinické chemie a molekulární diagnostiky (5. vydání). Elsevier Saunders. p.1554.
- ^ A b C d E F G h i Meyer TW; Hostetter, TH (2007). „Uremie“. N Engl J Med. 357 (13): 1316–25. doi:10.1056 / NEJMra071313. PMID 17898101.
- ^ A b Almeras, C .; Argiles, A. (2009). "Celkový obraz uremie". Semin. Vytočit. 22 (44): 321–322. doi:10.1111 / j.1525-139X.2009.00575.x. PMID 19708976.
- ^ A b C d E Depner, T.A. (2001). "Uremická toxicita: močovina a další". Semin. Vytočit. 14 (4): 246–251. doi:10.1046 / j.1525-139X.2001.00072.x. PMID 11489197.
- ^ Dobre, M .; Meyer, T.W .; Hostetter, T.H. (2012). „Hledání uremických toxinů“. Clin J Am Soc Nephrol. 8 (2): 1–6. doi:10,2215 / CJN.04260412. PMC 3562857. PMID 23024165.
- ^ A b C „Zpracování uremie“. Medscape Brent Alper Jr.
- ^ A b Nakano, T; Katsuki, S; Chen, M; Decano, JL; Halu, A; Lee, LH; Pestana, DVS; Kum, AST; Kuromoto, RK; Golden, WS; Boff, MS; Guimaraes, GC; Higashi, H; Kauffman, KJ; Maejima, T; Suzuki, T; Iwata, H; Barabási, AL; Aster, JC; Anderson, DG; Sharma, A; Singh, SA; Aikawa, E; Aikawa, M (2. ledna 2019). „Uremický toxin indoxylsulfát podporuje prozánětlivou aktivaci makrofágů souhrou signalizace OATP2B1 a Dll4“. Oběh. 139 (1): 78–96. doi:10.1161 / CIRCULATIONAHA.118.034588. PMC 6311723. PMID 30586693.
- ^ A b Hoyer, FF; Nahrendorf, M (2. ledna 2019). „Uremické toxiny aktivují makrofágy“. Oběh. 139 (1): 97–100. doi:10.1161 / CIRCULATIONAHA.118.037308. PMC 6394415. PMID 30592654.
- ^ A b Zhang LS, Davies SS (duben 2016). „Mikrobiální metabolismus složek stravy na bioaktivní metabolity: příležitosti pro nové terapeutické intervence“. Genome Med. 8 (1): 46. doi:10.1186 / s13073-016-0296-x. PMC 4840492. PMID 27102537.
Tabulka 2: Mikrobiální metabolity: jejich syntéza, mechanismy působení a účinky na zdraví a nemoci
Obrázek 1: Molekulární mechanismy působení indolu a jeho metabolitů na fyziologii a nemoc hostitele - ^ A b C d E Richet, Gabriel (1988). "Časná historie uremie". Ledviny International. 33 (5): 1013–1015. doi:10.1038 / ki.1988.102. PMID 3292814.
- ^ A b C d E F G h i j k l Burketův orální lék. Glick, Michael (12. vydání). Shelton, Connecticut. ISBN 978-1-60795-280-0. OCLC 903962852.CS1 maint: ostatní (odkaz)
- ^ A b C d E F G Gupta, Megha; Gupta, Mridul; Abhishek (červenec 2015). „Orální stavy u poruch ledvin a úvahy o léčbě - recenze pro dětského zubaře“. Saúdský zubní deník. 27 (3): 113–119. doi:10.1016 / j.sdentj.2014.11.014. ISSN 1013-9052. PMC 4501439. PMID 26236123.
- ^ A b Costantinides, Fulvia; Castronovo, Gaetano; Vettori, Erica; Frattini, Costanza; Artero, Mary Louise; Bevilacqua, Lorenzo; Berton, Federico; Nicolin, Vanessa; Di Lenarda, Roberto (13. 11. 2018). „Péče o zuby u pacientů s onemocněním ledvin v konečném stadiu a podstupujícím hemodialýzu“. International Journal of Dentistry. 2018: 9610892. doi:10.1155/2018/9610892. ISSN 1687-8728. PMC 6258100. PMID 30538746.
- ^ A b C d E F Dioguardi, Mario; Caloro, Giorgia Apollonia; Troiano, Giuseppe; Giannatempo, Giovanni; Laino, Luigi; Petruzzi, Massimo; Lo Muzio, Lorenzo (02.01.2016). "Orální projevy u pacientů s chronickou uremií". Selhání ledvin. 38 (1): 1–6. doi:10.3109 / 0886022X.2015.1103639. ISSN 0886-022X. PMID 26513593.
externí odkazy
- Uremie, WebMD.com
- Porozumění uremii, uspharmacist.com
| Klasifikace | |
|---|---|
| Externí zdroje |