Lanosterol syntáza - Lanosterol synthase
| lanosterol syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 5.4.99.7 | ||||||||
| Číslo CAS | 9032-71-7 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Lanosterol syntáza je oxidosqualen cykláza (OSC) enzym který převádí (S) -2,3-oxidosqualen k protosterolovému kationtu a nakonec k lanosterol.[5] Lanosterol je klíčový čtyřkruhový meziprodukt v cholesterol biosyntéza.[6][7] U lidí je lanosterol syntáza kódována LSS gen.[8][9]
v eukaryoty, lanosterol syntáza je integrální monotopový protein spojené s cytosolický strana endoplazmatické retikulum.[10] Některé důkazy naznačují, že enzym je rozpustný,vázané na membránu protein v několika málo prokaryoty které to produkují.[11]
Vzhledem k roli enzymu v cholesterol biosyntéza, existuje zájem o lanosterol syntázu inhibitory jako potenciální léky snižující hladinu cholesterolu k doplnění stávajících statiny.[12]
Mechanismus
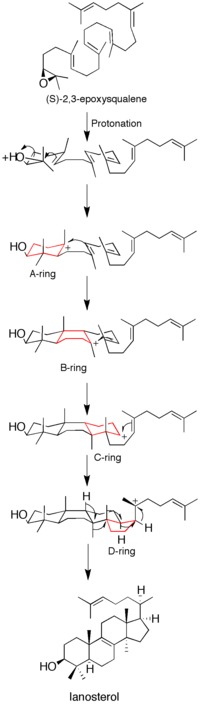
Ačkoli některá data o mechanismu byla získána použitím inhibitory sebevraždy, mutageneze studie a homologické modelování, stále ještě není zcela pochopeno, jak enzym katalyzuje vznik lanosterol.[12]
Počáteční protonace epoxidu a otevření kruhu
Před získáním bílkovin Rentgenová krystalová struktura, místně zaměřená mutageneze byl použit ke stanovení zbytků klíčových pro katalytickou aktivitu enzymu. Bylo zjištěno, že kyselina asparagová zbytek (D455) a dva histidin zbytky (H146 a H234) byly nezbytné pro funkci enzymu. Corey a kol. předpokládal, že kyselina asparagová působí protonací substrátu epoxid prsten, čímž se zvyšuje jeho náchylnost k intramolekulární útok nejbližší dvojná vazba s tím, že H146 možná zesiluje schopnost donoru protonů kyselinou asparagovou vodíkové vazby.[13] Po získání Rentgenová krystalová struktura enzymu byla potvrzena role D455 jako donoru protonu k epoxidu substrátu, i když bylo zjištěno, že D455 je více stabilizován vodíkovou vazbou ze dvou cystein zbytky (C456 a C533) než z dříve navrženého histidinu.[12]
Kaskáda formování prstenů
Epoxidová protonace aktivuje substrát a nastartuje kaskádu kruhových reakcí. Celkem jsou vytvořeny čtyři kruhy (A až D), které produkují cholesterol páteř.[12] I když myšlenka na společnou formaci všech čtyř prstenů byla v minulosti zábavná, kinetické studie s (S) -2,3-oxidosqualen analogy ukázaly, že tvorby produktu je dosaženo diskrétní karbokace meziprodukty (viz Obrázek 1). Izolace monocyklických a bicyklických produktů z mutantů lanosterol syntázy dále oslabila hypotézu o společném mechanismu.[14][15] Důkazy naznačují, že otevření epoxidového kruhu a tvorba kruhu A jsou spojeny.[16]
Struktura
Lanosterol syntáza je dvoudoménový monomerní protein[10] složený ze dvou spojených (α / α) hlavních domén a tří menších β-struktury. Enzym Aktivní stránky je ve středu proteinu, uzavřen zúženým kanálem. Průchod substrátu (S) -2,3-epoxysqualenu kanálem vyžaduje změnu v proteinová konformace. v eukaryoty, a hydrofobní povrch (6% z celkového povrchu enzymu) je ER oblast vázající membránu (viz Obrázek 2).[12]
Enzym obsahuje pět oblastí otisků prstů obsahujících Gln -Trp motivy, které jsou také přítomny ve vysoce analogickém bakteriálním enzymu skvalen-hopen cykláza.[12] Zbytky těchto oblastí otisků prstů obsahují skládané postranní řetězce, o nichž se předpokládá, že během vysoké přispívají k stabilitě enzymů exergonický cyklizační reakce katalyzované enzymem.[17]
Funkce
Katalýza tvorby lanosterolu
Lanosterol syntáza katalyzuje přeměnu (S) -2,3-epoxyskvalen na lanosterol, klíčový čtyřkruhový meziprodukt cholesterol biosyntéza.[6][7] To tedy zase poskytuje předchůdce estrogeny, androgeny, progestogeny, glukokortikoidy, mineralokortikoidy, a neurosteroidy. v eukaryoty enzym je vázán na cytosolický strana endoplazmatické retikulum membrána.[10] Zatímco cholesterol syntéza je většinou spojena s eukaryoty, málo prokaryoty bylo zjištěno, že exprimují lanosterol syntázu; bylo zjištěno jako rozpustný protein v Methylococcus capsulatus.[11]
Katalýza tvorby epoxylanosterolu
Lanosterol syntáza také katalyzuje cyklizaci 2,3; 22,23-diepoxysqualenu na 24 (S), 25-epoxylanosterol,[18] který se později převede na 24 (S), 25-epoxycholesterol.[19] Protože enzymová afinita pro tuto sekundu Podklad je větší než pro monoepoxy (S) -2,3-epoxysqualen, při částečné inhibiční konverzi 2,3; 22,23-diepoxysqualen na 24 (S), 25-epoxylanosterol je upřednostňován před lanosterol syntéza.[20] To má význam pro prevenci a léčbu nemocí.
Klinický význam
Inhibitory enzymů jako léky snižující hladinu cholesterolu
Zájem vzrostl o inhibitory lanosterol syntázy jako léky na snížení hladiny cholesterolu v krvi a léčbu ateroskleróza. Široce populární statin léky v současné době používané ke snížení LDL (lipoprotein s nízkou hustotou) cholesterol funkce inhibicí HMG-CoA reduktáza aktivita.[6] Protože tento enzym katalyzuje tvorbu prekurzorů daleko proti proudu (S) -2,3-epoxyskvalen a cholesterol, statiny může negativně ovlivnit množství meziproduktů potřebných pro jiné biosyntetické dráhy (např. syntéza isoprenoidy, koenzym Q ). Tudíž lanosterol syntáza, která je více vázána na biosyntézu cholesterolu než HMG-CoA reduktáza, je atraktivní drogový cíl.[21]
Předpokládá se, že inhibitory lanosterol syntázy snižují LDL a VLDL cholesterol mechanismem dvojí kontroly. Studie, ve kterých je lanosterol syntáza částečně inhibována, ukázaly jak přímé snížení lanosterol tvorba a pokles HMG-CoA reduktáza aktivita. The oxysterol 24 (S), 25-epoxylanosterol, který se přednostně tvoří nad lanosterol během částečné inhibice lanosterol syntázy se předpokládá, že je zodpovědný za tuto inhibici HMG-CoA reduktáza aktivita.[22]
Vývoj
Předpokládá se, že oxidosqualencyklázy (OSC, třída, do které lanosterol cykláza patří) se vyvinuly z bakteriální skvalen-hopen cyklázy (SHC), která se podílí na tvorbě hopanoidy. Fylogenetické stromy konstruované z aminokyselinových sekvencí OSC v různých organismech naznačují jediného společného předka a že syntéza se vyvinula pouze jednou.[23] Objev sterany počítaje v to cholestan v břidlicích starých 2,7 miliardy let z Pilbara Craton, Austrálie, to naznačuje eukaryoty s OSC a komplexním steroidním aparátem byly přítomny na počátku historie Země.[24]
Reference
- ^ A b C ENSG00000281289 GRCh38: Vydání souboru 89: ENSG00000160285, ENSG00000281289 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000033105 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Dean PD, Ortiz de Montellano PR, Bloch K, Corey EJ (červen 1967). „Rozpustný 2,3-oxidoskvalen-sterolcykláza“. The Journal of Biological Chemistry. 242 (12): 3014–5. PMID 6027261.
- ^ A b C Huff MW, Telford DE (červenec 2005). „Pán prstenů - mechanismus pro oxidosqualen: lanosterol cykláza se stává křišťálově čistou“. Trendy ve farmakologických vědách. 26 (7): 335–340. doi:10.1016 / j.tips.2005.05.004. PMID 15951028.
- ^ A b Yamamoto S, Lin K, Bloch K (květen 1969). „Některé vlastnosti mikrozomální 2,3-oxidoskvalen-sterolcyklázy“. Sborník Národní akademie věd Spojených států amerických. 63 (1): 110–7. Bibcode:1969PNAS ... 63..110Y. doi:10.1073 / pnas.63.1.110. PMC 534008. PMID 5257956.
- ^ Baker CH, Matsuda SP, Liu DR, Corey EJ (srpen 1995). "Molekulární klonování lidského genu kódujícího lanosterol syntázu z jaterní cDNA knihovny". Sdělení o biochemickém a biofyzikálním výzkumu. 213 (1): 154–160. doi:10.1006 / bbrc.1995.2110. PMID 7639730.
- ^ Young, Michele; Chen, Haiming; Lalioti, Maria D .; Antonarakis, Stylianos E. (květen 1996). "Gen lidského lanosterol syntázy se mapuje na chromozom 21q22.3". Genetika člověka. 97 (5): 620–624. doi:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- ^ A b C Ruf A, Müller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (březen 2004). „Monotopový membránový protein, lidská oxidoskvalencykláza, je aktivní jako monomer“. Sdělení o biochemickém a biofyzikálním výzkumu. 315 (2): 247–254. doi:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- ^ A b Lamb DC, Jackson CJ, Warrilow AG, Manning NJ, Kelly DE, Kelly SL (srpen 2007). „Biosyntéza lanosterolu v prokaryotu Methylococcus capsulatus: pohled na vývoj biosyntézy sterolu“. Molekulární biologie a evoluce. 24 (8): 1714–1721. doi:10,1093 / molbev / msm090. PMID 17567593.
- ^ A b C d E F Thoma R, Schulz-Gasch T, D'Arcy B, Benz J, Aebi J, Dehmlow H, Hennig M, Stihle M, Ruf A (listopad 2004). „Pohled na tvorbu steroidního lešení ze struktury lidské oxidoskvalencyklázy“. Příroda. 432 (7013): 118–122. Bibcode:2004 Natur.432..118T. doi:10.1038 / nature02993. PMID 15525992. S2CID 364281.
- ^ Corey EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (únor 1997). "Studie na vazebných segmentech substrátu a katalytickém působení lanosterol syntázy. Afinitní značení s karbokacemi odvozenými z analogů založených na mechanismech 2, 3-oxidoskvalenu a sond zaměřených na mutagenezi". J. Am. Chem. Soc. 119 (6): 1289–96. doi:10.1021 / ja963228o.
- ^ Wu TK, Wang TT, Chang CH, Liu YT, Shie WS (listopad 2008). "Význam Saccharomyces cerevisiae zbytku oxidoskvalen-lanosterol cyklázy tyrosinu 707 pro tvorbu bicyklického kruhu na křesle a deprotonační reakce". Organické dopisy. 10 (21): 4959–62. doi:10.1021 / ol802036c. PMID 18842050.
- ^ Joubert BM, Hua L, Matsuda SP (únor 2000). "Sterický objem v poloze 454 v Saccharomyces cerevisiae lanosterol synthase ovlivňuje tvorbu B-kruhu, ale ne deprotonaci". Organické dopisy. 2 (3): 339–41. doi:10.1021 / ol9912940. PMID 10814317.
- ^ Corey EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (únor 1997). "Metodika pro přípravu čisté rekombinantní S. cerevisiae Lanosterol Synthase pomocí bakulovirového expresního systému. Důkaz, že při biosyntéze lanosterolu z 2,3-oxidosqualenu dochází ke štěpení oxiranem a tvorbě A-kruhu". J. Am. Chem. Soc. 119 (6): 1277–88. doi:10.1021 / ja963227w.
- ^ Wendt KU, Poralla K, Schulz GE (září 1997). "Struktura a funkce skvalen cyklázy". Věda. 277 (5333): 1811–15. doi:10.1126 / science.277.5333.1811. PMID 9295270.
- ^ Corey EJ, Gross SK (srpen 1967). „Tvorba sterolů působením 2,3-oxidoskvalen-sterolcyklázy na faktické substráty 2,3: 22,23-dioxidosqualen a 2,3-oxido-22,23-dihydrosqualen“. Journal of the American Chemical Society. 89 (17): 4561–2. doi:10.1021 / ja00993a079. PMID 6046552.
- ^ Nelson JA, Steckbeck SR, Spencer TA (únor 1981). „Biosyntéza 24,25-epoxycholesterolu ze skvalenu 2,3; 22,23-dioxidu“. The Journal of Biological Chemistry. 256 (3): 1067–8. PMID 7451488.
- ^ Boutaud O, Dolis D, Schuber F (říjen 1992). „Preferenční cyklizace 2,3 (S): 22 (S), 23-dioxidosqualenu savčí 2,3-oxidoskvalen-lanosterol cyklázou“. Sdělení o biochemickém a biofyzikálním výzkumu. 188 (2): 898–904. doi:10.1016 / 0006-291X (92) 91140-L. PMID 1445330.
- ^ Telford DE, Lipson SM, Barrett PH, Sutherland BG, Edwards JY, Aebi JD, Dehmlow H, Morand OH, Huff MW (prosinec 2005). „Nový inhibitor oxidosqualenu: lanosterol cykláza inhibuje produkci lipoproteinů apolipoproteinů B100 s nízkou hustotou (apoB100) a zvyšuje katabolismus lipoproteinů apoB100 s nízkou hustotou výrazným snížením obsahu cholesterolu v játrech.“. Arterioskleróza, trombóza a vaskulární biologie. 25 (12): 2608–14. doi:10.1161 / 01.ATV.0000189158.28455,94. PMID 16210564.
- ^ Panini SR, Gupta A, Sexton RC, Parish EJ, Rudney H (říjen 1987). "Regulace biosyntézy sterolů a aktivity 3-hydroxy-3-methylglutaryl-koenzymu A reduktázy v kultivovaných buňkách pomocí progesteronu". The Journal of Biological Chemistry. 262 (30): 14435–40. PMID 3667583.
- ^ Pearson A, Budin M, Brocks JJ (prosinec 2003). „Fylogenetické a biochemické důkazy syntézy sterolů v bakterii Gemmata obscuriglobus“. Sborník Národní akademie věd Spojených států amerických. 100 (26): 15352–7. Bibcode:2003PNAS..10015352P. doi:10.1073 / pnas.2536559100. PMC 307571. PMID 14660793.
- ^ Brocks JJ, Logan GA, Buick R, Summons RE (srpen 1999). „Archeanské molekulární fosilie a časný vzestup eukaryot“. Věda. 285 (5430): 1033–6. CiteSeerX 10.1.1.516.9123. doi:10.1126 / science.285.5430.1033. PMID 10446042.
Další čtení
- Roessler E, Mittaz L, Du Y, Scott HS, Chang J, Rossier C, Guipponi M, Matsuda SP, Muenke M, Antonarakis SE (listopad 1999). „Struktura lidského genu lanosterol syntázy a její analýza jako kandidáta na holoprosencefalii (HPE1)“. Genetika člověka. 105 (5): 489–95. doi:10,1007 / s004390051135. PMID 10598817.
- Ma J, Dempsey AA, Stamatiou D, Marshall KW, Liew CC (březen 2007). "Identifikace vzorců exprese genu leukocytů spojená s hladinami lipidů v plazmě u lidských subjektů". Ateroskleróza. 191 (1): 63–72. doi:10.1016 / j.atheroskleróza.2006.05.032. PMID 16806233.
- Beyea MM, Heslop CL, Sawyez CG, Edwards JY, Markle JG, Hegele RA, Huff MW (únor 2007). „Selektivní up-regulace LXR regulovaných genů ABCA1, ABCG1 a APOE v makrofázích prostřednictvím zvýšené endogenní syntézy 24 (S), 25-epoxycholesterolu“. The Journal of Biological Chemistry. 282 (8): 5207–16. doi:10,1074 / jbc.M611063200. PMID 17186944.
- Dang H, Liu Y, Pang W, Li C, Wang N, Shyy JY, Zhu Y (březen 2009). „Potlačení 2,3-oxidoskvalencyklázy stravou s vysokým obsahem tuku přispívá ke zlepšení jaterního lipidového profilu zprostředkovaného alfa-receptory“. The Journal of Biological Chemistry. 284 (10): 6218–26. doi:10,1074 / jbc.M803702200. PMC 2649084. PMID 19119143.
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R, Yamamoto J, Sekine M, Tsuritani K, Wakaguri H, Ishii S, Sugiyama T, Saito K, Isono Y, Irie R, Kushida N, Yoneyama T , Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (leden 2006 ). „Diverzifikace transkripční modulace: rozsáhlá identifikace a charakterizace domnělých alternativních promotorů lidských genů“. Výzkum genomu. 16 (1): 55–65. doi:10,1101 / gr. 4039406. PMC 1356129. PMID 16344560.
- Sung CK, Shibuya M, Sankawa U, Ebizuka Y (říjen 1995). "Molekulární klonování cDNA kódující lidskou lanosterol syntázu". Biologický a farmaceutický bulletin. 18 (10): 1459–61. doi:10,1248 / bpb.18.1459. PMID 8593458.
- Young M, Chen H, Lalioti MD, Antonarakis SE (květen 1996). "Gen lidského lanosterol syntázy se mapuje na chromozom 21q22.3". Genetika člověka. 97 (5): 620–4. doi:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- Peffley DM, Gayen AK, Morand OH (srpen 1998). „Down-regulace 3-hydroxy-3-methylglutaryl koenzymu A reduktázy hladiny mRNA a syntéza v buňkách C100 syrského křečka inhibitorem oxidosqualencyklázy [4 '- (6-allyl-ethyl-amino-hexyloxy) -2'-fluor- fenyl] - (4-bromfenyl) -meonon (Ro 48-8071): srovnání se simvastatinem ". Biochemická farmakologie. 56 (4): 439–49. doi:10.1016 / S0006-2952 (98) 00083-5. PMID 9763219.
- Lu Y, Dollé ME, Imholz S, van 't Slot R, Verschuren WM, Wijmenga C, Feskens EJ, Boer JM (prosinec 2008). „Několik genetických variant podél kandidátských drah ovlivňuje plazmatické koncentrace lipoproteinů s vysokou hustotou cholesterolu. Journal of Lipid Research. 49 (12): 2582–9. doi:10.1194 / ml. M800232-JLR200. PMID 18660489.
- Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S, Patel S, Long J, Stern D, Tammana H, Helt G, Sementchenko V, Piccolboni A, Bekiranov S, Bailey DK, Ganesh M, Ghosh S, Bell I Gerhard DS, Gingeras TR (květen 2005). "Transkripční mapy 10 lidských chromozomů v rozlišení 5 nukleotidů". Věda. 308 (5725): 1149–54. Bibcode:2005Sci ... 308.1149C. doi:10.1126 / science.1108625. PMID 15790807. S2CID 13047538.
- Pyrah IT, Kalinowski A, Jackson D, Davies W, Davis S, Aldridge A, Greaves P (2001). "Toxikologické léze spojené se dvěma příbuznými inhibitory oxidoskvalencyklázy u psa a myši". Toxikologická patologie. 29 (2): 174–9. doi:10.1080/019262301317052440. PMID 11421484. S2CID 38721319.
- Bonaldo MF, Lennon G, Soares MB (září 1996). „Normalizace a odčítání: dva přístupy k usnadnění objevování genů“. Výzkum genomu. 6 (9): 791–806. doi:10,1101 / gr. 6.9.791. PMID 8889548.
- Ruf A, Müller F, D'Arcy B, Stihle M, Kusznir E, Handschin C, Morand OH, Thoma R (březen 2004). „Monotopový membránový protein, lidská oxidoskvalencykláza, je aktivní jako monomer“. Sdělení o biochemickém a biofyzikálním výzkumu. 315 (2): 247–54. doi:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- Mark M, Muller P, Maier R, Eisele B (leden 1996). „Účinky nového inhibitoru 2,3-oxidoskvalencyklázy na regulaci biosyntézy cholesterolu v buňkách HepG2“. Journal of Lipid Research. 37 (1): 148–58. PMID 8820110.
externí odkazy
- Lanosterol + syntáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)