Fosfoenolpyruvát mutáza - Phosphoenolpyruvate mutase
| fosfoenolpyruvát mutáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 5.4.2.9 | ||||||||
| Číslo CAS | 115756-49-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a fosfoenolpyruvát mutáza (ES 5.4.2.9 ) je enzym že katalyzuje the chemická reakce
- fosfoenolpyruvát 3-fosfonopyruvát
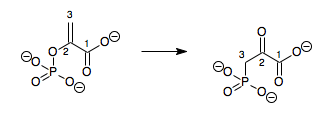
Tento enzym tedy jeden má Podklad, fosfoenolpyruvát (PEP) a jedna produkt, 3-fosfonopyruvát (PPR), které jsou strukturní izomery.
Tento enzym patří do rodiny izomerázy, konkrétně fosfotransferázy (fosfomutázy), které přenášejí fosfátové skupiny v molekule. The systematické jméno této třídy enzymů je fosfoenolpyruvát 2,3-fosfonomutázu. Mezi další běžně používaná jména patří fosfoenolpyruvát-fosfonopyruvátfosfomutáza, PEP fosfomutáza, fosfoenolpyruvátfosfomutáza, PEPPM, a PEP fosfomutáza. Tento enzym se účastní metabolismus aminofosfonátů.
Fosfoenolpyruvát mutáza byla objevena v roce 1988.[1][2]
Strukturální studie
Ke konci roku 2007, 6 struktur byly pro tuto třídu enzymů vyřešeny, vše skupinou Herzberg [1] na University of Maryland pomocí PEPPM z modrá slávka, Mytilus edulis. První struktura (PDB přístupový kód 1PYM ) byl vyřešen v roce 1999 a obsahoval inhibitor oxalátu hořečnatého.[3] Tato struktura identifikovala enzym jako sestávající ze stejného beta barel podjednotky (vystavující Hlaveň TIM záhyb, který se skládá z osmi paralel beta vlákna ). Byla pozorována dimerizace, při které šroubovice z každé podjednotky interaguje s hlavní druhé podjednotky; autoři tuto funkci nazvali „helix swapping“. Dimery mohou také dimerizovat za vzniku homotetramerního enzymu. Na základě této studie byl navržen mechanismus přenosu dvojitého fosforylu: to by zahrnovalo rozbití vazby fosfor-kyslík PEP za vzniku fosfoenzymového meziproduktu, po kterém následuje přenos fosforylové skupiny z enzymu na uhlík-3 za vzniku PPR.
Avšak v poslední době byla vyřešena struktura s inhibitorem sulfopyruvátu, který je bližším analogem substrátu (1M1B );[4] tato studie místo toho podporovala a disociativní mechanismus. Pozoruhodným rysem těchto struktur bylo stínění Aktivní stránky z rozpouštědla; bylo navrženo, aby významné konformační změna probíhá navázáním, aby to bylo umožněno, přemístěním proteinu z „otevřeného“ do „uzavřeného“ stavu a toto bylo podporováno několika krystalovými strukturami v otevřeném stavu.[5] Tři z nich byli z divoký typ: apoenzym v 1S2T, enzym plus jeho hořčíkový iontový kofaktor v 1S2V a enzym s vysokou iontovou silou v 1S2W. Mutant (D58A, v jedné ze smyček aktivního místa) byl krystalizován také jako apoenzym (1S2U ). Z těchto struktur byla identifikována "hradlovací" smyčka aktivního místa (zbytky 115-133), která chrání substrát před rozpouštědlem v uzavřené konformaci.
Dvě konformace, převzaté z krystalových struktur 1M1B (uzavřená) a 1S2T (otevřená), jsou zakotveny do sebe na obrázcích níže; liší se zanedbatelně, s výjimkou hradlovací smyčky, která je pro uzavřenou konformaci zbarvena fialově a pro otevřenou konformaci modře. V detailním obrázku aktivního místa (vlevo) je také zahrnuto několik postranních řetězců (azurová), které byly identifikovány jako důležité při katalýze; přehled (vpravo) ilustruje výraznou záměnu šroubovice. Obrázky jsou stále záběry z stuha kinemages. Obě tyto struktury byly krystalizovány jako dimery. V řetězci A (používá se k detailnímu zobrazení aktivního místa) jsou šroubovice červené, zatímco smyčky (jiné než vtoková smyčka) jsou bílé a řetězce beta jsou zelené; v řetězci B jsou šroubovice žluté, vlákna beta jsou olivová a smyčky šedé; tyto barvy jsou stejné pro uzavřené i otevřené struktury. Hořčíkové ionty jsou šedé a sulfopyruvátové ligandy jsou růžové; oba jsou z uzavřené struktury (ačkoli enzym byl také krystalizován pouze s vázaným hořčíkem a přijal otevřenou konformaci).


Struktura PEPPM je velmi podobná struktuře methylisocitrát lyáza, enzym podílející se na propanoát metabolismus, jehož substrát je také nízkomolekulární karboxylová kyselina —Struktura beta-barelu, stejně jako aktivní rozložení webu a geometrie multimerizace jsou stejné. Isocitrát lyáza je také docela podobný, ačkoli každá podjednotka má kromě hlavní beta hlavně i druhou, menší doménu beta.
Mechanismus
Předpokládá se, že fosfoenolpyruvát mutáza vykazuje disociační mechanismus.[4] Hořčíkový iont je zapojen jako kofaktor. Zdá se také, že fosforyl / fosfátová skupina iontově interaguje s Arg159 a His190 a stabilizuje reaktivní meziprodukt. Fosfoenzymový meziprodukt je nepravděpodobný, protože nejpravděpodobnější zbytky pro kovalentní adukt mohou být mutovány pouze s částečnou ztrátou funkce. Reakce zahrnuje disociaci fosforu z kyslíku 2 a poté a nukleofilní útok uhlíkem 3 na fosforu. Je pozoruhodné, že konfigurace je zachována na fosforu, tj. Uhlík 3 z PPR se přidává ke stejné ploše fosforu, ze kterého byl odstraněn kyslík 2 z PEP; to by bylo nepravděpodobné pro disociativní mechanismus bez enzymu katalyzovaný, ale protože reaktivní meziprodukt silně interaguje s aminokyselinami a ionty hořčíku aktivního místa, lze ho očekávat v přítomnosti enzymové katalýzy.
Zbytky ve vtokové smyčce aktivního místa, zejména Lys120, Asn122 a Leu124, také interagují se substrátem a reaktivním meziproduktem; tyto interakce vysvětlují, proč se smyčka přesouvá do uzavřené konformace při vázání substrátu.
Biologická funkce
Protože fosfoenolpyruvát mutáza má neobvyklou schopnost tvořit novou vazbu uhlík-fosfor, je nezbytná pro syntézu fosfonáty, jako fosfonolipidy a antibiotika fosfomycin a bialaphos. Tvorba této vazby je poměrně termodynamicky nepříznivá; přestože PEP je fosfátová sloučenina s velmi vysokou energií, rovnováha v interkonverzi PEP-PPR stále dává přednost PEP.[1] Enzym fosfonopyruvát dekarboxyláza představuje řešení tohoto problému: katalyzuje velmi termodynamicky příznivou dekarboxylaci PPR a výsledný 2-fosfonoacetaldehyd se poté převede na biologicky užitečné fosfonáty. To umožňuje, aby reakce fosfonolpyruvátu probíhala dopředu, kvůli Le Chatelierův princip. Dekarboxylace rychle odstraňuje produkt, a tak se reakce pohybuje vpřed, i když by bylo mnohem více reaktantu než produktu, pokud by systému bylo umožněno dosáhnout rovnováhy samo o sobě.
Enzym karboxyfosfoenolpyruvátfosfonomutáza provádí podobnou reakci, přeměňuje P-karboxyfosfoenolpyruvát na fosfinopyruvát a oxid uhličitý. [2] [6]
Reference
- ^ A b Bowman E, McQueney M, Barry RJ, Dunaway-Mariano D (1988). „Katalýza a termodynamika přesmyku fosfoenolpyruvát-fosfonopyruvát - vstup do třídy fosfonátů přirozeně se vyskytujících organofosforových sloučenin“. J. Am. Chem. Soc. 110 (16): 5575–5576. doi:10.1021 / ja00224a054.
- ^ Seidel HM, Freeman S, Seto H, Knowles JR (1988). „Fosfonátová biosyntéza: izolace enzymu odpovědného za tvorbu vazby uhlík-fosfor“. Příroda. 335 (6189): 457–458. Bibcode:1988Natur.335..457S. doi:10.1038 / 335457a0. PMID 3138545. S2CID 4310660.
- ^ Huang K, Li Z, Jia Y, Dunaway-Mariano D, Herzberg O (1999). "Výměna helixu mezi dvěma alfa / beta sudy: krystalová struktura fosfoenolpyruvát mutázy s navázaným Mg (2 +) - oxalátem". Skládání struktury. Des. 7 (5): 539–48. doi:10.1016 / S0969-2126 (99) 80070-7. PMID 10378273.
- ^ A b Liu S, Lu Z, Jia Y, Dunaway-Mariano D, Herzberg O (2002). „Disociativní přenos fosforylu v katalýze PEP mutázy: struktura komplexu enzym / sulfopyruvát a kinetické vlastnosti mutantů“. Biochemie. 41 (32): 10270–10276. doi:10.1021 / bi026024v. PMID 12162742.
- ^ Liu S, Lu Z, Han Y, Jia Y, Howard A, Dunaway-Mariano D, Herzberg O (2004). "Konformační flexibilita PEP mutázy". Biochemie. 43 (15): 4447–4453. CiteSeerX 10.1.1.432.6514. doi:10.1021 / bi036255h. PMID 15078090.
- ^ Hidaka T, Imai S, Hara O, Anzai H, Murakami T, Nagaoka K, Seto H (1990). „Karboxyfosfonoenolpyruvátfosfonomutáza, nový enzym katalyzující tvorbu vazby CP“. J. Bacteriol. 172 (6): 3066–72. doi:10.1128 / jb.172.6.3066-3072.1990. PMC 209109. PMID 2160937.

