Exopolyfosfatáza - Exopolyphosphatase
| Exopolyfosfatáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.6.1.11 | ||||||||
| Číslo CAS | 9024-85-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Exopolyfosfatáza (PPX) je a fosfatáza enzym který katalyzuje hydrolýzu anorganických látek polyfosfát, lineární molekula složená z až 1 000 nebo více monomerů spojených fosfo-anhydridovými vazbami.[1] PPX je procesní exofosfatáza, což znamená, že začíná na konci polyfosfát řetěz a štěpí fosfo-anhydridové vazby, aby se uvolnily ortofosfát jak se pohybuje podél molekuly polyfosfátu.[1] PPX má několik charakteristik, které ho odlišují od jiných známých polyfosfatáz, konkrétně na které nepůsobí ATP, má silnou preferenci polyfosfátu s dlouhým řetězcem a má velmi nízkou afinitu k polyfosfátovým molekulám s méně než 15 fosfátovými monomery.[2]
PPX hraje důležitou roli v metabolismu fosfátů a energie ve všech živých organismech.[3] To je zvláště důležité pro udržení odpovídajících úrovní intracelulárních polyfosfát, který se podílí na řadě buněčných funkcí, včetně reakce na stresory, jako jsou nedostatky v aminokyseliny, ortofosfát nebo dusík, změny v pH, podřazování živin a vysoká sůl a jako anorganická molekula garde.[2][4]
PPX je klasifikován jako polyfosfatáza, které jsou součástí velké rodiny DHH fosfoesterázy.[5] Obě podskupiny v této super rodině sdílejí čtyři N-konec motivy, ale mají různé C-konec skupiny.[6]
Aktivita PPX se kvantifikuje měřením ztráty radioaktivně značeného 32P polyfosfát.[1] PPX se smísí se známým množstvím značeného polyfosfátu a hydrolýzní reakce se zastaví kyselina chloristá (HClO4).[1] Množství zbývajícího značeného polyfosfátu se poté změří pomocí počítání kapalné scintilace.[1]
Dějiny
PPX objevila laboratoř laureáta Nobelovy ceny Arthur Kornberg v roce 1993 a je součástí polyfosfát operon spolu s polyfosfátkináza,[1] enzym, který syntetizuje polyfosfát. Laboratoř v Kornbergu měla velký zájem polyfosfát a publikoval sérii článků objasňujících metabolismus a role polyfosfát in vivo. Jejich zájem o polyfosfát vedl je k identifikaci a charakterizaci polyfosfátového operonu (který zahrnuje polyfosfátkináza [PPK] a PPX) a vyvinout širokou škálu testů a technik pro kvantifikaci produkce a degradace polyfosfátů, in vitro a in vivo. Výsledky těchto studií polyfosfát laboratoř v Kornbergu vedla Kornberga ke spekulacím, že vzhledem k vysokému obsahu energie a fosfátů a stupni jeho zachování u různých druhů, polyfosfát může být předchůdcem RNA, DNA, a bílkoviny.[2]
Struktura
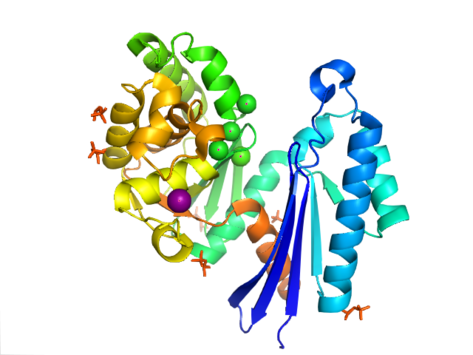
Struktura PPX je charakterizována jako aktin ATPáza doména, která je součástí této nadrodiny. v Aquifex aeolicus obsahuje a ribonukleáza Motiv ve tvaru písmene H, který je složen z pěti pramenů ß-prostěradlo s druhým vláknem antiparalelní ke zbytku. Několik pramenů je spojeno šroubovicovými segmenty, které jsou delší v C-terminální doméně než v N-terminální doméně. Pět alfa-šroubovice jsou umístěny v C-terminální doméně a pouze dva jsou umístěny v N-terminální doméně. Uzavřená konfigurace enzymu se označuje jako struktura typu I. Tato konfigurace sdílí podobné funkce s ostatními členy této nadrodiny, včetně domén N-terminálu a C-terminálu, které jsou odděleny dvěma alfa-helixy se středem na struktuře. Otevřenější uspořádání domén zobrazuje rotační pohyb dvou domén kolem jedné oblasti závěsu. Konstrukční flexibilita byla popsána jako rozštěp štěrbiny „jako motýl“ kolem Aktivní stránky.[8]
v E-coliexopolyfosfatáza existuje jako dimer, s každým monomer skládající se ze čtyř domén. První dvě domény se skládají ze tří beta listů, za nimiž následuje záhyb alfa-beta-alfa-beta-alfa. To se liší od dříve popsaného Aquifex aeolicus homolog, kterému chybí třetí a čtvrtá doména.[9] K dnešnímu dni byly pro tuto třídu enzymů vyřešeny 4 struktury Proteinová datová banka přístupové kódy 1T6C, 1T6D, 1U6Z, a 2FLO.

Aktivní stránky
Aktivní místo exopolyfosfatázy se nachází v rozštěpech mezi doménami I a II. v E-coli, tato oblast obsahuje smyčku mezi řetězci beta-1 a beta-2 s aminokyselinami glutamát a aspartát (E121, D143 a E150). Tyto zbytky jsou spolu s K197 kritické pro vazbu fosfátů a iontů, což je běžně vidět u jiných ASKHA (acetátové a cukrové kinázy, Hsp70, aktin ). v A. aeolicus, aktivní místo enzymu existuje v rozštěpu mezi dvěma doménami. Je vidět, že katalytické karboxylové skupiny v této štěrbině jsou důležité pro aktivitu enzymu, konkrétně Asp141 a Glu148. Preference exopolyfosfatázy se váže na polyfosfát a ne ATP přispělo ke střetu, ke kterému by došlo mezi ribózou a adenosinem ATP a postranními řetězci N21, C169 a R267.[9]
Mechanismus
Exopolyfosfatáza štěpí koncový fosfát z polyfosfátu přes aminokyselinové postranní řetězce glutamátu a lysinu. Glutamát aktivuje vodu, což jí umožňuje působit jako nukleofil a napadat koncový fosfát. Kyslík, který dříve přemosťoval dva fosfátové atomy, poté oddělí vodík z blízkého zbytku lysinu.[9]

Funkce
Polyfosfáty jsou využívány exopolyfosfatázovými enzymy, které štěpí části řetězce fosfátů. Tyto bílkoviny hrají zásadní roli v EU metabolismus a údržba polyfosfátů.[11] Polyfosfát se nachází v celém cytosol každé buňky a je také přítomen v buňce organely. Existuje mnoho tříd exopolyfosfatáz, každá s vlastní jedinečnou lokalizací a vlastnostmi. Spekulovalo se, že jakmile se polyfosfáty rozloží, jsou zapojeny do signálních molekul, které působí jako sekundární poslové.[6][12] v E-coli, regulace metabolismu polyfosfátů je špatně pochopena.[13]
Polyfosfát je lineární řetězec fosfátů spojených dohromady fosfoanhydridovými vazbami. Polyfosfát se nachází ve všech živých organismech a hraje zásadní roli v přežití organismů. V bakteriích se polyfosfát používá k ukládání energie k nahrazení adenosintrifosfát. Bylo také prokázáno, že se podílí na tvorbě a funkci buněčné membrány, regulaci enzymů a kontrole genové transkripce. U savců jsou polyfosfáty zapojeny do srážení krve a zánětu, imunitní odpovědi, vývoje kostní tkáně a funkce mozku.[11]
Bylo ukázáno v a droždí model, že mutantní kvasinky s deficitem aktivity exopolyfosfatázy měly problémy s respiračními funkcemi a metabolismem anorganických polyfosfátů.[14] Naopak se ukazuje, že kmeny kvasinek, které mají vyšší hladinu enzymu exopolyfosfatázy, nemají zjevné růstové vady při nedostatku fosfátu nebo podmínkách přebytku fosfátů, avšak hladina polyfosfátu v kvasinkách byla mnohem nižší kvůli zvýšenému počtu enzymů, které štěpí polyfosfátové řetězce.[15]
Potenciální klinická / průmyslová relevance
E-coli mutanti, kteří nejsou schopni syntetizovat polyfosfát, umírají již po několika dnech v roce stacionární fáze.[2] Strategie inhibice akumulace polyfosfátů v bakteriích jsou proto zajímavé jako potenciální antibakteriální léčba.[2][16] Toho lze dosáhnout inhibicí polyfosfátkinázy, zvýšením aktivity exopolyfosfatázy nebo obojím.
Akumulace polyfosfátu je také zajímavá pro řadu průmyslových aplikací, včetně odstraňování Pi z vodního prostředí prostřednictvím lepší biologické odstraňování fosforu a pro jeho roli jako molekulárního chaperonu při expresi rekombinantu protein. Kvůli aktivitě polyfosfátu jako molekulárního chaperonu[4] kmeny E-coli které akumulují polyfosfát, by mohly být použity ke zvýšení výtěžku rozpustného rekombinantu protein.[17]
Reference
- ^ A b C d E F Akiyama, M; Crooke, E; Kornberg, A (1993). „Exopolyfosfatáza E. coli: enzym a jeho gen ppx v polyfosfátovém operonu“. Journal of Biological Chemistry. 268 (1): 633–639.
- ^ A b C d E Kornberg, A; Rao, NN; Ault-Riché, D (1999). "Anorganický polyfosfát: molekula mnoha funkcí". Roční přehled biochemie. 68: 89–125. doi:10,1146 / annurev.biochem. 68.1.89. PMID 10872445.
- ^ Brown, Michael R.W .; Kornberg, Arthur (červen 2008). "Dlouhá a krátká - polyfosfát, PPK a bakteriální přežití". Trendy v biochemických vědách. 33 (6): 284–290. doi:10.1016 / j.tibs.2008.04.005. PMID 18487048.
- ^ A b Gray, MJ; Wholey, WY; Wagner, NO; Cremers, CM; Mueller-Schickert, A; Hock, NT; Krieger, AG; Smith, EM; Bender, RA; Bardwell, JC; Jakob, U (6. března 2014). „Polyfosfát je prvotní chaperon“. Molekulární buňka. 53 (5): 689–99. doi:10.1016 / j.molcel.2014.01.012. PMC 3996911. PMID 24560923.
- ^ Aravind, L; Koonin, EV (leden 1998). „Nová rodina předpovězených fosfoesteráz zahrnuje protein Drosophila prune a bakteriální exjaderázu RecJ“. Trendy v biochemických vědách. 23 (1): 17–9. doi:10.1016 / s0968-0004 (97) 01162-6. PMID 9478130.
- ^ A b Luginbuehl E, Kunz S, Wentzinger L, Freimoser F, Seebeck T (leden 2011). „Exopolyfosfatáza TbrPPX1 z Trypanosoma brucei“. Mikrobiologie BMC. 11: 4. doi:10.1186/1471-2180-11-4. PMC 3022644. PMID 21208463.
- ^ Kristensen, O .; Laurberg, M .; Liljas, A .; Kastrup, J.S .; Gajhede, M. (2004). „1T6C“. Biochemie. 43: 8894–8900. doi:10.2210 / pdb1t6c / pdb.
- ^ Kristensen, Ole; Laurberg, Martin; Liljas, Anders; Kastrup, Jette S .; Gajhede, Michael (2004). „Strukturální charakterizace rodiny proteinů exopolyfosfát / guanosin-pentafosfát-fosfohydroláza související s odezvou“. Biochemie. 43 (28): 8894–8900. doi:10.1021 / bi049083c. PMID 15248747.
- ^ A b C Alvarado, Johnjeff; Ghosh, Anita; Janovitz, Tyler; Jauregui, Andrew; Hasson, Miriam S .; Sanders, David A. (2006). „Struktura exopolyfosfatázy (PPX) z Escherichia coli O157: H7 navrhuje způsob vazby na dlouhé polyfosfátové řetězce“. Journal of Molecular Biology. 359 (5): 1249–1260. doi:10.1016 / j.jmb.2006.04.031. PMID 16678853.
- ^ Hasson, M.S .; Alvarado, J .; Sanders, D.A.; Janovitz, T .; Ghosh, A .; Alvarado, J. (2005). „1U6Z“. Struktura. 14: 1263–1272. doi:10.2210 / pdb1u6z / pdb.
- ^ A b Docampo Moreno. „Polyfosfátové (Poly P) funkce, syntéza a degradace“. Citováno 1. února 2015.
- ^ Kulaev (2005). „Specifické vlastnosti metabolismu a funkce vysokomolekulárních anorganických polyfosfátů v kvasnicích jako zástupců nižších eukaryot“. Molekulární biologie. 39 (4): 482–494. doi:10.1007 / s11008-005-0065-1.
- ^ Sharfstein (2006). "Polyfosfátový metabolismus v Escherichia coli". Annals of the New York Academy of Sciences. 745: 77–91. doi:10.1111 / j.1749-6632.1994.tb44365.x. PMID 7832534.
- ^ Pestov NA, Kulakovskaya TV, Kulaev IS (červen 2005). "Účinky inaktivace genu PPN1 na exopolyfosfatázy, anorganické polyfosfáty a funkce mitochondrií v kvasinkách Saccharomyces cerevisiae". Výzkum kvasinek FEMS. 5 (9): 823–8. doi:10.1016 / j.femsyr.2005.03.002. PMID 15925310.
- ^ Andreeva N, Trilisenko L, Kulakovskaya T, Dumina M, Eldarov M (leden 2015). "Čištění a vlastnosti rekombinantní exopolyfosfatázy PPN1 a účinky její nadměrné exprese na polyfosfát v Saccharomyces cerevisiae". Journal of Bioscience and Bioengineering. 119 (1): 52–6. doi:10.1016 / j.jbiosc.2014.06.006. PMID 25034634.
- ^ Thayil, Seema M .; Morrison, Norman; Schechter, Norman; Rubin, Harvey; Karakousis, Petros C. (2011). „Role nové exopolyfosfatázy MT0516 v toleranci a perzistenci léku Mycobacterium tuberculosis“. PLOS ONE. 6 (11): e28076. doi:10.1371 / journal.pone.0028076. PMC 3221697. PMID 22132215.
- ^ Cox, David L. Nelson, Michael M. (2013). Lehningerovy principy biochemie (6. vydání). New York: W.H. Freemane. ISBN 9781429234146.
