Ferricyanid - Ferricyanide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC hexakyanid železitý (3+) | |
| Systematický název IUPAC hexacyanidoferrate (III) | |
| Ostatní jména hexakyanid železitý; hexacyanidoferrát (3−); hexakyanoferát (III) | |
| Identifikátory | |
3D model (JSmol ) | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
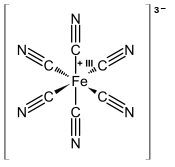
| [Fe (CN)6]3− | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Ferricyanid je anion [Fe (CN)6]3−. Také se tomu říká hexakyanoferát (III) a ve vzácných případech, ale systematické názvosloví hexakyanidoferát (III). Nejběžnější solí tohoto aniontu je ferikyanid draselný, červený krystalický materiál, který se používá jako oxidant v organická chemie.[1]
Vlastnosti
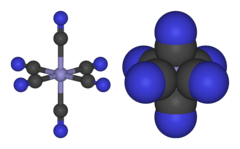
[Fe (CN)6]3− sestává z Fe3+ střed vázán dovnitř oktaedrická geometrie do šesti kyanid ligandy. V komplexu je Oh symetrie. Žehlička je nízké otáčky a snadno se redukuje na související ferokyanid iont [Fe (CN)6]4−, což je železo (Fe2+) derivát. Tento redoxní pár je reverzibilní a nevyžaduje žádné vytváření ani rozbití vazeb Fe – C:
- [Fe (CN)6]3− + e− ⇌ [Fe (CN)6]4−
Tento redoxní pár je standardem v elektrochemie.
Ve srovnání s normální kyanidy jako kyanid draselný, ferricyanidy jsou mnohem méně toxické kvůli pevnému držení CN− k Fe3+. Reagují však s minerálními kyselinami a uvolňují vysoce toxické látky kyanovodík plyn.
Použití
Ošetření ferricyanidu solemi železa (II) poskytuje brilantní a dlouhotrvající pigment pruská modř, tradiční barva plány.
Viz také
Reference
- ^ Gail, E .; Gos, S .; Kulzer, R .; Lorösch, J .; Rubo, A .; Sauer, M .; Kellens, R .; Reddy, J .; Steier, N. "Kyano sloučeniny, anorganické". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a08_159.pub3.
