Karboxypeptidáza - Carboxypeptidase

A karboxypeptidáza (EC číslo 3.4.16 - 3.4.18) je a proteáza enzym že hydrolyzuje (štěpí) a peptidová vazba na karboxy-terminálním (C-terminálním) konci a protein nebo peptid. To je na rozdíl od aminopeptidázy, které štěpí peptidové vazby na N-konci proteinů. Lidé, zvířata, bakterie a rostliny obsahují několik typů karboxypeptidáz, které mají různé funkce od katabolismu po zrání bílkovin.
Mechanismus
Mechanismus produkce karboxypeptidázy spočívá v tom, že voda koordinující substrát je nahrazena substrátem karbonylových (C = O) skupin.
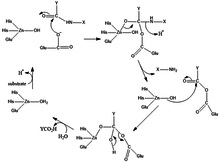
Funkce
První studované karboxypeptidázy byly ty, které se účastnily trávení potravy (pankreatické karboxypeptidázy A1, A2 a B). Většina známých karboxypeptidáz však není zahrnuta katabolismus; pomáhají zralým proteinům (např. Posttranslační modifikace ) nebo regulovat biologické procesy. Například biosyntéza neuroendokrinní peptidy jako např inzulín vyžaduje karboxypeptidázu. Karboxypeptidázy také fungují v srážení krve, růstový faktor Výroba, hojení ran, reprodukce a mnoho dalších procesů.
Klasifikace
Mechanismem aktivního místa
Karboxypeptidázy jsou obvykle klasifikovány do jedné z několika rodin na základě jejich mechanismu aktivního místa.
- Enzymy, které používají kov v aktivním místě, se nazývají „metalokarboxypeptidázy“ (číslo EC 3.4.17).
- Další karboxypeptidázy, které používají aktivní místo serin zbytky se nazývají "serinkarboxypeptidázy" (číslo ES 3.4.16).
- Ti, kteří používají aktivní web cystein se nazývají „cysteinkarboxypeptidáza“ (nebo „thiol karboxypeptidázy ") (číslo ES 3.4.18).
Tyto názvy neodkazují na selektivitu odštěpené aminokyseliny.
Podle preferencí substrátu
Další klasifikační systém pro karboxypeptidázy odkazuje na jejich preferenci substrátu.
- V tomto klasifikačním systému karboxypeptidázy, které mají silnější preference pro ty aminokyseliny, které obsahují aromatický nebo rozvětvený uhlovodíkové řetězce se nazývají karboxypeptidáza A (A pro aromatické /alifatický ).
- Karboxypeptidázy, které štěpí kladně nabité aminokyseliny (arginin, lysin ) se nazývají karboxypeptidáza B (B pro základní ).
Metalokarboxypeptidáza, která štěpí C-koncový glutamát z peptidu N-acetyl-L-aspartyl-L-glutamátu, se nazývá „glutamát karboxypeptidáza ".
Serinová karboxypeptidáza, která štěpí C-koncový zbytek z peptidů obsahujících sekvenci -Pro-Xaa (Pro je prolin, Xaa je jakákoli aminokyselina na C-konci peptidu), se nazývá „prolylkarboxypeptidáza ".
Aktivace
Některé, ale ne všechny, karboxypeptidázy se zpočátku vyrábějí v neaktivní formě; tato forma předchůdce se označuje jako a prokarboxypeptidáza. V případě pankreatické karboxypeptidázy A je neaktivní zymogen forma - pro-karboxypeptidáza A - se převádí na aktivní formu - karboxypeptidázu A - enzymem trypsin. Tento mechanismus zajišťuje, že buňky, kde se produkuje prokarboxypeptidáza A, nejsou samy tráveny.
Viz také
- Karboxypeptidáza E
- Karboxypeptidáza A
- Kategorie enzymů EC číslo 3.4
- Trombinem aktivovatelný inhibitor fibrinolýzy aka plazma karboxypeptidáza B2
- bakteriální transpeptidáza, an alaninkarboxypeptidáza
- bradykinin je rozdělen mezi ostatními enzymy pomocí karboxypeptidáza N
- D-Ala karboxypeptidáza je protein vázající penicilin
- Fenylalanin může bránit karboxypeptidáza A
- Martha L. Ludwig[1]
Reference
externí odkazy
- Karboxypeptidázy v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Sekce proteáz Stryerova kniha '02
