Heterogenní katalýza - Heterogeneous catalysis
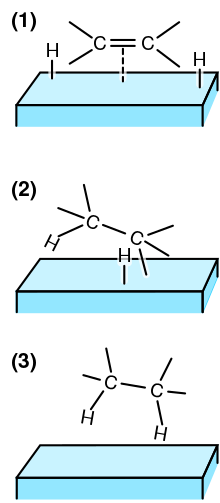
V chemii heterogenní katalýza je katalýza Kde fáze katalyzátorů se liší od katalyzátorů reaktanty[1] nebo produkty. Proces kontrastuje s homogenní katalýza kde reaktanty, produkty a katalyzátor existují ve stejné fázi. Fáze rozlišuje nejen mezi pevný, kapalný, a plyn komponenty, ale také nemísitelný směsi (např. olej a voda ) nebo kdekoli je rozhraní přítomno. Katalyzátory jsou užitečné, protože zvyšují rychlost reakce[2] aniž by byly spotřebovány, a jsou proto opakovaně použitelné.
Heterogenní katalýza obvykle zahrnuje katalyzátory na pevné fázi a reaktanty v plynné fázi.[3] V tomto případě dochází na povrchu katalyzátoru k cyklu molekulární adsorpce, reakce a desorpce. Termodynamika, přenos hmoty a přenos tepla ovlivňují rychlost (kinetika) reakce.
Heterogenní katalýza je velmi důležitá, protože umožňuje rychlejší výrobu ve velkém měřítku a selektivní tvorbu produktu.[4] Přibližně 35% světového HDP je ovlivněno katalýzou.[5] Produkci 90% objemových chemikálií napomáhají pevné katalyzátory.[3] Chemický a energetický průmysl je do značné míry závislý na heterogenní katalýze. Například Proces společnosti Haber-Bosch používá při syntéze katalyzátory na bázi kovů amoniak, důležitá složka v hnojivech; V roce 2016 bylo vyrobeno 144 milionů tun amoniaku.[6]
Adsorpce
Adsorpce je zásadním krokem v heterogenní katalýze. Adsorpce je proces, při kterém se molekula plynné (nebo roztokové) fáze (adsorbát) váže na pevné (nebo kapalné) povrchové atomy (adsorbent). Rub adsorpce je desorpce, štěpení adsorbátu z adsorbentu. Při reakci usnadněné heterogenní katalýzou je katalyzátorem adsorbent a reaktanty jsou adsorbátem.
Druhy adsorpce
Rozeznávají se dva typy adsorpce: fysisorpce slabě vázaná adsorpce a chemisorpce, silně vázaná adsorpce. Mnoho procesů v heterogenní katalýze leží mezi těmito dvěma extrémy. The Lennard-Jonesův model poskytuje základní rámec pro předpovídání molekulárních interakcí jako funkce atomové separace.[7]
Physisorpce
Při fysisorpci je molekula přitahována k povrchovým atomům prostřednictvím van der Waalsovy síly. Patří mezi ně interakce dipól-dipól, indukované dipólové interakce a Londonovy disperzní síly. Všimněte si, že mezi adsorbátem a adsorbentem se netvoří žádné chemické vazby a jejich elektronické stavy zůstávají relativně nerušené. Typické energie pro physisorpci jsou od 3 do 10 kcal / mol.[3] V heterogenní katalýze, když se molekula reaktantu fyziobsorbuje ke katalyzátoru, se běžně říká, že je ve stavu prekurzoru, ve stavu střední energie před chemisorpcí, silněji vázané adsorpci.[7] Ze stavu prekurzoru může molekula buď podstoupit chemisorpci, desorpci nebo migraci přes povrch.[8] Povaha stavu prekurzoru může ovlivnit kinetiku reakce.[8]
Chemisorpce
Když se molekula přiblíží dostatečně blízko k povrchovým atomům takovým, že jejich elektronové mraky může dojít k chemisorpci. Při chemisorpci adsorbát a adsorbent sdílejí elektrony znamenající vznik chemické vazby. Typické energie pro chemisorpci se pohybují od 20 do 100 kcal / mol.[3] Dva případy chemisorpce jsou:
- Molekulární adsorpce: adsorbát zůstává neporušený. Příkladem je vazba alkenu platinou.
- Disociační adsorpce: jedna nebo více vazeb se současně s adsorpcí rozpadá. V tomto případě bariéra k disociace ovlivňuje rychlost adsorpce. Příkladem toho je vazba H2 na kovový katalyzátor, kde se vazba H-H po adsorpci rozbije.
Povrchové reakce

K většině kovových povrchových reakcí dochází šíření řetězce ve kterém se cyklicky vyrábějí a spotřebovávají katalytické meziprodukty.[9] Pro A + B → C lze popsat dva hlavní mechanismy povrchových reakcí.[3]
- Langmuir-Hinshelwoodův mechanismus: Molekuly reaktantu, A a B, se adsorbují na katalytický povrch. Při adsorpci na povrch se spojí a vytvoří produkt C, který poté desorbuje.
- Eley-Ridealův mechanismus: Jedna molekula reaktantu, A, se adsorbuje na katalytický povrch. Bez adsorpce B reaguje s absorbovaným A za vzniku C, který potom desorbuje z povrchu.
Většina heterogenně katalyzovaných reakcí je popsána Langmuir-Hinshelwoodovým modelem.[10]
Při heterogenní katalýze reaktanty šířit z fáze sypké tekutiny do adsorbovat na povrch katalyzátoru. Adsorpční místo není vždy aktivním katalyzátorovým místem, takže molekuly reaktantů musí migrovat přes povrch do aktivního místa. V aktivním místě reagují molekuly reaktantu za vzniku molekuly produktu sledováním energeticky nenáročnější cesty katalytickými meziprodukty (viz obrázek vpravo). Molekuly produktu poté desorbují z povrchu a difundují pryč. Samotný katalyzátor zůstává neporušený a volný ke zprostředkování dalších reakcí. Ve sledované reakční rychlosti hrají roli také transportní jevy, jako je přenos tepla a hmoty.
Konstrukce katalyzátoru

Katalyzátory nejsou aktivní vůči reaktantům po celém svém povrchu; pouze určitá místa mají katalytickou aktivitu, tzv aktivní stránky. Povrch pevného katalyzátoru má silný vliv na počet dostupných aktivních míst. V průmyslové praxi jsou pevné katalyzátory často pórovité, aby maximalizovaly plochu, obvykle dosahující 50–400 m2/G.[3] Nějaký mezoporézní silikáty, jako je MCM-41, mají povrchy větší než 1000 m2/G.[11] Porézní materiály jsou nákladově efektivní díky vysokému poměru povrchu k hmotnosti a zvýšené katalytické aktivitě.
V mnoha případech je to pevný katalyzátor rozptýlené na nosném materiálu ke zvýšení povrchové plochy (rozšíření počtu aktivních míst) a zajištění stability.[3] Obvykle nosiče katalyzátoru jsou inertní materiály s vysokou teplotou tání, ale mohou být také samotné katalytické. Většina nosičů katalyzátoru je porézní (často na bázi uhlíku, oxidu křemičitého, zeolitu nebo na bázi oxidu hlinitého).[5] a byly vybrány pro jejich vysoký poměr povrchu k hmotnosti. Pro danou reakci musí být porézní nosiče zvoleny tak, aby reaktanty a produkty mohly vstupovat a vystupovat z materiálu.
Často se látky záměrně přidávají do reakční směsi nebo na katalyzátor, aby se ovlivnila katalytická aktivita, selektivita a / nebo stabilita. Tyto sloučeniny se nazývají promotory. Například oxid hlinitý (Al2Ó3) se přidává během syntézy amoniaku k zajištění větší stability zpomalením procesů slinování na Fe-katalyzátoru.[3]
Sabatierův princip lze považovat za jeden ze základních kamenů moderní teorie katalýzy.[12] Sabatierův princip uvádí, že interakce povrch-adsorbáty musí být optimální množství: není příliš slabá, aby byla inertní vůči reaktantům a není příliš silná, aby otrávila povrch a zabránila desorpci produktů.[13] Tvrzení, že interakce povrch-adsorbát musí být optimální, je kvalitativní. Obvykle je počet adsorbátů a přechodových stavů spojených s chemickou reakcí velký počet, tedy optimální musí být nalezen v mnohorozměrném prostoru. Návrh katalyzátoru v tak mnohorozměrném prostoru není výpočetně životaschopný úkol. Takový optimalizační proces by navíc nebyl zdaleka intuitivní. Vztahy škálování se používají ke snížení rozměrnosti prostoru návrhu katalyzátoru.[14] Takové vztahy jsou korelace mezi vazebnými energiemi adsorbátů (nebo mezi vazebnými energiemi adsorbátů a přechodovými stavy známými také jako BEP vztahy )[15] které jsou „dostatečně podobné“, např. škálování OH versus OOH.[16] Uplatnění relací škálování na problémy s návrhem katalyzátoru výrazně snižuje prostorovou dimenzionálnost (někdy až 1 nebo 2).[17] Lze také použít mikrokinetické modelování založené na takových škálovacích vztazích, aby se zohlednila kinetika spojená s adsorpcí, reakcí a desorpcí molekul za specifických tlakových nebo teplotních podmínek.[18] Takové modelování pak vede ke známým sopkovým plochám, na nichž se optimálně kvalitativně popsané Sabatierovým principem označuje jako „vrchol sopky“. Vztahy škálování lze použít nejen k propojení energetiky radikální povrchově adsorbované skupiny (např. O *, OH *),[14] ale také k propojení energetiky uzavřená skořápka molekuly mezi sebou nebo k protějšku radikálových adsorbátů.[19] Nedávnou výzvou pro vědce v oblasti katalytických věd je „prolomení“ škálovacích vztahů.[20] Korelace, které se projevují ve škálovacích vztazích, omezují konstrukční prostor katalyzátoru a brání tomu, aby člověk dosáhl „vrcholu sopky“. Rozdělení vztahů škálování může odkazovat buď na návrh povrchů nebo motivů, které nenásledují vztah změny měřítka, nebo na ty, které sledují jiný vztah změny měřítka (než je obvyklý vztah pro přidružené adsorbáty) správným směrem: ten, který nás může přiblížit horní část sopky reaktivity.[17] Kromě studia katalytické reaktivity lze škálovací vztahy použít ke studiu a screeningu materiálů na selektivitu vůči speciálnímu produktu.[21] Existují speciální kombinace vazebných energií, které upřednostňují konkrétní produkty před ostatními. Někdy soubor vazebných energií, které mohou změnit selektivitu vůči konkrétnímu „měřítku“ produktu, a tak ke zlepšení selektivity je třeba narušit některé škálovací vztahy; příkladem toho je škálování mezi oxidačními aktivačními energiemi metanu a methanolu, které vede k nedostatečné selektivitě při přímé přeměně metanu na methanol.[22]
Deaktivace katalyzátoru
Deaktivace katalyzátoru je definována jako ztráta katalytické aktivity a / nebo selektivity v průběhu času.
Látky, které snižují rychlost reakce, se nazývají jedy. Jedy chemisorbují na povrch katalyzátoru a snižují počet dostupných aktivních míst, na které se molekuly reaktantů váží.[23] Mezi běžné jedy patří prvky skupiny V, VI a VII (např. S, O, P, Cl), některé toxické kovy (např. As, Pb) a adsorpční druhy s více vazbami (např. CO, nenasycené uhlovodíky).[7][23] Síra například narušuje produkci methanolu otravou katalyzátoru Cu / ZnO.[24] Látky, které zvyšují rychlost reakce, se nazývají promotéři. Například přítomnost alkalických kovů v syntéze amoniaku zvyšuje rychlost dusíku2 disociace.[24]
Přítomnost jedů a promotorů může změnit aktivační energii kroku omezujícího rychlost a ovlivnit selektivitu katalyzátoru pro tvorbu určitých produktů. V závislosti na množství může být látka pro chemický proces příznivá nebo nepříznivá. Například při výrobě ethylenu bude malé množství chemicky absorbovaného chloru působit jako promotor zlepšením selektivity Ag-katalyzátoru vůči ethylenu nad CO2, zatímco příliš mnoho chloru bude působit jako jed.[7]
Mezi další mechanismy deaktivace katalyzátoru patří:
- Slinování: při zahřátí mohou dispergované katalytické kovové částice migrovat přes povrch nosiče a tvořit krystaly. To má za následek zmenšení povrchu katalyzátoru.
- Znečištění: ukládání materiálů z kapalné fáze na katalyzátor na pevné fázi a / nebo na nosné povrchy. To má za následek aktivní zablokování místa nebo pórů.
- Koksování: ukládání těžkých pevných látek bohatých na uhlík na povrchy v důsledku rozkladu uhlovodíků[23]
- Reakce pára-pevná látka: tvorba neaktivní povrchové vrstvy a / nebo tvorba těkavé sloučeniny, která opouští reaktor.[23] To má za následek ztrátu povrchu a / nebo materiálu katalyzátoru.
- Transformace v pevné fázi: difúze katalyzátoru v pevné fázi podporuje atomy na povrch následovanou reakcí, která tvoří neaktivní fázi. To má za následek ztrátu povrchu katalyzátoru.
- Eroze: kontinuální úbytek materiálu katalyzátoru běžný v reaktorech s fluidním ložem.[25] To má za následek ztrátu materiálu katalyzátoru.
V průmyslu stojí deaktivace katalyzátoru každý rok miliardy kvůli odstavení procesu a výměně katalyzátoru.[23]
Průmyslové příklady
V průmyslu je třeba zvážit mnoho konstrukčních proměnných, včetně konstrukce reaktoru a katalyzátoru v různých stupnicích od subnanometru po desítky metrů. Mezi běžné heterogenní katalýzy patří reaktory šarže, kontinuální, a reaktory s fluidním ložem, zatímco novější nastavení zahrnují pevné postele, mikrokanály a multifunkční zařízení reaktory.[7] Dalšími proměnnými, které je třeba vzít v úvahu, jsou rozměry reaktoru, povrchová plocha, typ katalyzátoru, nosič katalyzátoru a také provozní podmínky reaktoru, jako je teplota, tlak a koncentrace reaktantů.

Níže jsou uvedeny některé průmyslové průmyslové procesy zahrnující heterogenní katalyzátory.[5]
| Proces | Reaktanty, produkty / produkty (nevyvážené) | Katalyzátor | Komentář |
|---|---|---|---|
| Syntéza kyseliny sírové (Kontaktní proces ) | TAK2 + O.2, TAK3 | oxidy vanadu | Hydratace SO3 dává H2TAK4 |
| Syntéza amoniaku (Proces Haber – Bosch ) | N2 + H2, NH3 | oxidy železa na oxid hlinitý (Al2Ó3) | Spotřebuje 1% světového rozpočtu na průmyslovou energii[3] |
| Syntéza kyseliny dusičné (Ostwaldův proces ) | NH3 + O.2, HNO3 | nepodporovaná gáza Pt-Rh | Přímé trasy z N2 jsou neekonomické |
| Výroba vodíku do Parní reformování | CH4 + H2ACH2 + CO2 | Nikl nebo K.2Ó | Zelenější cesty do H2 podle štěpení vody aktivně hledal |
| Ethylenoxid syntéza | C2H4 + O.2, C.2H4Ó | stříbrný na oxid hlinitý s mnoha promotéry | Špatně použitelné pro jiné alkeny |
| Syntéza kyanovodíku (Andrussovova oxidace ) | NH3 + O.2 + CH4, HCN | Pt-Rh | Příbuzný amoxidace proces přeměňuje uhlovodíky na nitrily |
| Polymerace olefinů Polymerace Ziegler – Natta | propylen, polypropylen | TiCl3 na MgCl2 | Existuje mnoho variant, včetně některých homogenní příklady |
| Odsíření ropy (hydrodesulfurizace ) | H2 + R.2S (idealizovaná organosírová nečistota), RH + H2S | Mo -Spol na oxidu hlinitém | Produkuje uhlovodíky s nízkým obsahem síry, síra získaná prostřednictvím Clausův proces |

Další příklady
- Snížení nitrily při syntéze fenethylamin s Raney nikl katalyzátor a vodík v amoniak:[26]
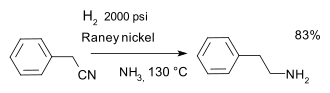 Hydrogenace nitrilu
Hydrogenace nitrilu - Praskání, izomerizace a reformace uhlovodíky k vytvoření vhodných a užitečných směsí benzínu.
- V automobilech katalyzátory se používají ke katalyzování tří hlavních reakcí:
- The oxidace z kysličník uhelnatý na oxid uhličitý:
- 2CO (g) + O2(g) → 2CO2(G)
- The snížení z oxid uhelnatý zpět k dusík:
- 2NO (g) + 2CO (g) → N2(g) + 2CO2(G)
- The oxidace z uhlovodíky do vody a oxid uhličitý:
- 2 C.6H6 + 15 O.2 → 12 CO2 + 6 hodin2Ó
- The oxidace z kysličník uhelnatý na oxid uhličitý:
- K tomuto procesu může dojít u kteréhokoli z uhlovodík, ale nejčastěji se provádí s benzín nebo nafta.
- Asymetrická heterogenní katalýza usnadňuje produkci čistých enantiomerních sloučenin pomocí chirálních heterogenních katalyzátorů.[27]
- Drtivá většina heterogenních katalyzátorů je založena na kovy[28] nebo oxidy kovů;[29][30] některé chemické reakce však mohou být katalyzováno uhlíkem materiály na bázi, např. oxidační dehydrogenace[31] nebo selektivní oxidace.[32]
- Ethylbenzen + 1/2 O.2 → Styren + H2Ó
- Akrolein + 1/2 O.2 → Akrylová kyselina
Reakce katalyzované kapalinou a kapalinou a kapalinou
Ačkoli většina heterogenních katalyzátorů jsou pevné látky, existuje několik variant, které mají praktickou hodnotu. U dvou nemísitelných roztoků (kapalin) nese jeden katalyzátor, zatímco druhý reaktant. Toto uspořádání je základem dvoufázové katalýzy prováděné v průmyslové výrobě butyraldehydu hydroformylací propylenu.[33]
| Reakční fáze | Uvedené příklady | Komentář |
|---|---|---|
| pevné + řešení | hydrogenace mastných kyselin niklem | používané k výrobě margarín |
| nemísitelné kapalné fáze | hydroformylace z propen | katalyzátor na vodné fázi; reaktanty a produkty hlavně v nevodné fázi |
Viz také
- Heterogenní katalýza zlata
- Katalyzátory na bázi nanomateriálů
- Platinové nanočástice
- Redukce naprogramovaná na teplotu
- Tepelná desorpční spektroskopie
Reference
- ^ Schlögl, Robert (09.03.2015). "Heterogenní katalýza". Angewandte Chemie International Edition. 54 (11): 3465–3520. doi:10.1002 / anie.201410738. hdl:11858 / 00-001M-0000-0025-0A33-6. PMID 25693734.
- ^ Chemistry, International Union of Pure and Applied. „Zlatá kniha IUPAC - katalyzátor“. goldbook.iupac.org. Citováno 2019-02-12.
- ^ A b C d E F G h i Rothenberg, Gadi (2008). Katalýza: koncepty a ekologické aplikace. Weinheim [Německo]: Wiley-VCH. ISBN 9783527318247. OCLC 213106542.
- ^ Informace., Lawrence Berkeley National Laboratory. Spojené státy. Ministerstvo energetiky. Úřad pro vědu a techniku (2003). Dopad nanověd na heterogenní katalýzu. Lawrence Berkeley National Laboratory. OCLC 727328504.
- ^ A b C Ma, Zhen; Zaera, Francisco (2006-03-15), „Heterogeneous Catalysis by Metals“, King, R. Bruce; Crabtree, Robert H .; Lukehart, Charles M .; Atwood, David A. (eds.), Encyclopedia of Anorganic Chemistry, John Wiley & Sons, Ltd, doi:10.1002 / 0470862106.ia084, ISBN 9780470860786
- ^ „United States Geological Survey, Mineral Commodity Summary“ (PDF). USGS. Ledna 2018.
- ^ A b C d E Thomas, J. M .; Thomas, W. J. (2014-11-19). Principy a praxe heterogenní katalýzy (Za druhé, přepracované vydání.). Weinheim, Německo. ISBN 9783527683789. OCLC 898421752.
- ^ A b Bowker, Michael (2016-03-28). „Role prekurzorových stavů v adsorpci, povrchových reakcích a katalýze“. Témata v katalýze. 59 (8–9): 663–670. doi:10.1007 / s11244-016-0538-6. ISSN 1022-5528. PMID 21386456.
- ^ R. I. Masel, „Principy adsorpce a reakce na pevných površích“, Wiley Series in Chemical Engineering, Wiley-Interscience, New York, USA, 1996, ISBN 978-0-471-30392-3
- ^ Petukhov, A.V. (1997). „Vliv molekulární mobility na kinetiku elektrochemické Langmuir-Hinshelwoodovy reakce“. Dopisy o chemické fyzice. 277 (5–6): 539–544. doi:10.1016 / s0009-2614 (97) 00916-0. ISSN 0009-2614.
- ^ Kresge, C. T .; Leonowicz, M.E .; Roth, W. J .; Vartuli, J. C .; Beck, J. S. (1992). "Uspořádaná mezoporézní molekulární síta syntetizovaná templátovým mechanismem z tekutých krystalů". Příroda. 359 (6397): 710–712. Bibcode:1992 Natur.359..710K. doi:10.1038 / 359710a0. ISSN 0028-0836. S2CID 4249872.
- ^ Medford, Andrew J .; Vojvodic, Aleksandra; Hummelshøj, Jens S .; Voss, Johannes; Abild-Pedersen, Frank; Studt, Felix; Bligaard, Thomas; Nilsson, Anders; Nørskov, Jens K. (2015). „Od Sabatierova principu k prediktivní teorii heterogenní katalýzy přechodných kovů“. Journal of Catalysis. 328: 36–42. doi:10.1016 / j.jcat.2014.12.033.
- ^ Laursen, Anders B .; Muž, Isabela Costinela; Trinhammer, Ole L .; Rossmeisl, Jan; Dahl, Søren (04.10.2011). „Sabatierův princip ilustrovaný katalytickým rozkladem H2O2 na kovových površích“. Journal of Chemical Education. 88 (12): 1711–1715. doi:10.1021 / ed101010x.
- ^ A b Abild-Pedersen, F .; Greeley, J .; Studt, F .; Rossmeisl, J .; Munter, T. R.; Moses, P. G .; Skúlason, E .; Bligaard, T .; Nørskov, J. K. (06.07.2007). „Škálování vlastností adsorpčních energií pro molekuly obsahující vodík na povrchech přechodných kovů“ (PDF). Dopisy o fyzické kontrole. 99 (1): 016105. doi:10.1103 / PhysRevLett.99.016105. PMID 17678168.
- ^ Nørskov, Jens K .; Christensen, Claus H .; Bligaard, Thomas; Munter, Ture R. (2008-08-18). "BEP vztahy pro disociaci N2 na stupňovitých povrchech přechodových kovů a slitin". Fyzikální chemie Chemická fyzika. 10 (34): 5202–5206. doi:10.1039 / B720021H. ISSN 1463-9084. PMID 18728861.
- ^ Viswanathan, Venkatasubramanian; Hansen, Heine Anton; Rossmeisl, Jan; Nørskov, Jens K. (11.7.2012). „Univerzálnost v elektrokatalýze s redukcí kyslíku na kovových površích“. ACS katalýza. 2 (8): 1654–1660. doi:10.1021 / cs300227s. ISSN 2155-5435.
- ^ A b Nørskov, Jens K .; Vojvodic, Aleksandra (01.06.2015). „Nové paradigma designu pro heterogenní katalyzátory“. National Science Review. 2 (2): 140–143. doi:10.1093 / nsr / nwv023. ISSN 2095-5138.
- ^ Medford, Andrew J .; Shi, Chuan; Hoffmann, Max J .; Lausche, Adam C .; Fitzgibbon, Sean R .; Bligaard, Thomas; Nørskov, Jens K. (01.03.2015). „CatMAP: Softwarový balíček pro mikrokinetické mapování katalytických trendů na základě deskriptorů“. Katalýza dopisy. 145 (3): 794–807. doi:10.1007 / s10562-015-1495-6. ISSN 1572-879X. S2CID 98391105.
- ^ Kakekhani, Arvin; Roling, Luke T .; Kulkarni, Ambarish; Latimer, Allegra A .; Abroshan, Hadi; Schumann, Julia; AlJama, Hassan; Siahrostami, Samira; Ismail-Beigi, Sohrab (18.06.2018). „Povaha vazeb osamělých párů a povrchů a jejich škálovací vztahy“. Anorganická chemie. 57 (12): 7222–7238. doi:10.1021 / acs.inorgchem.8b00902. ISSN 0020-1669. OSTI 1459598. PMID 29863849.
- ^ Chen, Ping; On, Teng; Wu, Guotao; Guo, Jianping; Gao, Wenbo; Chang, Fei; Wang, Peikun (leden 2017). „Prolomení relací škálování pro dosažení nízkoteplotní syntézy amoniaku prostřednictvím přenosu a hydrogenace dusíku zprostředkovaného LiH“. Přírodní chemie. 9 (1): 64–70. doi:10,1038 / nchem.2595. ISSN 1755-4349. PMID 27995914.
- ^ Schumann, Julia; Medford, Andrew J .; Yoo, Jong Suk; Zhao, Zhi-Jian; Bothra, Pallavi; Cao, Ang; Studt, Felix; Abild-Pedersen, Frank; Nørskov, Jens K. (2018-03-13). "Selektivita přeměny syntézního plynu na C2 + kyslíky na povrchech přechodových kovů fcc (111)". ACS katalýza. 8 (4): 3447–3453. doi:10.1021 / acscatal.8b00201. OSTI 1457170.
- ^ Nørskov, Jens K .; Studt, Felix; Abild-Pedersen, Frank; Tsai, Charlie; Yoo, Jong Suk; Montoya, Joseph H .; Aljama, Hassan; Kulkarni, Ambarish R .; Latimer, Allegra A. (únor 2017). „Porozumění trendům v aktivaci vazeb CH – H v heterogenní katalýze“. Přírodní materiály. 16 (2): 225–229. doi:10.1038 / nmat4760. ISSN 1476-4660. PMID 27723737.
- ^ A b C d E Bartoloměj, Calvin H (2001). "Mechanismy deaktivace katalyzátoru". Aplikovaná katalýza A: Obecně. 212 (1–2): 17–60. doi:10.1016 / S0926-860X (00) 00843-7.
- ^ A b Nørskov, Jens K. (2014-08-25). Základní pojmy v heterogenní katalýze. Studt, Felix., Abild-Pedersen, Frank., Bligaard, Thomas. Hoboken, New Jersey. ISBN 9781118892022. OCLC 884500509.
- ^ Forzatti, P (1999-09-14). "Deaktivace katalyzátoru". Katalýza dnes. 52 (2–3): 165–181. doi:10.1016 / s0920-5861 (99) 00074-7. ISSN 0920-5861.
- ^ Organic Syntheses, Coll. Sv. 3, str. 720 (1955); Sv. 23, str. 71 (1943). https://web.archive.org/web/20120315000000*/http://orgsynth.org/orgsyn/pdfs/CV4P0603.pdf
- ^ Heitbaum; Glorius; Escher (2006). "Asymetrická heterogenní katalýza". Angew. Chem. Int. Vyd. 45 (29): 4732–62. doi:10.1002 / anie.200504212. PMID 16802397.
- ^ Wang, Aiqin; Li, červen; Zhang, Tao (červen 2018). "Heterogenní jednoatomová katalýza". Nature Chemistry. 2 (6): 65–81. doi:10.1038 / s41570-018-0010-1. ISSN 2397-3358. S2CID 139163163.
- ^ Zeng, Liang; Cheng, Zhuo; Fan, Jonathan A .; Fanoušek, Liang-Shih; Gong, Jinlong (listopad 2018). "Redoxní chemie oxidů kovů pro chemické cyklické procesy". Nature Chemistry. 2 (11): 349–364. doi:10.1038 / s41570-018-0046-2. ISSN 2397-3358. S2CID 85504970.
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E .; Schlögl, Robert; Trunschke, Annette (2014). „Reakční síť při oxidaci propanu nad fázově čistými katalyzátory oxidu MoVTeNb M1“. J. Catal. 311: 369–385. doi:10.1016 / j.jcat.2013.12.008. hdl:11858 / 00-001M-0000-0014-F434-5.
- ^ Zhang, J .; Liu, X .; Blume, R .; Zhang, A .; Schlögl, R .; Su, D. S. (2008). „Povrchově modifikované uhlíkové nanotrubice katalyzují oxidační dehydrogenaci n-butanu“. Věda. 322 (5898): 73–77. Bibcode:2008Sci ... 322 ... 73Z. doi:10.1126 / science.1161916. hdl:11858 / 00-001M-0000-0010-FE91-E. PMID 18832641. S2CID 35141240.
- ^ Frank, B .; Blume, R .; Rinaldi, A .; Trunschke, A .; Schlögl, R. (2011). „Catalysis Insertion Catalysis od sp2 Uhlík". Angew. Chem. Int. Vyd. 50 (43): 10226–10230. doi:10,1002 / anie.201103340. PMID 22021211.
- ^ Boy Cornils; Wolfgang A. Herrmann, eds. (2004). Organokovová katalýza ve vodné fázi: koncepty a aplikace. Wiley-VCH.
externí odkazy
 Média související s Heterogenní katalýza na Wikimedia Commons
Média související s Heterogenní katalýza na Wikimedia Commons

