Kyselina dikarboxylová - Dicarboxylic acid
A dikarboxylová kyselina je organická sloučenina obsahující dva karboxyl funkční skupiny (−COOH). Generál molekulární vzorec pro dikarboxylové kyseliny lze psát jako HO2C − R − CO2H, kde R může být alifatický nebo aromatický. Obecně dikarboxylové kyseliny vykazují podobné chemické chování a reaktivitu monokarboxylové kyseliny. Dikarboxylové kyseliny se také používají při přípravě kopolymery jako polyamidy a polyestery. Nejpoužívanější dikarboxylovou kyselinou v průmyslu je kyselina adipová, což je předchůdce používaný při výrobě nylon. Další příklady dikarboxylových kyselin zahrnují kyselina asparagová a kyselina glutamová, dva aminokyseliny v lidském těle. Název lze zkrátit na dikyselina.
Lineární nasycené dikarboxylové kyseliny
Obecný vzorec je HO
2C (CH
2)
nCO
2H.[1] The PubChem odkazy poskytuje přístup k dalším informacím o sloučeninách, včetně dalších jmen, ID, toxicity a bezpečnosti.
n Běžné jméno Systematický název IUPAC Struktura pKA1 pKA2 PubChem 0 Kyselina šťavelová kyselina etandiová 
1.27 4.27 971 1 Kyselina malonová kyselina propandiová 
2.85 5.05 867 2 Kyselina jantarová kyselina butandiová 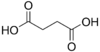
4.21 5.41 1110 3 Kyselina glutarová kyselina pentandiová 
4.34 5.41 743 4 Kyselina adipová kyselina hexandiová 
4.41 5.41 196 5 Kyselina pimelová kyselina heptandiová 
4.50 5.43 385 6 Kyselina suberová kyselina oktandiová 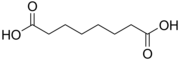
4.526 5.498 10457 7 Kyselina azelaová kyselina nonandiová 
4.550 5.498 2266 8 Kyselina sebaková kyselina dekandiová 
4.720 5.450 5192 9 kyselina undekandiová 
15816 10 kyselina dodekandiová 
12736 11 Kyselina brassylová kyselina tridekandiová 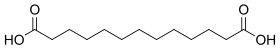
10458 14 Kyselina thapsová kyselina hexadekandiová 10459 19 Kyselina japonská kyselina heneikosadioová 9543668 20 Kyselina fhellogenová kyselina dokosandiová 244872 28 Kyselina ekvisetolová kyselina triakontandiová 5322010
Výskyt
- Kyselina adipová, navzdory svému názvu (v latině adipis znamená tuk), není běžnou složkou přírodních lipidů, ale je produktem oxidační žluklost. Poprvé byl získán oxidací ricinový olej (kyselina ricinolejová ) s kyselinou dusičnou. Nyní se průmyslově vyrábí oxidací cyklohexanol nebo cyklohexan, hlavně pro výrobu Nylon 6-6. Má několik dalších průmyslových využití při výrobě lepidla, změkčovadla želatinizační činidla, hydraulické kapaliny, maziva, změkčovadla, polyuretanové pěny, vyčinění kůže, urethan a také jako okyselující látka v potravinách.
- Kyselina pimelová (řecky pimelh, tuk) byl také nejprve izolován z oxidovaného oleje. Deriváty kyseliny pimelové se podílejí na biosyntéze lysin.
- Kyselina suberová byla nejprve vyrobena oxidací korku kyselinou dusičnou (latinsky suber). Tato kyselina se také vytváří při oxidaci ricinového oleje. Kyselina suberová se používá při výrobě alkydové pryskyřice a při syntéze polyamidy (nylon varianty).
- Název kyseliny azelaové pochází z působení kyseliny dusičné (azotové, dusíkové nebo azotické, dusičné) oxidace kyselina olejová nebo kyselina elaidová. Bylo zjištěno mezi produkty žluklých tuků. Jeho původ vysvětluje jeho přítomnost ve špatně zachovaných vzorcích lněný olej a ve vzorcích masti odstraněných z egyptských hrobek starých 5 000 let. Kyselina azelaová byla připravena oxidací kyseliny olejové s manganistan draselný, ale nyní oxidativním štěpením kyseliny olejové s kyselina chromová nebo ozonolýzou. Kyselina azelaová se používá jako jednoduché estery nebo estery s rozvětveným řetězcem) při výrobě změkčovadel (pro vinylchlorid pryskyřice, guma), maziva a tuky. Kyselina azelaová se nyní používá v kosmetice (léčba akné). Zobrazuje bakteriostatické a baktericidní vlastnosti proti různým aerobní a anaerobní mikroorganismy na pokožce nesoucí akné. . Kyselina azelaová byla identifikována jako molekula, která se akumulovala ve zvýšených hladinách v některých částech rostlin a bylo prokázáno, že je schopna zvýšit odolnost rostlin vůči infekcím.[2]
- Kyselina sebaková, pojmenovaná z mazu (lůj ). Thenard izoloval tuto sloučeninu z destilačních produktů hovězího loje v roce 1802. Vyrábí se průmyslově alkalickým štěpením ricinového oleje.[3] Kyselina sebaková a její deriváty mají řadu průmyslových použití jako změkčovadla, mazadla, oleje pro difúzní pumpy, kosmetiku, svíčky atd. Používá se také při syntéze polyamidu, jako je nylon, a alkydových pryskyřic. Isomer, kyselina isosebaková, má několik aplikací při výrobě změkčovadel vinylové pryskyřice, vytlačovacích plastů, lepidel, esterových mazadel, polyesterů, polyuretanových pryskyřic a syntetická guma.
- Kyselinu brassylovou lze vyrobit z kyselina eruková podle ozonolýza ale také mikroorganismy (Candida sp. ) z tridecane. Tato dikyselina se v Japonsku vyrábí v malém komerčním měřítku na výrobu vonných látek.[4]
- Kyselina dodekandiová se používá při výrobě nylonu (nylon-6,12), polyamidů, povlaků, lepidel, tuků, polyesterů, barviv, detergentů, retardérů hoření a vonných látek. Nyní se vyrábí fermentací alkanů s dlouhým řetězcem se specifickým kmenem Candida tropicalis.[4] Kyselina traumatická je její mononenasycený protějšek.
- Kyselina thapsová byla izolována ze sušených kořenů středomořské „smrtící mrkve“, Thapsia garganica (Apiaceae ).
Japonský vosk je směs obsahující triglyceridy dikarboxylových kyselin C21, C22 a C23 získané z strom škumpy (Rhus sp.).
Velký průzkum dikarboxylových kyselin přítomných ve středomořských ořechech odhalil neobvyklé složky.[5] Bylo stanoveno celkem 26 vedlejších kyselin (od 2 u pekanových ořechů po 8% u arašídů): 8 druhů odvozených od kyselina jantarová, pravděpodobně ve vztahu k fotosyntéza a 18 druhů s řetězcem od 5 do 22 atomů uhlíku. Kyseliny s vyšší hmotností (> C20) se nacházejí v ponorka přítomný na rostlinných površích (vnější kůra, kořenová pokožka). C16 až C26 a, ω-dioové kyseliny jsou považovány za diagnostické pro suberin. U C18: 1 a C18: 2 činí jejich obsah od 24 do 45% celého suberinu. Jsou v rostlině přítomny v nízkých hladinách (<5%) Cutin, kromě v Arabidopsis thaliana kde jejich obsah může být vyšší než 50%.[6]
Ukázalo se, že hypertermofilní mikroorganismy konkrétně obsahovaly velké množství dikarboxylových kyselin.[7]To je pravděpodobně nejdůležitější rozdíl mezi těmito mikroorganismy a jinými mořskými bakteriemi. Dioické mastné kyseliny od C16 do C22 byly nalezeny v hypertermofilní látce archaeon, Pyrococcus furiosus. Diokové kyseliny s krátkým a středním řetězcem (až 11 atomů uhlíku) byly objeveny v Sinice rodu Aphanizomenon.[8]
Dikarboxylové kyseliny mohou být produkovány ω-oxidací mastných kyselin během jejich katabolismus. Bylo zjištěno, že tyto sloučeniny se objevily v moči po podání trikaprinu a triundecylinu. I když význam jejich biosyntézy zůstává nedostatečně pochopen, bylo prokázáno, že ω-oxidace probíhá v játrech potkanů, ale při nízké rychlosti potřebuje kyslík, NADPH a cytochrom P450. Později se ukázalo, že tato reakce je důležitější u hladovějících nebo diabetických zvířat, kde 15% kyselina palmitová je vystaven ω-oxidaci a poté toboxidaci, tím se vytvoří malonyl-coA který se dále používá při syntéze nasycených mastných kyselin.[9]Stanovení dikarboxylových kyselin generovaných oxidací manganistan-jodistanu monoenových mastných kyselin bylo užitečné ke studiu polohy dvojné vazby v uhlíkovém řetězci.[10]
Dikarboxylové kyseliny s rozvětveným řetězcem
Obsahující dikarboxylové kyseliny s dlouhým řetězcem vicinální v rodu byly objeveny dimetylové větvení blízko středu uhlíkového řetězce Butyrivibrio, bakterie, které se podílejí na trávení celulózy v bachoru.[11] Tyto mastné kyseliny, pojmenované diabolické kyseliny, mají délku řetězce v závislosti na mastné kyselině použité v kultivačním médiu. Nejhojnější kyselina diabolická v Butyrivibrio měl 32-uhlíkový řetězec. Diabolické kyseliny byly také detekovány v jádrových lipidech rodu Termotoga objednávky Thermotogales, bakterie žijící v solfatara pružiny, hlubinné mořské hydrotermální systémy a vysokoteplotní mořská a kontinentální ropná pole.[12] Ukázalo se, že asi 10% jejich lipidové frakce byly symetrické diabolické kyseliny C30 až C34. C30 (13,14-dimethyloktakosandiová kyselina) a C32 (15,16-dimethyltriacontandiová kyselina) diabolické kyseliny byly popsány v Thermotoga maritima.[13]
Některé mateřské dikyseliny C29 až C32, ale s methylovými skupinami na uhlících C-13 a C-16, byly izolovány a charakterizovány z lipidů termofilní anaerobní eubacterium Themanaerobacter ethanolicus.[14] Nejhojnější dikyselinou byla kyselina C30a, ω-13,16-dimethyloktakosandiová.
Bifhytanové dikyseliny jsou přítomny v geologických sedimentech a jsou považovány za stopovací látky minulé anaerobní oxidace metanu.[15] V kenozoických vsakovacích vápencích bylo zjištěno několik forem bez nebo s jedním nebo dvěma pentacyklickými kruhy. Tyto lipidy mohou být nerozpoznanými metabolity z Archea.

Crocetin je základní sloučenina krokinů (crocetin glykosidů), které jsou hlavními červenými pigmenty šafránových stigmat (Crocus sativus ) a plody gardénie (Gardenia jasminoides ). Crocetin je dikarboxylová kyselina s 20 atomy uhlíku, která je diterpenenoid a lze ji považovat za karotenoid. Byl to první rostlinný karotenoid, který byl rozpoznán již v roce 1818, zatímco historie pěstování šafránu sahá více než 3000 let zpět. Hlavní účinnou látkou šafránu je žlutý pigment crocin 2 (jsou známy tři další deriváty s různými glykosylacemi) obsahující na každém konci molekuly skupinu gentiobiose (disacharid). Byla vyvinuta jednoduchá a specifická metoda HPLC-UV ke kvantifikaci pěti hlavních biologicky aktivních složek šafránu, konkrétně čtyř crocinů a crocetinu.[16]
Nenasycené dikarboxylové kyseliny
Typ Běžné jméno Název IUPAC Isomer Strukturní vzorec PubChem Mononenasycené Kyselina maleinová Kyselina (Z) -butendiová cis 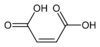
444266 Kyselina fumarová Kyselina (E) -butendiová trans 
444972 Kyselina acetyléndikarboxylová Kyselina but-2-yndiová nepoužitelné 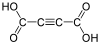
371 Kyselina glutakonová Kyselina (Z) -pent-2-enedioová cis 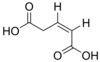
5370328 Kyselina (E) -pent-2-enedioová trans 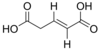
5280498 Kyselina 2-decendioová trans 
6442613 Kyselina traumatická Kyselina dodec-2-enedioová trans 
5283028 Nenasycený Kyselina mukonová Kyselina (2E, 4E) -hexa-2,4-dienendioová trans, trans 
5356793 Kyselina (2Z, 4E) -hexa-2,4-dienendioová cis, trans 
280518 Kyselina (2Z, 4Z) -hexa-2,4-dienendioová cis, cis 
5280518 Kyselina glutinová
(Kyselina allen-1,3-dikarboxylová)(RS) -Kyselina penta-2,3-dienedioová HO2CCH = C = CHCO2H 5242834 Větvené Kyselina citrakonová Kyselina (2Z) -2-methylbut-2-eniová cis 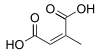
643798 Kyselina mesakonová Kyselina (2E) -2-methyl-2-butendioová trans 
638129 Kyselina itakonová Kyselina 2-methylidenbutandiová – 
811
Kyselina traumatická byla jednou z prvních biologicky aktivních molekul izolovaných z rostlinných tkání. Ukázalo se, že tato dikarboxylová kyselina je účinným prostředkem pro hojení ran v rostlině, který stimuluje buněčné dělení poblíž místa rány,[17]pochází z 18: 2 nebo 18: 3 mastných kyselin hydroperoxidy po přeměně na oxo- mastné kyseliny.
trans, trans-Kyselina muconová je a metabolit benzenu u lidí. Stanovení jeho koncentrace v moči se proto používá jako a biomarker pracovní nebo environmentální expozice benzenu.[18][19]
Kyselina glutinová, substituovaná Allene, byl izolován od Alnus glutinosa (Betulaceae).[20]
Zatímco polynenasycené mastné kyseliny jsou v rostlinných kutikulách neobvyklé, byla jako součást povrchových vosků nebo polyesterů některých druhů rostlin popsána di-nenasycená dikarboxylová kyselina. Octadeca-c6, c9-dien-1,18-dioát, derivát kyselina linolová, je přítomen v Arabidopsis a Brassica napus pokožka.[21]
Alkylitaconates

PubChem 811
Bylo izolováno několik dikarboxylových kyselin s alkylovým postranním řetězcem a itakonátovým jádrem lišejníky a houby, kyselina itakonová (kyselina methylenesukcinová) je metabolit produkovaný vláknitými houbami. Z těchto sloučenin bylo z různých druhů lišejníků izolováno několik analogů, nazývaných kyseliny chaetomellové s různou délkou řetězce a stupněm nenasycení. Chaetomella. Ukázalo se, že tyto molekuly jsou cenné jako základ pro vývoj protinádorových léčiv kvůli jejich silné farnesyltransferáza inhibiční účinky.[22]
Řada alkyl- a alkenyl-itakonátů, známých jako kyselina ceriporová (Pub Chem 52921868 ), byly nalezeny v kulturách selektivního lignin -degradující houba (houba bílá hniloba ), Ceriporiopsis subvermispora.[23][24] Podrobně byla diskutována absolutní konfigurace ceriporových kyselin, jejich stereoselektivní biosyntetická dráha a rozmanitost jejich metabolitů.[25]
Substituované dikarboxylové kyseliny
Běžné jméno Název IUPAC Strukturní vzorec PubChem Kyselina tartronová Kyselina 2-hydroxypropandiová 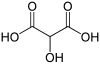
45 Kyselina mezoxalová Kyselina oxopropandiová 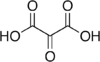
10132 Kyselina jablečná Kyselina hydroxybutandiová 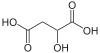
525 Kyselina vinná Kyselina 2,3-dihydroxybutandiová 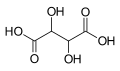
875 Kyselina oxalooctová Kyselina oxobutandiová 
970 Kyselina asparagová Kyselina 2-aminobutandiová 
5960 kyselina dioxosukcinová kyselina dioxobutandiová 
82062 kyselina α-hydroxyglutarová 2-hydroxypentandikarboxylová kyselina 
43 Kyselina arabinarová Kyselina 2,3,4-trihydroxypentandiová 109475 Kyselina acetonedikarboxylová Kyselina 3-oxopentandiová 
68328 Kyselina α-ketoglutarová Kyselina 2-oxopentandiová 
51 Kyselina glutamová Kyselina 2-aminopentandiová 
611 Kyselina diaminopimelová Kyselina (2R, 6S) -2,6-diaminoheptandiová 
865 Kyselina cukrová (2S, 3S, 4S, 5R) -2,3,4,5-tetrahydroxyhexandiová kyselina 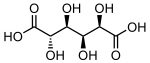
33037
Aromatické dikarboxylové kyseliny
Běžná jména Název IUPAC Struktura PubChem Kyselina ftalová
Ókyselina ftalováKyselina benzen-1,2-dikarboxylová 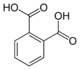
1017 Kyselina isoftalová
mkyselina ftalováKyselina benzen-1,3-dikarboxylová 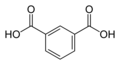
8496 Kyselina tereftalová
pkyselina ftalováKyselina benzen-1,4-dikarboxylová 
7489 Kyselina difenová
Kyselina bifenyl-2,2'-dikarboxylováKyselina 2- (2-karboxyfenyl) benzoová 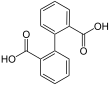
10210 2,6-naftalendikarboxylová kyselina 2,6-naftalendikarboxylová kyselina 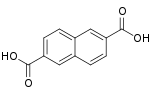
14357
Kyselina tereftalová je a komoditní chemikálie používané při výrobě polyester známé pod obchodními názvy jako PET, Terylen, Dacron a Lavsan.
Vlastnosti
Dikarboxylové kyseliny jsou krystalické pevné látky. Rozpustnost ve vodě a teplota tání sloučenin α, ω- postupují v sérii, protože uhlíkové řetězce se prodlužují střídáním lichého a sudého počtu atomů uhlíku, takže pro sudá čísla atomů uhlíku je teplota tání vyšší než pro další v řadě s lichým číslem.[26] Tyto sloučeniny jsou slabé dvojsytné kyseliny s pKA inklinující k hodnotám ca. 4,5 a 5,5, jak se zvyšuje separace mezi dvěma karboxylátovými skupinami. Ve vodném roztoku o pH asi 7, typickém pro biologické systémy, tedy Henderson-Hasselbalchova rovnice znamená, že existují převážně jako dikarboxylátové anionty.
Jako zesíťovací činidla lze použít dikarboxylové kyseliny, zejména malé a lineární.[27] Dikarboxylové kyseliny, kde karboxylové skupiny nejsou odděleny žádným nebo jedním atomem uhlíku, se při zahřívání rozkládají za vzniku oxidu uhličitého a zanechání monokarboxylové kyseliny.[26]
Blancovo pravidlo říká, že zahřátím barnaté soli dikarboxylové kyseliny nebo její dehydratací anhydridem kyseliny octové se získá anhydrid cyklické kyseliny, pokud jsou atomy uhlíku nesoucí kyselé skupiny v poloze 1 a (3,4 nebo 5). Kyselina jantarová se tedy získá anhydrid kyseliny jantarové. U kyselin s karboxylovými skupinami v poloze 1 a 6 tato dehydratace způsobuje ztrátu oxidu uhličitého a vody za vzniku cyklického ketonu, například kyselina adipová cyklopentanon.[26]
Deriváty
Pokud jde o monofunkční karboxylové kyseliny, existují deriváty stejného typu. Existuje však další komplikace, že lze změnit jednu nebo dvě karboxylové skupiny. Pokud se změní pouze jeden, pak se derivát nazývá „kyselina“, a pokud se oba konce změní, nazývá se to „normální“. Tyto deriváty zahrnují soli, chloridy, estery, amidy a anhydridy. V případě anhydridů nebo amidů se dvě z karboxylových skupin mohou spojit za vzniku cyklické sloučeniny, například sukcinimid.[28]
Viz také
Reference
- ^ Boy Cornils, Peter Lappe „Dikarboxylové kyseliny, alifatické“ v Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a08_523
- ^ Jung, Ho Won; Tschaplinski, Timothy J .; Wang, Lin; Glazebrook, Jane; Greenberg, Jean T. (2009). "Primování v systémové imunitě rostlin". Věda. 324 (3. dubna 2009): 89–91. Bibcode:2009Sci ... 324 ... 89W. doi:10.1126 / science.1170025. PMID 19342588.
- ^ Kadesch, Richard G. (listopad 1954). "Kyseliny dibázové". Journal of the American Oil Chemists 'Society. 31 (11): 568–573. doi:10.1007 / BF02638574.
- ^ A b Kroha, Kyle (září 2004). „Průmyslová biotechnologie poskytuje příležitosti pro komerční výrobu nových dibázických kyselin s dlouhým řetězcem“. Informovat. 15: 568–571.
- ^ Dembitsky, Valery M; Goldshlag, Paulina; Srebnik, Morris (duben 2002). "Výskyt dikarboxylových (dioových) kyselin v některých středomořských ořechech". Chemie potravin. 76 (4): 469–473. doi:10.1016 / S0308-8146 (01) 00308-9.
- ^ Pollard, Mike; Beisson, Fred; Ohlrogge, John B. (3. dubna 2009). "Budování lipidových bariér: biosyntéza kutinu a suberinu". Trendy ve vědě o rostlinách. 13 (5): 89–91. doi:10.1016 / j.tplantts.2008.03.003.
- ^ Carballeira, N. M .; Reyes, M .; Sostre, A .; Huang, H .; Verhagen, M. F .; Adams, M. W. (2009). „Neobvyklé složení mastných kyselin hypertermofilního archaeona Pyrococcus furiosus a bakterie Thermotoga maritima“. J. Bacteriol. 179 (8): 2766–2768. doi:10.1128 / jb.179.8.2766-2768.1997. PMC 179030. PMID 9098079.
- ^ Dembitsky, V. M .; Shkrob, I .; Go, J. V. (2001). „Složení dikarboxylových a mastných kyselin sinic rodu Aphanizomenon“. Biochemie (Moskva). 66 (1): 72–76. doi:10.1023 / A: 1002837830653. PMID 11240396.
- ^ Wada, F .; Usami, M. (1997). „Studie na ω-oxidační mastné kyseliny, antiketogenní účinek a glukoneogenicita dikarboxylových kyselin“. Biochimica et Biophysica Acta (BBA) - lipidy a metabolismus lipidů. 487 (2): 261–268. doi:10.1016/0005-2760(77)90002-9.
- ^ Longmuir, Kenneth J .; Rossi, Mary E .; Resele-Tiden, Christine (1987). „Stanovení polohy dvojné vazby monoenové mastné kyseliny oxidací manganistanu a jodistanu následovanou vysoce účinnou kapalinovou chromatografií fenacylesterů karboxylové kyseliny“. Analytická biochemie. 167 (2): 213–221. doi:10.1016/0003-2697(87)90155-2. PMID 2831753.
- ^ Klein, RA; Hazlewood, GP; Kemp, P; Dawson, RM (1. prosince 1979). „Nová řada dikarboxylových kyselin s dlouhým řetězcem s vicinálním dimethylovým rozvětvením nalezená jako hlavní složka lipidů Butyrivibrio spp.“. The Biochemical Journal. 183 (3): 691–700. doi:10.1042 / bj1830691. PMC 1161651. PMID 540040.
- ^ Huber, Robert; Langworthy, Thomas A .; König, Helmut; Thomm, Michael; Woese, Carl R .; Sleytr, Uwe B .; Stetter, Karl O. (květen 1986). „Thermotoga maritima sp. Nov. Představuje nový rod jedinečných extrémně termofilních eubakterií rostoucích až do 90 ° C“. Archiv mikrobiologie. 144 (4): 324–333. doi:10.1007 / BF00409880.
- ^ Carballeira, NM; Reyes, M; Sostre, A; Huang, H; Verhagen, MF; Adams, MW (duben 1997). „Neobvyklé složení mastných kyselin hypertermofilního archaeona Pyrococcus furiosus a bakterie Thermotoga maritima“. Journal of Bacteriology. 179 (8): 2766–8. doi:10.1128 / jb.179.8.2766-2768.1997. PMC 179030. PMID 9098079.
- ^ Jung, S; Zeikus, JG; Hollingsworth, RI (červen 1994). „Nová rodina alfa, omega-dikarboxylových kyselin s velmi dlouhým řetězcem je hlavní strukturní mastnou acylovou složkou membránových lipidů Thermoanaerobacter ethanolicus 39E.“ Journal of Lipid Research. 35 (6): 1057–65. PMID 8077844.
- ^ Birgel, Daniel; Elvert, Marcus; Han, Xiqiu; Peckmann, Jörn (leden 2008). „Bifytové dikyseliny s deplecí 13C jako stopovací látky minulé anaerobní oxidace metanu“. Organická geochemie. 39 (1): 152–156. doi:10.1016 / j.orggeochem.2007.08.013.
- ^ Li, Na; Lin, Ge; Kwan, Yiu-Wa; Min, Zhi-Da (červenec 1999). „Simultánní kvantifikace pěti hlavních biologicky aktivních složek šafránu pomocí vysoce účinné kapalinové chromatografie“. Journal of Chromatography A. 849 (2): 349–355. doi:10.1016 / S0021-9673 (99) 00600-7. PMID 10457433.
- ^ Farmář, Edward E. (1994). "Signalizace mastných kyselin v rostlinách a jejich přidružených mikroorganismech". Molekulární biologie rostlin. 26 (5): 1423–1437. doi:10.1007 / BF00016483. PMID 7858198.
- ^ Wiwanitkit V, Soogarun S, Suwansaksri J (2007). „Korelační studie parametrů červených krvinek a trans moči, kyseliny trans-muconové v moči u subjektů s expozicí benzenu na pracovišti“. Toxikologická patologie. 35 (2): 268–9. doi:10.1080/01926230601156278. PMID 17366320.
- ^ Weaver VM, Davoli CT, Heller PJ a kol. (1996). „Expozice benzenu, hodnocená močí trans, kyselinou trans-muconovou, u městských dětí se zvýšenou hladinou olova v krvi“. Environ. Perspektiva zdraví. 104 (3): 318–23. doi:10.2307/3432891. JSTOR 3432891. PMC 1469300. PMID 8919771.
- ^ Sati, Sushil Chandra; Sati, Nitin; Sati, O. P. (2011). "Bioaktivní složky a léčivý význam rodu Alnus". Recenze farmakognosie. 5 (10): 174–183. doi:10.4103/0973-7847.91115. PMC 3263052. PMID 22279375.
- ^ Bonaventure, Gustavo; Ohlrogge, John; Pollard, Mike (2004). „Analýza složení alifatických monomerů polyesterů spojených s Arabidopsis epidermis: výskyt oktadeka-cis-6, cis-9-dien-1,18-dioátu jako hlavní složky“. The Plant Journal. 40 (6): 920–930. doi:10.1111 / j.1365-313X.2004.02258.x. PMID 15584957.
- ^ Singh, SB; Jayasuriya, H; Silverman, KC; Bonfiglio, CA; Williamson, JM; Lingham, RB (březen 2000). „Efektivní syntézy, inhibiční aktivity chaetomelických kyselin a analogů na lidskou a kvasinkovou farnesyl-protein transferázu“. Bioorganická a léčivá chemie. 8 (3): 571–80. doi:10.1016 / S0968-0896 (99) 00312-0. PMID 10732974. - přes ScienceDirect (Může být vyžadováno předplatné nebo může být obsah dostupný v knihovnách.)
- ^ Enoki, Makiko; Watanabe, Takashi; Honda, Yoichi; Kuwahara, Masaaki (2000). „Nová fluorescenční kyselina dikarboxylová, kyselina (Z) -1,7-nonadekien-2,3-dikarboxylová, vyráběná houbami White-Rot Ceriporiopsis subvermispora“. Chemické dopisy. 29 (1): 54–55. doi:10,1246 / cl. 2000,54.
- ^ Amirta, Rudianto; Fujimori, Keňa; Shirai, Nobuaki; Honda, Yoichi; Watanabe, Takashi (prosinec 2003). „Kyselina ceriporová C, hexadecenylitaconát produkovaný houbou degradující lignin, Ceriporiopsis subvermispora“. Chemie a fyzika lipidů. 126 (2): 121–131. doi:10.1016 / S0009-3084 (03) 00098-7. PMID 14623447.
- ^ Nishimura, Hiroshi; Murayama, Kyoko; Watanabe, Takahito; Honda, Yoichi; Watanabe, Takashi (červen 2009). „Absolutní konfigurace kyselin ceriporových, metabolity umlčující redox železo produkované selektivní houbou degradující lignin, Ceriporiopsis subvermispora“. Chemie a fyzika lipidů. 159 (2): 77–80. doi:10.1016 / j.chemphyslip.2009.03.006. PMID 19477313.
- ^ A b C Schmidt, Julius (1955). Organická chemie. Londýn: Oliver a Boyd. 283–284.
- ^ Moghadas, Babak; Solouk, Atefeh; Sadeghi, Davoud (2020-08-24). „Vývoj chitosanové membrány s použitím netoxických zesíťovacích prostředků pro potenciální aplikace krytí ran“. Bulletin polymerů. doi:10.1007 / s00289-020-03352-8. ISSN 1436-2449.
- ^ Bernthsen, A. (1922). Organická chemie. London: Blackie & Son. str. 242.
externí odkazy
- Lipidomics gateway Structure Database Dikarboxylové kyseliny
- Dijkstra, Albert J. „Triviální názvy mastných kyselin - část 1“. lipidlibrary.aocs.org. Citováno 24. června 2019.




























