DNA ligáza - DNA ligase
tento článek potřebuje další citace pro ověření. (Února 2007) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| DNA ligáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Umělecké pojetí DNA ligázy opravující poškození chromozomů | |||||||||
| Identifikátory | |||||||||
| EC číslo | 6.5.1.1 | ||||||||
| Číslo CAS | 9015-85-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| ligáza I, DNA, závislá na ATP | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identifikátory | |||||||
| Symbol | LIG1 | ||||||
| Gen NCBI | 3978 | ||||||
| HGNC | 6598 | ||||||
| OMIM | 126391 | ||||||
| RefSeq | NM_000234 | ||||||
| UniProt | P18858 | ||||||
| Další údaje | |||||||
| Místo | Chr. 19 [1] | ||||||
| |||||||
| ligáza III, DNA, závislá na ATP | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | LIG3 | ||||||
| Gen NCBI | 3980 | ||||||
| HGNC | 6600 | ||||||
| OMIM | 600940 | ||||||
| RefSeq | NM_002311 | ||||||
| UniProt | P49916 | ||||||
| Další údaje | |||||||
| Místo | Chr. 17 q11.2-q12 | ||||||
| |||||||
DNA ligáza je specifický typ enzymu, a ligáza, (ES 6.5.1.1 ) který usnadňuje připojení k DNA prameny dohromady katalyzováním tvorby a fosfodiesterová vazba. Hraje roli při opravě jednořetězcových zlomů v duplexu DNA v živých organismech, ale některé formy (např DNA ligáza IV ) může konkrétně opravit dvouvláknové zlomy (tj. zlom v obou komplementární řetězce DNA). Jednořetězcové zlomy jsou opraveny DNA ligázou pomocí komplementárního vlákna dvojité šroubovice jako šablony,[1] s DNA ligázou vytvářející finální fosfodiesterovou vazbu k úplné opravě DNA.
U obou se používá DNA ligáza Oprava DNA a replikace DNA (vidět Savčí ligázy ). Kromě toho má DNA ligáza rozsáhlé použití v molekulární biologie laboratoře pro rekombinantní DNA experimenty (viz Výzkumné aplikace ). Vyčištěná DNA ligáza se používá při genovém klonování ke spojování molekul DNA dohromady za vzniku rekombinantní DNA.
Enzymatický mechanismus
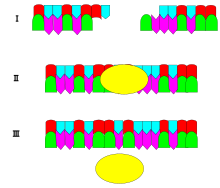
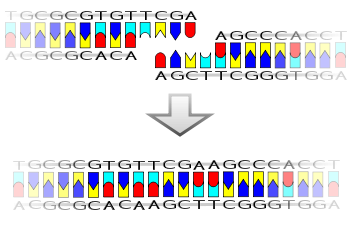
Mechanismus DNA ligázy je vytvoření dvou kovalentní fosfodiesterové vazby mezi 3 'hydroxylové konce jednoho nukleotid („akceptor“) s 5 'fosfátový konec jiného („dárce“). Pro každou vytvořenou fosfodiesterovou vazbu jsou spotřebovány dvě molekuly ATP. AMP je vyžadován pro ligázovou reakci, která probíhá ve čtyřech krocích:
- Reorganizace místa aktivity, jako jsou škrábance v DNA segmentech nebo fragmenty Okazaki atd.
- Adenylylace (přidání AMP) a lysin zbytek v aktivním centru enzymu, pyrofosfát je vydáno;
- Přenos AMP na 5 'fosfát takzvaného dárce, tvorba pyrofosfátové vazby;
- Tvorba fosfodiesterové vazby mezi 5 'fosfátem donoru a 3' hydroxylem akceptoru.[2]
Ligase bude také spolupracovat tupé konce, i když jsou vyžadovány vyšší koncentrace enzymů a různé reakční podmínky.
Typy
E-coli
The E-coli DNA ligáza je kódována lig gen. DNA ligáza v E-coli, stejně jako většina prokaryot, využívá energii získanou štěpením nikotinamid adenin dinukleotid (NAD) k vytvoření fosfodiesterové vazby.[3] Neliguje DNA s tupými konci, s výjimkou podmínek molekulárního shlukování polyethylenglykol, a nemůže účinně spojovat RNA s DNA.
Aktivitu DNA ligázy E. coli lze zvýšit pomocí DNA polymeráza ve správných koncentracích. Vylepšení funguje pouze v případě, že koncentrace DNA polymerázy 1 jsou mnohem nižší než fragmenty DNA, které mají být ligovány. Když jsou koncentrace Pol I DNA polymeráz vyšší, má to nepříznivý účinek na DNA ligázu E. coli[4]
T4
DNA ligáza z bakteriofág T4 (A bakteriofág který infikuje Escherichia coli bakterie). T4 ligáza je nejčastěji používaná v laboratorním výzkumu.[5] Může se ligovat soudržné nebo tupé konce DNA, oligonukleotidů, stejně jako RNA a hybridů RNA-DNA, ale ne jednovláknové nukleové kyseliny. Může také ligovat tupě zakončená DNA s mnohem větší účinností než E-coli DNA ligáza. Na rozdíl od E-coli DNA ligáza, T4 DNA ligáza nemůže využívat NAD a má absolutní požadavek na ATP jako kofaktor. Bylo provedeno určité inženýrství ke zlepšení in vitro aktivita T4 DNA ligázy; jeden úspěšný přístup, například testoval T4 DNA ligázu fúzovanou s několika alternativními proteiny vázajícími DNA a zjistil, že konstrukty buď s p50 nebo NF-kB protože fúzní partneři byli pro klonování o více než 160% aktivnější v ligacích s tupým koncem než DNA ligáza divokého typu T4.[6] Typická reakce pro vložení fragmentu do plazmidového vektoru by používala přibližně 0,01 (lepivé konce) až 1 (tupé konce) jednotek ligázy. Optimální inkubační teplota pro T4 DNA ligázu je 16 ° C.
Bakteriofág T4 ligáza mutanti mají zvýšenou citlivost na oba UV ozáření[7][8] a alkylační činidlo methylmethansulfonát[9] což naznačuje, že DNA ligáza je použita v opravit z Poškození DNA způsobené těmito agenty.
Savčí
U savců existují čtyři specifické typy ligázy.
- DNA ligáza I: liguje rodící se DNA zaostávající vlákno po Ribonukleáza H odstranil RNA primer z Okazaki fragmenty.
- DNA ligáza III: komplexy s Oprava DNA protein XRCC1 na pomoc při utěsňování DNA během procesu oprava nukleotidové excize a rekombinantní fragmenty. Ze všech známých savčích DNA ligáz bylo zjištěno, že v mitochondriích je přítomen pouze Lig III.
- DNA ligáza IV: komplexy s XRCC4. Katalyzuje poslední krok v nehomologní spojování konců Cesta opravy dvouvláknového zlomu DNA. Je také nutné pro V (D) J rekombinace, proces, který generuje rozmanitost v imunoglobulin a Receptor T-buněk loci během imunitní systém rozvoj.
- DNA ligáza II: zdá se, že se používá při opravách. Je tvořen alternativním sestřihem proteolytického fragmentu DNA ligázy III a nemá svůj vlastní gen, proto je často považován za prakticky totožný s DNA ligázou III.
DNA ligáza z eukaryoty a použití některých mikrobů adenosintrifosfát (ATP) spíše než NAD.[3]
Termostabilní
Enzym, odvozený z termofilní bakterie, je stabilní a aktivní při mnohem vyšších teplotách než běžné DNA ligázy. Jeho poločas je 48 hodin při 65 ° C a více než 1 hodina při 95 ° C. Ukázalo se, že ampligázová DNA Ligáza je aktivní po dobu nejméně 500 tepelných cyklů (94 ° C / 80 ° C) nebo 16 hodin cyklování.10 Tato výjimečná termostabilita umožňuje extrémně vysokou přísnost hybridizace a specificitu ligace.[10]
Měření aktivity
K měření aktivity DNA ligázy se používají nejméně tři různé jednotky:[11]
- Weissova jednotka - množství ligázy, které katalyzuje výměnu 1 nmolu 32P z anorganického pyrofosfát na ATP za 20 minut ve 37°C. Toto je nejčastěji používané.
- Jednotka Modrich-Lehman - toto se používá jen zřídka a jedna jednotka je definována jako množství enzymu potřebné k převodu 100 nmolů d (A-T)n do formy rezistentní na exonukleázu III za 30 minut za standardních podmínek.
- Mnoho komerčních dodavatelů ligáz používá libovolnou jednotku založenou na schopnosti ligázy ligovat kohezní konce. Tyto jednotky jsou často více subjektivní než kvantitativní a postrádají přesnost.
Výzkumné aplikace
DNA ligázy se staly nepostradatelnými nástroji v moderním výzkumu molekulární biologie pro generování rekombinantní DNA sekvence. Například DNA ligázy se používají s restrikční enzymy často vložit fragmenty DNA geny, do plazmidy.
Ovládání optimální teploty je zásadním aspektem provádění účinných rekombinačních experimentů zahrnujících ligaci fragmentů s kohezivním koncem. Většina experimentů používá T4 DNA ligázu (izolovanou z bakteriofág T4 ), který je nejaktivnější při 37 ° C.[12] Pro optimální účinnost ligace s fragmenty s kohezivním koncem („lepkavé konce“) je však nutné optimální teplotu enzymu vyrovnat s teplota tání Tm lepkavých konců ligovaných,[13] the homologní párování lepivých konců nebude stabilní, protože dojde k narušení vysoké teploty vodíkové vazby. Ligační reakce je nejúčinnější, když jsou lepivé konce již stabilně žíhány, a narušení žíhacích konců by proto mělo za následek nízkou účinnost ligace. Čím kratší převis, čím nižší je Tm.
Vzhledem k tomu, že fragmenty DNA s tupými konci nemají žádné kohezní konce k nasedání, teplota tání není faktorem, který je třeba brát v úvahu v normálním teplotním rozmezí ligační reakce. Omezujícím faktorem při ligaci tupých konců není aktivita ligázy, ale spíše počet seřazení mezi konci fragmentů DNA, ke kterým dochází. Nejúčinnější ligační teplota pro tupě zakončené DNA by proto byla teplota, při které může nastat největší počet vzájemných shod. Většina ligací s tupými konci se provádí při teplotě 14 až 25 ° C přes noc. Absence stabilně žíhaných konců také znamená, že účinnost ligace je snížena, což vyžaduje použití vyšší koncentrace ligázy.[13]
Nové použití DNA ligázy lze spatřit v oblasti nano chemie, konkrétně v DNA origami. Ukázalo se, že principy samosestavování založené na DNA jsou užitečné pro organizaci objektů v měřítku, jako jsou biomolekuly, nanomachiny, nanoelektronické a fotonické komponenty. Sestavení takové nano struktury vyžaduje vytvoření složité sítě molekul DNA. Ačkoli je možné samosestavení DNA bez jakékoli vnější pomoci s použitím různých substrátů, jako je zajištění katatonického povrchu hliníkové fólie, může DNA ligáza poskytnout enzymatickou pomoc, která je nutná k vytvoření struktury mřížky DNA z DNA.[14]
Dějiny
První DNA ligáza byla čištěna a charakterizována v roce 1967 laboratořemi Gellert, Lehman, Richardson a Hurwitz.[15] Nejprve byl purifikován a charakterizován Weissem a Richardsonem za použití šestistupňového chromatografického frakcionačního procesu počínaje eliminací buněčných zbytků a přidáním streptomycinu, po kterém následovalo několik promytí kolony diethylaminoethyl (DEAE) -celulózy a finální fosfocelulózová frakcionace. Konečný extrakt obsahoval 10% aktivity původně zaznamenané vE-colimédia; v průběhu procesu bylo zjištěno, že k optimalizaci reakce jsou nezbytné ATP a Mg ++. Běžné komerčně dostupné DNA ligázy byly původně objeveny v bakteriofág T4, E-coli a další bakterie.[16]
Poruchy
Genetické nedostatky v lidských DNA ligázách byly spojeny s klinickými syndromy vyznačenými imunodeficiencí, radiační citlivostí a vývojovými abnormalitami,[15] LIG4 syndrom (Syndrom ligázy IV) je vzácné onemocnění spojené s mutacemi DNA ligázy 4 a interferuje s mechanismy opravy zlomení dsDNA. Syndrom ligázy IV způsobuje imunodeficienci u jedinců a je běžně spojován s mikrocefalií a hypoplázií dřeně.[17] Seznam nejčastějších onemocnění způsobených nedostatkem nebo nesprávnou funkcí DNA ligázy je následující.
Xeroderma pigmentosum
Xeroderma pigmentosum, která je běžně známá jako XP, je zděděný stav charakterizovaný extrémní citlivostí na ultrafialové (UV) paprsky ze slunečního záření. Tento stav většinou postihuje oči a oblasti pokožky vystavené slunci. Někteří postižení jedinci mají také problémy s nervovým systémem.[18]
Ataxia-telangiektázie
Mutace v genu ATM způsobujíataxie – telangiektázie. Gen ATM poskytuje pokyny pro výrobu proteinu, který pomáhá řídit dělení buněk a podílí se na opravě DNA. Tento protein hraje důležitou roli v normálním vývoji a činnosti několika tělesných systémů, včetně nervového systému a imunitního systému. Protein ATM pomáhá buňkám rozpoznávat poškozené nebo zlomené řetězce DNA a koordinuje opravu DNA aktivací enzymů, které fixují zlomená vlákna. Účinná oprava poškozených řetězců DNA pomáhá udržovat stabilitu genetické informace buňky. U postižených dětí se obvykle projevují potíže s chůzí, problémy s rovnováhou a koordinací rukou, mimovolní trhavé pohyby (chorea), záškuby svalů (myoklonus) a poruchy nervových funkcí (neuropatie). Problémy s pohybem obvykle způsobují, že lidé v dospívání potřebují pomoc na invalidním vozíku. Lidé s touto poruchou mají také nezřetelnou řeč a potíže s pohybem očí, aby vypadali ze strany na stranu (okulomotorická apraxie).[19]
Fanconiho anémie
Fanconiho anémie (FA) je vzácná dědičná porucha krve, která vede k selhání kostní dřeně. FA brání kostní dřeni vytvářet dostatek nových krevních buněk pro normální fungování těla. FA také může způsobit, že kostní dřeň vytváří mnoho vadných krevních buněk. To může vést k vážným zdravotním problémům, jako je leukémie.[20]
Bloomův syndrom
Bloomův syndrom vede k pokožce, která je citlivá na sluneční záření, a obvykle k rozvoji zarudlé kůže ve tvaru motýla přes nos a tváře. Kožní vyrážka se může objevit také na jiných místech, která jsou obvykle vystavena slunci, jako je hřbet rukou a předloktí. V vyrážce se často objevují malé shluky zvětšených krevních cév (telangiektázy); telangiektázy se mohou vyskytovat také v očích. Mezi další vlastnosti pokožky patří skvrny na kůži, které jsou světlejší nebo tmavší než okolní oblasti (hypopigmentace nebo hyperpigmentace). Tyto skvrny se objevují na oblastech pokožky, které nejsou vystaveny slunci, a jejich vývoj nesouvisí s vyrážkami.
Jako drogový cíl
V nedávných studiích byla použita lidská DNA ligáza I Počítačem podporovaný design léčiv identifikovat inhibitory DNA ligázy jako možné terapeutické látky k léčbě rakoviny.[21] Vzhledem k tomu, že nadměrný buněčný růst je charakteristickým znakem vývoje rakoviny, může cílená chemoterapie, která narušuje fungování DNA ligázy, bránit adjuvantní formě rakoviny. Dále se ukázalo, že DNA ligázy lze obecně rozdělit do dvou kategorií, a to ATP- a NAD+-závislý. Předchozí výzkum ukázal, že i když NAD+-závislé DNA ligázy byly objeveny ve sporadických buněčných nebo virových výklencích mimo bakteriální doménu života, neexistuje žádný případ, kdy by NAD+-dependentní ligáza je přítomna v a eukaryotický organismus. Přítomnost pouze v neeukaryotických organismech, jedinečná substrátová specificita a charakteristická doménová struktura NAD + závislá ve srovnání s ATP-závislými lidskými DNA ligázami společně tvoří NAD+-dependentní ligázy ideální cíle pro vývoj nových antibakteriálních léků.[15]
Viz také
Reference
- ^ Pascal JM, O'Brien PJ, Tomkinson AE, Ellenberger T (listopad 2004). „Lidská DNA ligáza úplně obklopuje a částečně odvíjí přezdívanou DNA“. Příroda. 432 (7016): 473–8. Bibcode:2004 Natur.432..473P. doi:10.1038 / nature03082. PMID 15565146. S2CID 3105417.
- ^ Lehman IR (listopad 1974). "DNA ligáza: struktura, mechanismus a funkce". Věda. 186 (4166): 790–7. Bibcode:1974Sci ... 186..790L. doi:10.1126 / science.186.4166.790. PMID 4377758. S2CID 86549159.
- ^ A b Foster JB, Slonczewski J (2010). Mikrobiologie: vyvíjející se věda (Druhé vydání.). New York: W. W. Norton & Company. ISBN 978-0-393-93447-2.
- ^ Yang Y, LiCata VJ (únor 2018). „Pol I DNA polymerázy stimulují DNA spojení na konci pomocí DNA ligázy Escherichia coli“. Sdělení o biochemickém a biofyzikálním výzkumu. 497 (1): 13–18. doi:10.1016 / j.bbrc.2018.01.165. PMID 29409896.
- ^ "Ligázy" (PDF). Průvodce enzymovými prostředky. Promega Corporation. s. 8–14.
- ^ Wilson RH, Morton SK, Deiderick H, Gerth ML, Paul HA, Gerber I, Patel A, Ellington AD, Hunicke-Smith SP, Patrick WM (červenec 2013). "Upravené DNA ligázy se zlepšenými aktivitami in vitro". Proteinové inženýrství, design a výběr. 26 (7): 471–8. doi:10,1093 / protein / gzt024. PMID 23754529.
- ^ Baldy MW (1968). "Oprava a rekombinace ve fágu T4. II. Geny ovlivňující UV citlivost". Cold Spring Harbor Symposia o kvantitativní biologii. 33: 333–8. doi:10,1101 / sqb.1968.033.01.038. PMID 4891973.
- ^ Baldy MW (únor 1970). „UV citlivost některých časně funkčních teplotně citlivých mutantů fága T4“. Virologie. 40 (2): 272–87. doi:10.1016/0042-6822(70)90403-4. PMID 4909413.
- ^ Baldy MW, Strom B, Bernstein H (březen 1971). „Oprava alkylovaného bakteriofága T4 deoxyribonukleové kyseliny mechanismem zahrnujícím polynukleotidovou ligázu“. Journal of Virology. 7 (3): 407–8. doi:10.1128 / JVI.7.3.407-408.1971. PMC 356131. PMID 4927528.
- ^ „Ampligáza - termostabilní DNA ligáza“. www.epibio.com. Citováno 2017-05-15.
- ^ Russell DW, Sambrook J (2001). „Kapitola 1: Plazmidy a jejich užitečnost při molekulárním klonování“. Molekulární klonování: laboratorní příručka. 1 (3. vyd.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory. s. 1–159. ISBN 978-0-87969-577-4.
- ^ Baneyx F, Lucotte G (1993). Úvod do technik molekulárního klonování. Chichester: John Wiley & Sons. p. 156. ISBN 978-0-471-18849-0.
- ^ A b Tabor S (květen 2001). "DNA ligázy". Současné protokoly v molekulární biologii. Kapitola 3: Jednotka 3.14. doi:10.1002 / 0471142727.mb0314s08. ISBN 978-0-471-14272-0. PMID 18265223. S2CID 23944826.
- ^ Bhanjadeo MM, Nayak AK, Subudhi U (2017). „Surface-assisted DNA self-assembly: Enzym-free strategy towards creation of branched DNA mřížky“. Sdělení o biochemickém a biofyzikálním výzkumu. 485 (2): 492–498. doi:10.1016 / j.bbrc.2017.02.024. PMID 28189681.
- ^ A b C Shuman S (červen 2009). „DNA ligázy: pokrok a vyhlídky“. The Journal of Biological Chemistry. 284 (26): 17365–9. doi:10,1074 / jbc.R900017200. PMC 2719376. PMID 19329793.
- ^ Weiss B, Richardson CC (duben 1967). „Enzymatické rozbití a spojení deoxyribonukleové kyseliny, I. Oprava jednořetězcových zlomů DNA pomocí enzymového systému z Escherichia coli infikovaného bakteriofágem T4“. Sborník Národní akademie věd Spojených států amerických. 57 (4): 1021–8. Bibcode:1967PNAS ... 57.1021W. doi:10.1073 / pnas.57.4.1021. PMC 224649. PMID 5340583.
- ^ Altmann T, Gennery AR (říjen 2016). „Syndrom DNA ligázy IV; recenze“. Orphanet Journal of Rare Diseases. 11 (1): 137. doi:10.1186 / s13023-016-0520-1. PMC 5055698. PMID 27717373.
- ^ "xeroderma pigmentosum". Genetická domácí reference. Citováno 2017-05-15.
- ^ "ataxia-telangiectasia". Genetická domácí reference. Citováno 2017-05-15.
- ^ „Co je Fanconiho anémie?“. NHLBI, NIH. Citováno 2017-05-15.
- ^ Tomkinson AE, Howes TR, Wiest NE (červen 2013). „DNA ligázy jako terapeutické cíle“. Translační výzkum rakoviny. 2 (3). PMC 3819426. PMID 24224145.
externí odkazy
- DNA ligáza: molekula měsíce PDB
- Davidson College Obecné informace o Ligase
- OpenWetWare DNA ligační protokol
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P00970 (DNA ligáza) na PDBe-KB.
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P18858 (DNA ligáza 1) na PDBe-KB.
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P49916 (DNA ligáza 3) na PDBe-KB.
