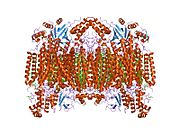
Cytochrom c oxidáza podjednotka I - Cytochrome c oxidase subunit I
| Cytochrom c oxidáza podjednotka I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura 13 podjednotky oxidované cytochrom c oxidázy.[4] | |||||||||
| Identifikátory | |||||||||
| Symbol | COX1 nebo COI | ||||||||
| Pfam | PF00115 | ||||||||
| InterPro | IPR000883 | ||||||||
| STRÁNKA | PDOC00074 | ||||||||
| SCOP2 | 1occ / Rozsah / SUPFAM | ||||||||
| TCDB | 3.D.4 | ||||||||
| OPM nadčeleď | 4 | ||||||||
| OPM protein | 1v55 | ||||||||
| CDD | cd01663 | ||||||||
| |||||||||

Cytochrom c oxidáza I (COX1) také známý jako mitochondriálně kódovaná cytochrom c oxidáza I (MT-CO1) je protein že u lidí je kódován MT-CO1 gen.[5] V jiných eukaryoty, gen se nazývá COX1, CO1nebo COI.[6] Cytochrom c oxidáza I je hlavní podjednotkou cytochrom c oxidáza komplex. Byly spojeny mutace v MT-CO1 Leberova dědičná optická neuropatie (LHON), získaný idiopatické sideroblastická anémie, Komplex IV nedostatek, kolorektální karcinom, senzorineurální hluchota a opakující se myoglobinurie.[7][8][9]
Struktura
Jeden z 37 mitochondriálních genů, MT-CO1 Gen je lokalizován z nukleotidových párů 5904 až 7444 na guanin - bohatá těžká (H) část mtDNA. Genovým produktem je 57 kDa protein složený z 513 aminokyseliny.[10][11]
Funkce
Cytochrom c oxidáza podjednotka I (CO1 nebo MT-CO1) je jednou ze tří mitochondriální DNA (mtDNA) kódované podjednotky (MT-CO1, MT-CO2, MT-CO3 ) z dýchací komplex IV. Komplex IV je třetím a posledním enzymem elektronový transportní řetězec mitochondrií oxidační fosforylace.[5]
Cytochrom c oxidáza (ES 1.9.3.1 ) je klíčovým enzymem v aerobním metabolismu. Protonové pumpy hem-měď oxidázy představují terminální enzymy přenosu energie dýchacích řetězců prokaryoty a eukaryoty. CuB-hem hem3 (nebo hem o) dvoujaderné centrum, spojené s největší podjednotkou I cytochromu c a ubichinol oxidázy (ES 1.10.3.10 ), je přímo zapojen do vazby mezi redukcí dioxygenů a čerpáním protonů.[12][13] Některé koncové oxidázy generují transmembránový protonový gradient přes plazmatickou membránu (prokaryoty) nebo mitochondriální vnitřní membránu (eukaryoty).
Enzymový komplex se skládá z 3-4 podjednotek (prokaryot) až 13 polypeptidů (savců), z nichž pouze katalytická podjednotka (ekvivalentní savčí podjednotce I (COI)) se nachází ve všech dýchacích oxidázách hem-měď. Přítomnost bimetalického centra (tvořeného vysokotočivým hemem a mědí B) i nízkootáčkového hemu, oba ligované do šesti konzervovaných histidinových zbytků poblíž vnější strany čtyř transmembránových polí v COI, je společná pro všechny členy rodiny .[14][15][16] Na rozdíl od eukaryot je dýchací řetězec prokaryot rozvětvený na více terminálních oxidáz. Enzymové komplexy se liší složením hemu a mědi, typem substrátu a afinitou substrátu. Různé respirační oxidázy umožňují buňkám přizpůsobit jejich dýchací systém podle různých podmínek růstu prostředí.[12]
Ukázalo se, že eubakteriální chinol oxidáza byla odvozena z cytochrom c oxidázy u grampozitivních bakterií a že archebakteriální chinol oxidáza má nezávislý původ. To naznačuje značné množství důkazů proteobakterie (Purpurové bakterie) získala chinol oxidázu postranním přenosem genu z Grampozitivní bakterie.[12]
Související reduktáza oxidu dusnatého (ES 1.7.99.7 ) existuje v denitrifikačních druzích archea a eubakterií a je heterodimerem cytochromů b a c. Fenazin methosulfát může působit jako akceptor. Bylo navrženo, že katalytické podjednotky cytochrom c oxidázy se vyvinuly ze starodávných reduktáz oxidu dusnatého, které by mohly redukovat jak dusík, tak kyslík.[17][18]
Klinický význam
Mutace v tomto genu jsou spojeny s Leberova dědičná optická neuropatie (LHON), získaný idiopatické sideroblastická anémie, Komplex IV nedostatek, kolorektální karcinom, senzorineurální hluchota a opakující se myoglobinurie.[7][8][9]
Leberova dědičná optická neuropatie (LHON)
LHON, korelovaný s mutacemi v MT-CO1, je charakterizováno dysfunkce zrakového nervu, způsobující subakutní nebo akutní centrální ztráta zraku. Někteří pacienti se mohou zobrazovat neurologický nebo srdeční vedení vady. Protože toto onemocnění je výsledkem mitochondriálních mutací DNA ovlivňujících komplexy dýchacích řetězců, to je zdědil mateřsky.[19][8][9]
Získaná idiopatická sideroblastická anémie
MT-CO1 se může podílet na rozvoji získané idiopatické sideroblastické anémie. Mutace v mitochondriální DNA mohou způsobit prevenci dysfunkce dýchacího řetězce snížení z železitý žehlička na železný železo, které je nutné pro poslední krok v mitochondriích biosyntéza z heme. Výsledkem je železitá akumulace v mitochondriích a nedostatečná produkce hemu.[20][21][8][9]
Nedostatek mitochondriálního komplexu IV (MT-C4D)
Mutace v tomto genu mohou způsobit nedostatek mitochondriálního komplexu IV, onemocnění mitochondriálního respiračního řetězce vykazující širokou škálu klinických projevů od izolovaných myopatie na závažné multisystémové onemocnění postihující více orgánů a tkání. Příznaky mohou zahrnovat dysfunkce jater a hepatomegalie, hypotonie, svalová slabost, nesnášenlivost cvičení, zpožděno vývoj motoru, mentální retardace, vývojové zpoždění, a Hypertrofické kardiomyopatie. U některých pacientů je hypertrofická kardiomyopatie fatální novorozenec etapa. Mohou se projevit i jiné postižené osoby Leighova choroba.[22][23][8][9]
Kolorektální karcinom (CRC)
MT-CO1 mutace hrají roli v kolorektálním karcinomu, což je velmi složité onemocnění zhoubný léze ve vnitřních stěnách dvojtečka a konečník. Četné takové genetické změny jsou často spojeny s progresí adenom nebo premaligní léze, na invazivní adenokarcinom. Dlouholetý ulcerózní kolitida, polypy tlustého střeva a rodinná anamnéza jsou rizikové faktory pro kolorektální karcinom.[24][25][8][9]
Recidivující myoglobinurie mitochondriální (RM-MT)
RM-MT je onemocnění charakterizované opakovanými záchvaty rhabdomyolýza (nekróza nebo rozpad kosterního svalu) spojené s bolestí a slabostí svalů, nesnášenlivostí cvičení, nízkou svalovou kapacitou pro oxidativní fosforylaci a následnou exkrecí myoglobin v moči. Je spojována s mitochondriální myopatií. Mutace G5920A a heteroplazmatická G6708A nesmyslná mutace byly spojeny s nedostatkem COX a RM-MT.[26][27][8][9]
Hluchota, senzorineurální, mitochondriální (DFNM)
DFNM je forma nesyndromová hluchota s mateřské dědictví. U postižených jedinců se projevuje progresivní, postlingvální, senzorineurální ztráta sluchu zahrnující vysoké frekvence. Mutace A1555G byla spojována s tímto onemocněním.[28][8][9]
Podskupiny
- Cytochrom c oxidáza cbb3 typu, podjednotka I InterPro: IPR004677
- Cytochrom o ubichinol oxidáza, podjednotka I InterPro: IPR014207
- Cytochrom aa3 chinol oxidáza, podjednotka I InterPro: IPR014233
- Cytochrom c oxidáza, bakteriální typ podjednotky I. InterPro: IPR014241
Použití při čárovém kódování DNA
MT-CO1 je gen, který se často používá jako a DNA čárový kód k identifikaci druhů zvířat. Sekvence genu MT-CO1 je pro tuto roli vhodná, protože je mutace rychlost je často dostatečně rychlá, aby rozlišovala blízce související druh a také proto, že jeho sekvence je mezi stejnými druhy zachována. Na rozdíl od primární námitky skeptiků, že rozdíly v sekvenci MT-CO1 jsou příliš malé na to, aby mohly být detekovány mezi blízce příbuznými druhy, je obvykle detekována více než 2% divergence sekvence mezi blízce příbuznými druhy zvířat,[29] což naznačuje, že čárový kód je účinný pro mnoho zvířat. Ve většině, ne-li všichni semenné rostliny, avšak rychlost vývoje MT-CO1 je velmi pomalá.
MT-COI (= CCOI) v tlustých kryptách

Protein MT-COI, známý také jako CCOI, je obvykle exprimován na vysoké úrovni cytoplazma z tlusté krypty člověka tlusté střevo (dvojtečka). MT-COI se však často ztrácí v kryptách tlustého střeva s věkem u lidí a také často chybí v defektech pole, které způsobují rakovinu tlustého střeva, stejně jako v částech rakoviny tlustého střeva.[30]
The epiteliální vnitřní povrch tlustého střeva je přerušován invaginacemi, tlustými kryptami. Krypty tlustého střeva mají tvar mikroskopických silnostěnných zkumavek se středovým otvorem po celé délce zkumavky (krypta lumen ). Na obrázku v této části jsou zobrazeny čtyři tkáňové řezy, dva řezy podél dlouhých os krypt a dva řezy rovnoběžně s dlouhými osami.
Většina krypt lidské tlustého střeva na obrázcích má vysokou expresi hnědé oranžové barvy MT-COI. V některých kryptách tlustého střeva však všechny buňky postrádají MT-COI a vypadají většinou bílé, přičemž jejich hlavní barvou je modrošedé zabarvení jader na vnějších stěnách krypt. Greaves a kol.[31] ukázaly, že nedostatky MT-COI v kryptách tlustého střeva jsou způsobeny mutacemi v genu MT-COI. Jak je vidět v panelu B, zdá se, že část kmenových buněk tří krypt má mutaci v MT-COI, takže 40% až 50% buněk pocházejících z těchto kmenových buněk tvoří v příčném řezu bílý segment .
U lidí je procento krypt tlustého střeva s deficitem MT-COI před 40 rokem méně než 1%, ale s věkem se lineárně zvyšuje.[30] V průměru procento krypt tlustého střeva s deficitem MT-COI dosahuje ve věku 80–84 let 18% u žen a 23% u mužů.[30] Nádory tlustého střeva často vznikají v oblasti krypt obsahujících velký shluk (až 410) krypt s deficitem MT-COI. U rakoviny tlustého střeva může mít až 80% nádorových buněk deficit MT-COI.[30]
Jak je vidět na panelech C a D, krypty jsou dlouhé asi 75 až asi 110 buněk. Průměrný obvod krypty je 23 buněk.[32] Na základě těchto měření mají krypty mezi 1725 a 2530 buňkami. Další zpráva poskytla rozsah 1 500 až 4 900 buněk na kryptiku tlustého střeva.[33]
Výskyt častých krypt s téměř úplnou ztrátou MT-COI v jejich 1700 až 5 000 buňkách naznačuje proces přirozeného výběru. Ukázalo se však také, že k deficitu v konkrétní kryptě v důsledku počáteční mutace mitochondriální DNA může občas dojít stochastickým procesem.[34][35] Nicméně častý výskyt deficitu MT-COI u mnoha krypt v epitelu tlustého střeva naznačuje, že absence MT-COI pravděpodobně poskytuje selektivní výhodu.
MT-COI je kódován pro mitochondriální chromozom. Ve většině mitochondrií existuje více kopií chromozomu, obvykle mezi 2 a 6 na mitochondrii.[36][37][38] Pokud dojde k mutaci v MT-COI v jednom chromozomu mitochondrie, může dojít k náhodné segregaci chromozomů během mitochondriální štěpení generovat nové mitochondrie. To může vést k vzniku mitochondrie s primárně nebo výhradně s chromozomy mutovanými MT-COI.
Mitochondrie s převážně chromozomy mutovanými MT-COI by musela mít pozitivní zkreslení výběru aby se často stal hlavním typem mitochondrií v buňce (buňka s nedostatkem MT-COI homoplazmy ). Na buňku je asi 100 až 700 mitochondrií, v závislosti na typu buňky.[37][38] Kromě toho dochází k poměrně rychlému obratu mitochondrií, takže mitochondrie s chromozomy s mutací MT-COI a zkreslení pozitivní selekce by se brzy mohly stát hlavním typem mitochondrií v buňce. Průměrný poločas mitochondrií u potkanů je v závislosti na typu buňky mezi 9 a 24 dny,[39] a u myší je to asi 2 dny.[40] U lidí je pravděpodobné, že poločas mitochondrií je také otázkou dnů až týdnů.
Kmenová buňka na dně tlustého střeva, která byla z velké části s deficitem MT-COI, může soutěžit s ostatními 4 nebo 5 kmenovými buňkami o převzetí výklenku kmenových buněk. Pokud k tomu dojde, pak by krypta tlustého střeva měla deficit MT-COI ve všech 1700 až 5 000 buňkách, jak je uvedeno u některých krypt v panelech A, B a D obrazu.
Krypty tlustého střeva se mohou množit štěpením, jak je vidět na panelu C, kde krypta štěpí za vzniku dvou krypt, a na panelu B, kde se alespoň jedna krypta zdá být štěpná. Většina krypt s deficitem MT-COI je ve shlucích krypt (klonů krypt) se dvěma nebo více kryptami s deficitem MT-COI vedle sebe (viz panel D).[30] To ilustruje, že často vznikají klony deficitních krypt, a tedy že existuje pravděpodobně pozitivní selektivní zkreslení, které jim umožnilo šířit se v lidském tlustém epitelu.
Není jasné, proč by nedostatek MT-COI měl mít pozitivní selektivní zkreslení. Jeden návrh[30] je to, že nedostatek MT-COI v mitochondriích vede k nižší produkci reaktivního kyslíku (a menšímu oxidačnímu poškození) a to poskytuje selektivní výhodu v soutěži s jinými mitochondriemi ve stejné buňce, aby se vytvořila homoplazmie pro nedostatek MT-COI. Dalším návrhem bylo, že buňky s nedostatkem cytochrom c oxidázy jsou rezistentní na apoptózu, a proto s větší pravděpodobností přežijí. Vazba MT-COI na apoptózu vzniká, protože aktivní cytochrom c oxidáza oxiduje cytochrom c, který pak aktivuje prokaspázu 9, což vede k apoptóze.[41] Tyto dva faktory mohou přispívat k častému výskytu krypt tlustého střeva s deficitem MT-COI s věkem nebo během karcinogeneze v lidském tlustém střevě.
Interakce
V rámci MITRAC (mitochondriální translační regulační montážní meziprodukt cytochrom c oxidázy) komplex kódovaný protein interaguje s COA3 a SMIM20 /7. díl MITRAC. Tato interakce s SMIM20 stabilizuje nově syntetizovaný MT-CO1 a zabraňuje jeho předčasnému obrat.[42] Kromě toho interaguje s TMEM177 v COX20 -závislým způsobem.[43][8][9]
Reference
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000064351 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S (květen 1996). „Celá struktura 13 podjednotky oxidovala cytochrom c oxidázu při 2,8 A“. Věda. 272 (5265): 1136–44. Bibcode:1996Sci ... 272.1136T. doi:10.1126 / science.272.5265.1136. PMID 8638158. S2CID 20860573.
- ^ A b „Entrez Gene: Cytochrome c oxidase subunit I“.
- ^ Kosakyan A, Heger TJ, Leander BS, Todorov M, Mitchell EA, Lara E (květen 2012). „Čárové kódy COI u améb testate Nebelid (Amoebozoa: Arcellinida): rozsáhlá kryptická rozmanitost a nové vymezení druhu Hyalospheniidae Schultze“ (PDF). Protist. 163 (3): 415–34. doi:10.1016 / j.protis.2011.10.003. PMID 22130576.
- ^ A b Online Mendelian Inheritance in Man (OMIM): 516030
- ^ A b C d E F G h i „MT-CO1 - podjednotka cytochrom c oxidázy 1 - Homo sapiens (člověk) - gen a protein MT-CO1“. www.uniprot.org. Citováno 2018-08-13.
 Tento článek včlení text dostupný pod CC BY 4.0 licence.
Tento článek včlení text dostupný pod CC BY 4.0 licence. - ^ A b C d E F G h i „UniProt: univerzální znalostní databáze proteinů“. Výzkum nukleových kyselin. 45 (D1): D158 – D169. Ledna 2017. doi:10.1093 / nar / gkw1099. PMC 5210571. PMID 27899622.
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J , Duan H, Uhlen M, Yates JR, Apweiler R, Ge J, Hermjakob H, Ping P (říjen 2013). „Integrace biologie a medicíny srdečních proteomů pomocí specializované znalostní databáze“. Výzkum oběhu. 113 (9): 1043–53. doi:10.1161 / CIRCRESAHA.113.301151. PMC 4076475. PMID 23965338.
- ^ „MT-CO1 - cytochrom c oxidáza podjednotka 1“. Srdeční organelární proteinová atlasová znalostní databáze (COPaKB).[trvalý mrtvý odkaz ]
- ^ A b C García-Horsman JA, Barquera B, Rumbley J, Ma J, Gennis RB (září 1994). "Nadčeleď hem-měďových respiračních oxidáz". Journal of Bacteriology. 176 (18): 5587–600. doi:10.1128 / jb.176.18.5587-5600.1994. PMC 196760. PMID 8083153.
- ^ Papa S, Capitanio N, Glaser P, Villani G (květen 1994). "Protonová pumpa hem-měď oxidáz". Cell Biology International. 18 (5): 345–55. doi:10.1006 / cbir.1994.1084. PMID 8049679. S2CID 36428993.
- ^ Castresana J, Lübben M, Saraste M, Higgins DG (červen 1994). „Vývoj cytochromoxidázy, enzymu staršího než atmosférický kyslík“. Časopis EMBO. 13 (11): 2516–25. doi:10.1002 / j.1460-2075.1994.tb06541.x. PMC 395125. PMID 8013452.
- ^ Capaldi RA, Malatesta F, Darley-Usmar VM (Červenec 1983). "Struktura cytochrom c oxidázy". Biochimica et Biophysica Acta (BBA) - Recenze na bioenergetiku. 726 (2): 135–48. doi:10.1016/0304-4173(83)90003-4. PMID 6307356.
- ^ Holm L, Saraste M, Wikström M (září 1987). „Strukturální modely redoxních center v cytochromoxidáze“. Časopis EMBO. 6 (9): 2819–23. doi:10.1002 / j.1460-2075.1987.tb02578.x. PMC 553708. PMID 2824194.
- ^ Saraste M, Castresana J (březen 1994). „Cytochromoxidáza se vyvinula šťouráním s denitrifikačními enzymy“. FEBS Dopisy. 341 (1): 1–4. doi:10.1016/0014-5793(94)80228-9. PMID 8137905. S2CID 1248917.
- ^ Chen J, Strous M (únor 2013). „Denitrifikace a aerobní dýchání, hybridní elektronové transportní řetězce a společná evoluce“. Biochimica et Biophysica Acta (BBA) - bioenergetika. 1827 (2): 136–44. doi:10.1016 / j.bbabio.2012.10.002. PMID 23044391.
- ^ Brown MD, Yang CC, Trounce I, Torroni A, Lott MT, Wallace DC (srpen 1992). „Varianta mitochondriální DNA identifikovaná u pacientů s dědičnou optickou neuropatií Leber, která rozšiřuje aminokyselinovou sekvenci podjednotky I cytochrom c oxidázy“. American Journal of Human Genetics. 51 (2): 378–85. PMC 1682694. PMID 1322638.
- ^ Gattermann N, Retzlaff S, Wang YL, Hofhaus G, Heinisch J, Aul C, Schneider W (prosinec 1997). „Heteroplazmatické bodové mutace mitochondriální DNA ovlivňující podjednotku I cytochrom c oxidázy u dvou pacientů se získanou idiopatickou sideroblastickou anémií“. Krev. 90 (12): 4961–72. doi:10,1182 / krev. V90.12.4961. PMID 9389715.
- ^ Bröker S, Meunier B, Rich P, Gattermann N, Hofhaus G (listopad 1998). „MtDNA mutace spojené se sideroblastickou anémií způsobují poruchu mitochondriální cytochrom c oxidázy“. European Journal of Biochemistry. 258 (1): 132–8. doi:10.1046 / j.1432-1327.1998.2580132.x. PMID 9851701.
- ^ Varlamov DA, Kudin AP, Vielhaber S, Schröder R, Sassen R, Becker A, Kunz D, Haug K, Rebstock J, Heils A, Elger CE, Kunz WS (srpen 2002). "Metabolické důsledky nové missense mutace genu mtDNA CO I". Lidská molekulární genetika. 11 (16): 1797–805. doi:10,1093 / hmg / 11.16.1797. PMID 12140182.
- ^ Lucioli S, Hoffmeier K, Carrozzo R, Tessa A, Ludwig B, Santorelli FM (březen 2006). „Představení nové lidské mutace mtDNA do genu COX I u Paracoccus denitrificans vysvětluje funkční deficity u pacienta“. Neurogenetika. 7 (1): 51–7. doi:10.1007 / s10048-005-0015-z. PMID 16284789. S2CID 21304246.
- ^ Greaves LC, Preston SL, Tadrous PJ, Taylor RW, Barron MJ, Oukrif D, Leedham SJ, Deheragoda M, Sasieni P, Novelli MR, Jankowski JA, Turnbull DM, Wright NA, McDonald SA (leden 2006). „Mitochondriální DNA mutace se usazují v lidských kmenových buňkách tlustého střeva a mutované klony expandují štěpením krypty“. Sborník Národní akademie věd Spojených států amerických. 103 (3): 714–9. Bibcode:2006PNAS..103..714G. doi:10.1073 / pnas.0505903103. PMC 1325106. PMID 16407113.
- ^ Namslauer I, Brzezinski P (březen 2009). „Mutace mitochondriální DNA spojená s rakovinou tlustého střeva vede k úniku protonů v cytochrom c oxidáze“. Sborník Národní akademie věd Spojených států amerických. 106 (9): 3402–7. Bibcode:2009PNAS..106.3402N. doi:10.1073 / pnas.0811450106. PMC 2651238. PMID 19218458.
- ^ Karadimas CL, Greenstein P, Sue CM, Joseph JT, Tanji K, Haller RG, Taivassalo T, Davidson MM, Shanske S, Bonilla E, DiMauro S (září 2000). „Opakovaná myoglobinurie způsobená nesmyslnou mutací v genu COX I mitochondriální DNA“. Neurologie. 55 (5): 644–9. doi:10.1212 / ml. 55.5.644. PMID 10980727. S2CID 26776388.
- ^ Kollberg G, Moslemi AR, Lindberg C, Holme E, Oldfors A (únor 2005). „Mitochondriální myopatie a rhabdomyolýza spojená s novou nesmyslnou mutací genu kódujícího cytochrom c oxidázovou podjednotku I“. Journal of Neuropathology and Experimental Neurology. 64 (2): 123–8. doi:10.1093 / jnen / 64.2.123. PMID 15751226.
- ^ Pandya A, Xia XJ, Erdenetungalag R, Amendola M, Landa B, Radnaabazar J, Dangaasuren B, Van Tuyle G, Nance WE (prosinec 1999). „Heterogenní bodové mutace v mitochondriálním prekurzoru tRNA Ser (UCN) koexistující s mutací A1555G u neslyšících studentů z Mongolska“. American Journal of Human Genetics. 65 (6): 1803–6. doi:10.1086/302658. PMC 1288397. PMID 10577941.
- ^ Hebert PD, Ratnasingham S, deWaard JR (srpen 2003). „Čárový kód života zvířat: divergence cytochrom c oxidázy podjednotky 1 mezi blízce příbuznými druhy“. Řízení. Biologické vědy. 270 Suppl 1: S96–9. doi:10.1098 / rsbl.2003.0025. PMC 1698023. PMID 12952648.
- ^ A b C d E F G Bernstein C, Facista A, Nguyen H, Zaitlin B, Hassounah N, Loustaunau C, Payne CM, Banerjee B, Goldschmid S, Tsikitis VL, Krouse R, Bernstein H (prosinec 2010). "Rakovina a věk související s defekty tlustého střeva v cytochrom c oxidase I". World Journal of Gastrointestinal Oncology. 2 (12): 429–42. doi:10.4251 / wjgo.v2.i12.429. PMC 3011097. PMID 21191537.
- ^ Greaves LC, Preston SL, Tadrous PJ, Taylor RW, Barron MJ, Oukrif D, Leedham SJ, Deheragoda M, Sasieni P, Novelli MR, Jankowski JA, Turnbull DM, Wright NA, McDonald SA (leden 2006). „Mitochondriální DNA mutace se usazují v lidských kmenových buňkách tlustého střeva a mutované klony expandují štěpením krypty“. Sborník Národní akademie věd Spojených států amerických. 103 (3): 714–9. Bibcode:2006PNAS..103..714G. doi:10.1073 / pnas.0505903103. PMC 1325106. PMID 16407113.
- ^ Baker AM, Cereser B, Melton S, Fletcher AG, Rodriguez-Justo M, Tadrous PJ, Humphries A, Elia G, McDonald SA, Wright NA, Simons BD, Jansen M, Graham TA (srpen 2014). „Kvantifikace vývoje krypty a kmenových buněk v normálním a neoplastickém lidském tlustém střevě“. Zprávy buněk. 8 (4): 940–7. doi:10.1016 / j.celrep.2014.07.019. PMC 4471679. PMID 25127143.
- ^ Nooteboom M, Johnson R, Taylor RW, Wright NA, Lightowlers RN, Kirkwood TB, Mathers JC, Turnbull DM, Greaves LC (únor 2010). „Mutace mitochondriální DNA spojené s věkem vedou k malým, ale významným změnám v buněčné proliferaci a apoptóze v lidských kryptách tlustého střeva“. Stárnoucí buňka. 9 (1): 96–9. doi:10.1111 / j.1474-9726.2009.00531.x. PMC 2816353. PMID 19878146.
- ^ Coller HA, Bodyak ND, Khrapko K (duben 2002). "Časté intracelulární klonální expanze somatických mutací mtDNA: význam a mechanismy". Annals of the New York Academy of Sciences. 959 (1): 434–47. Bibcode:2002NYASA.959..434C. doi:10.1111 / j.1749-6632.2002.tb02113.x. PMID 11976216.
- ^ Nekhaeva E, Bodyak ND, Kraytsberg Y, McGrath SB, Van Orsouw NJ, Pluzhnikov A, Wei JY, Vijg J, Khrapko K (duben 2002). „Klonálně rozšířené bodové mutace mtDNA jsou hojné v jednotlivých buňkách lidských tkání“. Sborník Národní akademie věd Spojených států amerických. 99 (8): 5521–6. Bibcode:2002PNAS ... 99.5521N. doi:10.1073 / pnas.072670199. PMC 122802. PMID 11943860.
- ^ Legros F, Malka F, Frachon P, Lombès A, Rojo M (červen 2004). „Organizace a dynamika lidské mitochondriální DNA“. Journal of Cell Science. 117 (Pt 13): 2653–62. doi:10.1242 / jcs.01134. PMID 15138283.
- ^ A b Robin ED, Wong R (září 1988). "Mitochondriální molekuly DNA a virtuální počet mitochondrií na buňku v buňkách savců". Journal of Cellular Physiology. 136 (3): 507–13. doi:10.1002 / jcp.1041360316. PMID 3170646.
- ^ A b Satoh M, Kuroiwa T (září 1991). "Organizace více nukleoidů a molekul DNA v mitochondriích lidské buňky". Experimentální výzkum buněk. 196 (1): 137–40. doi:10.1016/0014-4827(91)90467-9. PMID 1715276.
- ^ Menzies RA, Gold PH (duben 1971). "Obrat mitochondrií v různých tkáních mladých dospělých a starých krys". The Journal of Biological Chemistry. 246 (8): 2425–9. PMID 5553400.
- ^ Miwa S, Lawless C, von Zglinicki T (prosinec 2008). „Mitochondriální obrat v játrech je rychlý in vivo a je urychlován dietními omezeními: aplikace jednoduchého dynamického modelu“. Stárnoucí buňka. 7 (6): 920–3. doi:10.1111 / j.1474-9726.2008.00426.x. PMC 2659384. PMID 18691181.
- ^ Brown GC, Borutaite V (2008). „Regulace apoptózy redoxním stavem cytochromu c“. Biochimica et Biophysica Acta (BBA) - bioenergetika. 1777 (7–8): 877–81. doi:10.1016 / j.bbabio.2008.03.024. PMID 18439415.
- ^ Dennerlein S, Oeljeklaus S, Jans D, Hellwig C, Bareth B, Jakobs S, Deckers M, Warscheid B, Rehling P (září 2015). „MITRAC7 působí jako chaperon specifický pro COX1 a odhaluje kontrolní bod během montáže cytochrom c oxidázy“. Zprávy buněk. 12 (10): 1644–55. doi:10.1016 / j.celrep.2015.08.009. PMID 26321642.
- ^ Lorenzi I, Oeljeklaus S, Aich A, Ronsör C, Callegari S, Dudek J, Warscheid B, Dennerlein S, Rehling P (únor 2018). „Mitochondriální TMEM177 se během biogeneze COX2 asociuje s COX20“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1865 (2): 323–333. doi:10.1016 / j.bbamcr.2017.11.010. PMC 5764226. PMID 29154948.
Další čtení
- Torroni A, Achilli A, Macaulay V, Richards M, Bandelt HJ (červen 2006). "Sklizeň plodů lidského stromu mtDNA". Trendy v genetice. 22 (6): 339–45. doi:10.1016 / j.tig.2006.04.001. PMID 16678300.
- Bodenteich A, Mitchell LG, Polymeropoulos MH, Merril CR (květen 1992). „Dinukleotidová repetice v lidské mitochondriální D-smyčce“. Lidská molekulární genetika. 1 (2): 140. doi:10,1093 / hmg / 1,2,140-a. PMID 1301157.
- Brown MD, Yang CC, Trounce I, Torroni A, Lott MT, Wallace DC (srpen 1992). „Varianta mitochondriální DNA identifikovaná u pacientů s dědičnou optickou neuropatií Leber, která rozšiřuje aminokyselinovou sekvenci podjednotky I cytochrom c oxidázy“. American Journal of Human Genetics. 51 (2): 378–85. PMC 1682694. PMID 1322638.
- Lu X, Walker T, MacManus JP, Seligy VL (červenec 1992). „Diferenciace lidských buněk HT-29 adenokarcinomu tlustého střeva koreluje se zvýšenou expresí mitochondriální RNA: účinky trehalózy na růst a zrání buněk“. Výzkum rakoviny. 52 (13): 3718–25. PMID 1377597.
- Marzuki S, Noer AS, Lertrit P, Thyagarajan D, Kapsa R, Utthanaphol P, Byrne E (prosinec 1991). „Normální varianty lidské mitochondriální DNA a translačních produktů: budování referenční databáze“. Genetika člověka. 88 (2): 139–45. doi:10.1007 / bf00206061. PMID 1757091. S2CID 28048453.
- Moraes CT, Andreetta F, Bonilla E, Shanske S, DiMauro S, Schon EA (březen 1991). „Replikačně kompetentní lidská mitochondriální DNA bez oblasti promotoru těžkých řetězců“. Molekulární a buněčná biologie. 11 (3): 1631–7. doi:10.1128 / MCB.11.3.1631. PMC 369459. PMID 1996112.
- Attardi G, Chomyn A, Doolittle RF, Mariottini P, Ragan CI (1987). "Sedm neidentifikovaných čtecích rámců lidské mitochondriální DNA kóduje podjednotky dýchacího řetězce NADH dehydrogenázy". Cold Spring Harbor Symposia o kvantitativní biologii. 51 (1): 103–14. doi:10,1101 / sqb.1986.051.01.013. PMID 3472707.
- Chomyn A, Cleeter MW, Ragan CI, Riley M, Doolittle RF, Attardi G (říjen 1986). "URF6, poslední neidentifikovaný čtecí rámec lidské mtDNA, kóduje podjednotku NADH dehydrogenázy". Věda. 234 (4776): 614–8. Bibcode:1986Sci ... 234..614C. doi:10.1126 / science.3764430. PMID 3764430.
- Chomyn A, Mariottini P, Cleeter MW, Ragan CI, Matsuno-Yagi A, Hatefi Y, Doolittle RF, Attardi G (1985). „Šest neidentifikovaných čtecích rámců lidské mitochondriální DNA kóduje složky NADH dehydrogenázy dýchacího řetězce“. Příroda. 314 (6012): 592–7. Bibcode:1985 Natur.314..592C. doi:10.1038 / 314592a0. PMID 3921850. S2CID 32964006.
- Sanger F, Coulson AR, Barrell BG, Smith AJ, Roe BA (říjen 1980). „Klonování v jednořetězcovém bakteriofágu jako pomůcka pro rychlé sekvenování DNA“. Journal of Molecular Biology. 143 (2): 161–78. doi:10.1016/0022-2836(80)90196-5. PMID 6260957.
- Montoya J, Ojala D, Attardi G (duben 1981). "Charakteristické rysy 5'-koncových sekvencí lidských mitochondriálních mRNA". Příroda. 290 (5806): 465–70. Bibcode:1981 Natur.290..465M. doi:10.1038 / 290465a0. PMID 7219535. S2CID 4358928.
- Horai S, Hayasaka K, Kondo R, Tsugane K, Takahata N (leden 1995). „Nedávný africký původ moderních lidí odhalen úplnými sekvencemi hominoidních mitochondriálních DNA“. Sborník Národní akademie věd Spojených států amerických. 92 (2): 532–6. Bibcode:1995PNAS ... 92..532H. doi:10.1073 / pnas.92.2.532. PMC 42775. PMID 7530363.
- Andrews RM, Kubacka I, Chinnery PF, Lightowlers RN, Turnbull DM, Howell N (říjen 1999). "Reanalysis a revize cambridgeské referenční sekvence pro lidskou mitochondriální DNA". Genetika přírody. 23 (2): 147. doi:10.1038/13779. PMID 10508508. S2CID 32212178.
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (prosinec 2000). „Variace mitochondriálního genomu a původ moderních lidí“. Příroda. 408 (6813): 708–13. Bibcode:2000Natur.408..708I. doi:10.1038/35047064. PMID 11130070. S2CID 52850476.
- Finnilä S, Lehtonen MS, Majamaa K (červen 2001). „Fylogenetická síť pro evropskou mtDNA“. American Journal of Human Genetics. 68 (6): 1475–84. doi:10.1086/320591. PMC 1226134. PMID 11349229.
- Maca-Meyer N, González AM, Larruga JM, Flores C, Cabrera VM (2003). „Hlavní genomové mitochondriální linie určují časné lidské expanze“. Genetika BMC. 2: 13. doi:10.1186/1471-2156-2-13. PMC 55343. PMID 11553319.
Tento článek včlení text z United States National Library of Medicine, který je v veřejná doména.