Raketoplán malát-aspartát - Malate-aspartate shuttle
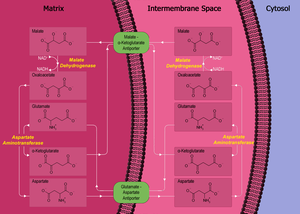
The malát-aspartát raketoplán (někdy jednoduše malátový raketoplán) je biochemický systém pro translokaci elektronů produkovaných během glykolýza přes polopropustný vnitřní membrána mitochondrie pro oxidační fosforylace v eukaryoty. Tyto elektrony vstupují do elektronový transportní řetězec mitochondrií prostřednictvím redukční ekvivalenty vygenerovat ATP. Kyvadlový systém je vyžadován, protože mitochondriální vnitřní membrána je nepropustný pro NADH, primární redukční ekvivalent transportního řetězce elektronů. Chcete-li to obejít, malát nese snižování ekvivalentů přes membránu.
Součásti
Raketoplán se skládá ze čtyř proteinových částí:
- malát dehydrogenáza v mitochondriální matici a mezimembránovém prostoru.
- aspartátaminotransferáza v mitochondriální matici a mezimembránovém prostoru.
- malát-alfa-ketoglutarátový antiporter ve vnitřní membráně.[1]
- antiporter glutamát-aspartát ve vnitřní membráně.[2]
Mechanismus
Primární enzym v malát-aspartátovém člunku je malát dehydrogenáza. Malát dehydrogenáza je v kyvadlovém systému přítomna ve dvou formách: mitochondriální malát dehydrogenáza a cytosolium malát dehydrogenáza. Tyto dvě malátdehydrogenázy se liší svým umístěním a strukturou a v tomto procesu katalyzují své reakce v opačných směrech.
Nejprve v cytosolu katalyzuje malátdehydrogenáza reakci oxaloacetát a NADH k výrobě malátu a NAD+. V tomto procesu dva elektrony generované z NADH a doprovodný H+, jsou připojeny k oxaloacetátu za vzniku malátu.
Jakmile se vytvoří malát, první antiporter (malát-alfa-ketoglutarát ) importuje malát z cytosolu do mitochondriální matrice a současně exportuje alfa-ketoglutarát z matrice do cytosolu. Poté, co malát dosáhne mitochondriální matrice, je přeměněn mitochondriální malát dehydrogenázou na oxaloacetát, během kterého NAD+ je redukován dvěma elektrony za vzniku NADH. Oxaloacetát se poté transformuje na aspartát (protože oxaloacetát nelze transportovat do cytosolu) mitochondriální aspartátaminotransferázou. Protože aspartát je aminokyselina, je třeba k oxaloacetátu přidat amino radikál. To je dodáváno glutamátem, který se v procesu transformuje na alfa-ketoglutarát stejným enzymem.
Druhý antiporter ( glutamát-aspartátový antiporter ) importuje glutamát z cytosolu do matrice a exportuje aspartát z matrice do cytosolu. Jakmile je v cytosolu, je aspartát přeměněn cytosolickou aspartátaminotransferázou na oxaloacetát.
Čistý účinek malát-aspartátového raketoplánu je čistě redox: NADH v cytosolu se oxiduje na NAD+a NAD+ v matici se sníží na NADH. NAD+ v cytosolu pak může být znovu redukován dalším cyklem glykolýzy a NADH v matrici lze použít k přenosu elektronů do řetězce transportu elektronů, takže lze syntetizovat ATP.
Vzhledem k tomu, že malát-aspartátový člun regeneruje NADH uvnitř mitochondriální matrice, je schopen maximalizovat počet ATP produkovaných při glykolýze (3 / NADH), což v konečném důsledku vede k čistému zisku 38 molekul ATP na molekulu metabolizované glukózy. Porovnejte to s glycerol 3-fosfátový člun, což snižuje FAD+ produkovat FADH2, daruje elektrony do chinonového fondu v elektronový transportní řetězec, a je schopen generovat pouze 2 ATP na NADH generovaný při glykolýze (což nakonec vede k čistému zisku 36 ATP na metabolizovanou glukózu). (Tato čísla ATP jsou prechemiosmotická a měla by být snížena s ohledem na práci Mitchella a mnoha dalších[Citace je zapotřebí ]. Každý NADH produkuje pouze 2,5 ATP a každý FADH2 produkuje pouze 1,5 ATP. Proto by měly být ATP na glukózu sníženy na 32 z 38 a 30 z 36. Další H+ požadované k zavedení anorganického fosfátu během oxidačně-fosforylace také přispívá k číslům 30 a 32).
Nařízení
Aktivita malát-aspartátového člunku je modulována methylací argininu malát dehydrogenáza 1 (MDH1). Protein arginin N-methyltransferáza CARM1 methyláty a inhibuje MDH1 narušením jeho dimerizace, která potlačuje malát-aspartátový člun a inhibuje mitochondriální dýchání z rakovina slinivky buňky.[3]
Interaktivní mapa cest
Kliknutím na geny, proteiny a metabolity níže můžete odkazovat na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „GlycolysisGluconeogenesis_WP534“.
Viz také
Reference
- ^ Lu, M; Zhou, L; Stanley, WC; Cabrera, ME; Saidel, GM; Yu, X (2008). "Role malát-aspartátového raketoplánu na metabolickou reakci na ischemii myokardu". J. Theor. Biol. 254: 466–75. doi:10.1016 / j.jtbi.2008.05.033. PMC 2572303. PMID 18603266.
- ^ Lu, M; Zhou, L; Stanley, WC; Cabrera, ME; Saidel, GM; Yu, X (2008). "Role malát-aspartátového raketoplánu na metabolickou reakci na ischemii myokardu". J. Theor. Biol. 254: 466–75. doi:10.1016 / j.jtbi.2008.05.033. PMC 2572303. PMID 18603266.
- ^ Wang YP, Zhou W, Wang J, Huang X, Zuo Y, Wang TS, Gao X, Xu YY, Zou SW, Liu YB, Cheng JK, Lei QY (listopad 2016). „Arginin methylace MDH1 pomocí CARM1 inhibuje metabolismus glutaminu a potlačuje rakovinu pankreatu“. Molekulární buňka. 64 (4): 673–87. doi:10.1016 / j.molcel.2016.09.028. PMID 27840030.
- Monty Krieger; Matthew P Scott; Matsudaira, Paul T .; Lodish, Harvey F .; Darnell, James E .; Lawrence Zipursky; Kaiser, Chris; Arnold Berk. Molecular Cell Biology, páté vydání. San Francisco: W. H. Freeman. ISBN 0-7167-4366-3.

