Kolorektální polyp - Colorectal polyp
| Polypy tlustého střeva | |
|---|---|
 | |
| Polyp sigmoidního tračníku odhalený kolonoskopií. Průměr přibližně 1 cm. Polyp byl odstraněn pomocí lékárna. | |
| Specialita | Gastroenterologie |
A kolorektální polyp je polyp (masitý růst) vyskytující se na podšívce dvojtečka nebo konečník.[1] Neošetřené kolorektální polypy se mohou vyvinout kolorektální karcinom.[2]
Kolorektální polypy jsou často klasifikovány podle jejich chování (tj. Benigní vs. maligní) nebo podle příčiny (např. Jako důsledek zánětlivé onemocnění střev ). Mohou být benigní (např. Hyperplastický polyp), před maligní (např. tubulární adenom ) nebo maligní (např. kolorektální adenokarcinom).
Příznaky a symptomy
Kolorektální polypy nejsou obvykle spojeny s příznaky.[2] Když k nim dojde, příznaky zahrnují krvavé stolice; změny frekvence nebo konzistence stolice (například týden nebo více z zácpa nebo průjem );[3] a únava vyplývající ze ztráty krve.[2] Anémie vyplývající z nedostatek železa se mohou také projevit v důsledku chronické ztráty krve, a to i při absenci krvavé stolice.[3][4] Dalším příznakem může být zvýšená produkce hlenu, zejména těch, které zahrnují vilózní adenomy.[4] Bohatá tvorba sliznic způsobuje ztrátu draslíku, která může příležitostně vést k symptomatické hypokalémii.[4] Občas, pokud je polyp dostatečně velký, aby způsobil a obstrukce střev, může být nevolnost, zvracení a těžká zácpa.[3]
Struktura
Polypy jsou buď stopkaté (připevněné ke stěně střeva stopkou), nebo přisedlé (rostou přímo ze stěny).[5][6]:1342 Kromě kategorizace hrubého vzhledu se dále dělí podle histologického vzhledu jako tubulární adenom, což jsou tubulární žlázy, vilózní adenom, který má na povrchu dlouhé prstové výstupky, a tubulovilózní adenom, který má vlastnosti obou.[6]:1342
Genetika
Mezi dědičné syndromy způsobující zvýšenou tvorbu kolorektálních polypů patří:
- Familiární adenomatózní polypóza (FAP)
- Dědičná nepolypózní kolorektální rakovina
- Peutz – Jeghersův syndrom
- Syndrom juvenilní polypózy
Několik genů bylo spojeno s polypózou, jako např GREM1, MSH3, MLH3, NTHL1, RNF43 a RPS20.[7]
Familiární adenomatózní polypóza
Familiární adenomatózní polypóza (FAP) je forma syndromu dědičné rakoviny zahrnující gen APC lokalizovaný na chromozomu q521.[8] Syndrom poprvé popsal v roce 1863 Virchow na 15letém chlapci s více polypy v tlustém střevě.[8] Tento syndrom zahrnuje vývoj více polypů v raném věku a u těch, kteří se neléčí, se nakonec vyvine rakovina.[8] Gen je 100% exprimován u osob s mutací a je autosomálně dominantní.[8] 10% až 20% pacientů má negativní rodinnou anamnézu a syndrom získávají spontánní mutací zárodečné linie.[8] Průměrný věk nově diagnostikovaného pacienta je 29 let a průměrný věk nově objeveného kolorektálního karcinomu je 39 let.[8] Doporučuje se, aby postižení podstoupili screening kolorektálního karcinomu v mladším věku s léčbou a prevencí, aby byli chirurgičtí s odstraněním postižených tkání.[8]
Dědičná nepolypózní kolorektální rakovina (Lynchův syndrom)
Dědičná nepolypózní kolorektální rakovina (HNPCC, také známý jako Lynchův syndrom) je dědičný syndrom kolorektálního karcinomu.[8] Jedná se o nejběžnější dědičnou formu kolorektálního karcinomu ve Spojených státech a představuje asi 3% všech případů rakoviny.[8] Poprvé to uznal olše S. Warthin v roce 1885 na University of Michigan.[8] Později to dále studoval Henry Lynch, který rozpoznal autosomálně dominantní transmisní vzorec u postižených s relativně časným nástupem rakoviny (průměrný věk 44 let), větší výskyt proximálních lézí, většinou mucinózní nebo špatně diferencovaný adenokarcinom, větší počet synchronních a metachronních rakovinové buňky a dobrý výsledek po chirurgickém zákroku.[8] K definici Lynchova syndromu byla původně použita amsterdamská kritéria, než byl vypracován základní genetický mechanismus.[8] Kritéria požadovala, aby měl pacient tři členy rodiny, všechny příbuzné prvního stupně s kolorektálním karcinomem, které zahrnují nejméně dvě generace, přičemž nejméně jedna postižená osoba byla v době stanovení diagnózy mladší než 50 let.[8] Amsterdamská kritéria jsou příliš restriktivní a byla později rozšířena o rakoviny endometria, vaječníků, žaludku, pankreatu, tenkého střeva, močovodu a ledviny.[8] Zvýšené riziko rakoviny pozorované u pacientů se syndromem je spojeno s dysfunkcí mechanismu opravy DNA.[8] Molekulární biologové spojili syndrom se specifickými geny, jako jsou hMSH2, hMSH1, hMSH6 a hPMS2.[8]
Peutz – Jeghersův syndrom
Peutz – Jeghersův syndrom je autosomálně dominantní syndrom, který se projevuje u hamartomatózních polypů, což je dezorganizovaný růst tkání zažívacího traktu a hyperpigmentace v ústech, rtech a prstech.[8] Syndrom byl poprvé zaznamenán v roce 1896 Hutchinsonem a později samostatně popsán Peutzem a poté znovu v roce 1940 Jeghersem.[8] Tento syndrom je spojen s nesprávnou funkcí genu serin-threoninkinázy 11 nebo STK 11 a má 2% až 10% zvýšení rizika vzniku rakoviny střevního traktu.[8] Syndrom také způsobuje zvýšené riziko extraintestinálního karcinomu, jako je například rakovina prsu, vaječníků, děložního čípku, vejcovodů, štítné žlázy, plic, žlučníku, žlučovodů, pankreatu a varlat.[8] Polypy často krvácejí a mohou způsobit obstrukci, která by vyžadovala chirurgický zákrok.[8] Jakékoli polypy větší než 1,5 cm je třeba odstranit a pacienti by měli být pečlivě sledováni a každé 2 roky vyšetřováni na malignitu.[8]
Syndrom juvenilní polypózy
Syndrom juvenilní polypózy je autosomálně dominantní syndrom charakterizovaný zvýšeným rizikem rakoviny střevního traktu a extraintestinálního karcinomu.[8] Často se projevuje krvácením a obstrukcí střevního traktu spolu s nízkým obsahem sérového albuminu v důsledku ztráty bílkovin ve střevě.[8] Tento syndrom je spojen s poruchou funkce SMAD4 genu pro potlačení nádoru, který je pozorován v 50% případů.[8] Jedinci s mnohočetnými juvenilními polypy mají nejméně 10% pravděpodobnost vzniku malignity a měli by podstoupit břišní kolektomii s ileorektální anastomózou a pečlivým sledováním pomocí endoskopie konečníku.[8] U jedinců s několika juvenilními polypy by pacienti měli podstoupit endoskopickou polypektomii.[8]
Typy

Kolorektální polypy lze obecně klasifikovat následovně:
- hyperplastické,
- neoplastické (adenomatózní a maligní),
- hamartomatous a,
- zánětlivé.
Srovnávací tabulka
| Typ | Riziko obsahující maligní buňky | Histopatologie | obraz | |
|---|---|---|---|---|
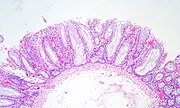
| Hyperplastický polyp | 0% | Žádná dysplázie.[9]
| 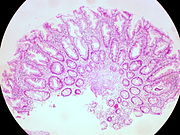 | |
| Tubulární adenom | 2% na 1,5 cm[11] | Dysplázie nízkého až vysokého stupně[12] | Více než 75% objemu má tubulární vzhled.[13] |  |
| Tubulovilózní adenom | 20% na 25%[14] | 25% -75% podlý[13] | 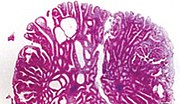 | |
| Villous adenom | 15%[15] na 40%[14] | Více než 75% hnusný[13] | 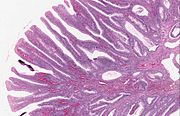 | |
| Přisedlý zoubkovaný adenom (SSA)[16] |
|  | ||
| Kolorektální adenokarcinom | 100% |
| 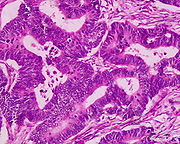 | |
Hyperplastický polyp
Většina hyperplastických polypů se nachází v distální dvojtečka a konečník.[17] Nemají žádný zhoubný potenciál,[17] což znamená, že není pravděpodobnější, že se z rakoviny nakonec stane normální tkáň.
Hyperplastické polypy na pravé straně tlustého střeva vykazují maligní potenciál. K tomu dochází prostřednictvím několika mutací, které ovlivňují cesty opravy DNA nesouladem a opravou. V důsledku toho nejsou opraveny mutace DNA během replikace. Tohle vede k nestabilita mikrosatelitu, což může nakonec vést k maligní transformaci polypů na pravé straně tlustého střeva.[Citace je zapotřebí ]
Neoplastický polyp
A novotvar je tkáň, jejíž buňky ztratily normální stav diferenciace. Mohou to být buď benigní výrůstky, nebo zhoubné výrůstky. Maligní výrůstky mohou mít primární nebo sekundární příčiny. Adenomatózní polypy jsou považovány za prekurzory rakoviny a rakovina se stává invazivní, jakmile maligní buňky procházejí sliznicí muscularis a napadají buňky níže.[8] Jakékoli buněčné změny pozorované nad lamina propria jsou považovány za neinvazivní a jsou označeny jako atypie nebo dysplázie. Jakýkoli invazivní karcinom, který pronikl do muscularis mocos, má potenciál pro metastázy v lymfatických uzlinách a lokální recidivu, což vyžaduje agresivnější a rozsáhlejší resekci.[8] Haggittova kritéria se používají pro klasifikaci polypů obsahujících rakovinu a jsou založena na hloubce penetrace.[8] Haggittova kritéria mají úroveň 0 až úroveň 4, přičemž všechny invazivní karcinomy variant sedících polypů jsou podle definice klasifikovány jako úroveň 4.[8]
- Úroveň 0: Rakovina neproniká sliznicí muscularis.[8]
- Úroveň 1: Rakovina proniká přes sliznici muscularis a napadá submukózu níže, ale je omezena na hlavu polypu.[8]
- Úroveň 2: Rakovina proniká skrz postižení krku polypu.[8]
- Úroveň 3: Rakovina proniká skrz zásah všech částí stonku.[8]
- Úroveň 4: Rakovina napadá submukózu pod stonkou polypu, ale nad muscularis propria stěny střeva.[8]
Adenomy
Neoplastické polypy střevo jsou často benigní, proto se nazývají adenomy. Adenom je nádor žlázové tkáně, který (dosud) nezískal vlastnosti rakoviny.[Citace je zapotřebí ]
Společné adenomy tlustého střeva (kolorektální adenom ) jsou trubkovitý, tubulovillous, odporný, a přisedlé zoubkované (SSA).[17] Velká většina (65% až 80%) je benigního tubulárního typu, přičemž 10% až 25% je tubulovilózních a klků je nejvzácnějších u 5% až 10%.[8]
Jak je patrné z jejich názvu, přisedlé zoubkované a tradiční zoubkované adenomy (TSA) mají zoubkovaný vzhled a je obtížné je mikroskopicky odlišit od hyperplastických polypů.[17] Toto rozlišení je však důležité, protože SSA a TSA mají potenciál stát se rakovinou,[18] zatímco hyperplastické polypy ne.[17]
Vilózní dělení je spojeno s nejvyšším maligním potenciálem, protože má obecně největší plochu. (Je to proto, že klky jsou výstupky do lumenu, a proto mají větší povrch.) Avšak vilózní adenomy nejsou pravděpodobnější než tubulární nebo tubulovilózní adenomy, pokud budou mít stejnou velikost.[17]
Hamartomatózní polyp
Hamartomatózní polypy jsou nádory, jako výrůstky nalezené v orgánech v důsledku chybného vývoje. Obvykle jsou tvořeny směsí tkání. Obsahují hlenem naplněné žlázy s retenčními cystami, bohatou pojivovou tkání a chronickou buněčnou infiltrací eosinofilů.[19] Rostou normální rychlostí hostitelské tkáně a zřídka způsobují problémy, jako je komprese. Běžným příkladem hamartomatózní léze je a jahodový naevus. Hamartomatózní polypy se často vyskytují náhodou; vyskytující se u syndromů, jako je Peutz – Jegherův syndrom nebo syndrom juvenilní polypózy.
Peutz – Jeghersův syndrom je spojován s polypy GI traktu a také se zvýšenou pigmentací kolem rtů, genitálií, bukální sliznice nohou a rukou. Lidé jsou často diagnostikováni s Peutz-Jegherem po projevu intususcepce ve věku kolem 9 let. Samotné polypy mají malý maligní potenciál, ale kvůli potenciálním koexistujícím adenomům existuje 15% šance na malignitu tlustého střeva.
Juvenilní polypy jsou hamartomatózní polypy, které se často projeví před dvaceti lety, ale lze je pozorovat i u dospělých. Obvykle se jedná o osamělé polypy nacházející se v konečník které se nejčastěji projevují rektálním krvácením. Syndrom juvenilní polypózy je charakterizován přítomností více než pěti polypů v tlustém střevě nebo konečníku nebo mnoha juvenilních polypů v celém gastrointestinální trakt nebo jakýkoli počet juvenilních polypů u jakékoli osoby s rodinnou anamnézou juvenilní polypózy. Lidé s juvenilní polypózou mají zvýšené riziko rakoviny tlustého střeva.[18]
Zánětlivý polyp
Jedná se o polypy, které jsou spojeny se zánětlivými stavy, jako je ulcerózní kolitida a Crohnova nemoc.[Citace je zapotřebí ]
Diagnóza
Kolorektální polypy lze detekovat pomocí a okultní krev ve výkalech test, flexibilní sigmoidoskopie, kolonoskopie, virtuální kolonoskopie, digitální rektální vyšetření, klystýr barnatý nebo a tabletová kamera.[3][ověření se nezdařilo ]
Maligní potenciál je spojen s
- stupeň dysplázie
- Typ polypu (např. vilózní adenom ):
- Tubulární adenom: 5% riziko rakoviny
- Tubulovilózní adenom: 20% riziko rakoviny
- Villous adenoma: 40% riziko rakoviny
- Velikost polypu:
Obvykle se léčí adenom, který je větší než 0,5 cm.
Galerie

Mikrovezikulární hyperplastický polyp. H&E skvrna.

Mikrovezikulární hyperplastický polyp. H&E skvrna.

Tradiční zoubkovaný adenom. H&E skvrna.

Hrubý vzhled a kolektomie vzorek obsahující dva kolorektální polypy a jeden invazivní kolorektální karcinom

Mikrograf a tubulární adenom, nejběžnější typ dysplastického polypu v tlustém střevě.
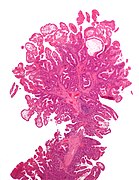
Mikrograf a Peutz – Jeghers tlustý polyp - druh hamartomatózního polypu. H&E skvrna.

Mikrograf a tubulární adenom – dysplastické epitel (tmavě fialový) na levé straně obrázku; normální epitel (modrý) vpravo. H&E skvrna.

Mikrograf a vilózní adenom. U těchto polypů se předpokládá vysoké riziko maligní transformace. H&E skvrna.

Pařížská klasifikace kolorektálních novotvarů.[21]
NICE klasifikace
v kolonoskopie, kolorektální polypy lze klasifikovat NICE (Úzkopásmové zobrazování Mezinárodní kolorektální endoskopie):[22]
| Typ 1 | Typ 2 | Typ 3 | |
|---|---|---|---|
| Barva | Stejné nebo lehčí než pozadí | Hnědší než pozadí | Hnědší nebo tmavší než pozadí, někdy nepravidelné bělejší oblasti |
| Plavidla | Žádné, nebo izolované krajkové cévy, které se pohybovaly po lézi | Hnědé nádoby obklopující bílé struktury | Oblast narušených nebo chybějících plavidel |
| Povrchový vzor | Homogenní nebo tmavé nebo bílé skvrny jednotné velikosti | Oválné, trubkovité nebo rozvětvené bílé struktury obklopené hnědými nádobami | Amorfní nebo chybějící povrchový vzor |
| S největší pravděpodobností patologie | Hyperplazie | Adenom | Hluboká submukózní invazivní rakovina |
| Léčba | Následovat | Slizniční nebo submukózní polypektomie | Chirurgický zákrok |
Prevence
Předpokládá se, že strava a životní styl hrají velkou roli v tom, zda se tvoří kolorektální polypy. Studie ukazují, že existuje ochranná souvislost mezi konzumací vařené zelené zeleniny, hnědé rýže, luštěnin a sušeného ovoce a sníženým výskytem kolorektálních polypů.[23]
Léčba
Polypy lze odstranit během a kolonoskopie nebo sigmoidoskopie pomocí drátěné smyčky, která odřízne stonek polypu a kauterizuje aby se zabránilo krvácení.[3][ověření se nezdařilo ] Mnoho „vzdorovitých“ polypů - velkých, plochých a jinak se šířících bočně adenomy —Může být odstraněn endoskopicky technikou zvanou endoskopická resekce sliznice (EMR), který zahrnuje injekci tekutiny pod lézi, aby se zvedla a tím se usnadnila endoskopická resekce. K vytvoření výtahu lze použít slanou vodu, i když některá injekční řešení, jako je SIC 8000, mohou být účinnější.[24] Minimálně invazivní chirurgický zákrok je indikován u polypů, které jsou příliš velké nebo na nepříznivých místech, jako je například slepé střevo, které nelze endoskopicky odstranit.[25] Tyto techniky mohou být použity jako alternativa k těm invazivnějším kolektomie.[26]
Reference
- ^ Marks, Jay W .; Anand, Bhupinder. „Polypy tlustého střeva: příznaky, příčiny, riziko rakoviny, léčba a prevence“. Centrum polypů tlustého střeva. MedicineNet. Citováno 18. ledna 2020.
- ^ A b C Phillips, Michael M .; Zieve, David; Conaway, Brenda (25. září 2019). "Kolorektální polypy". Lékařská encyklopedie. MedlinePlus. Citováno 18. ledna 2020.
- ^ A b C d E "Polypní polypy". Klinika Mayo. Mayo Foundation for Medical Education and Research. Citováno 18. ledna 2020.
- ^ A b C Quick CR, Reed JB, Harper SJ, Saeb-Parsy K, Burkitt HG (2014). Základní chirurgie: problémy, diagnostika a léčba. Edinburgh: Elsevier. ISBN 9780702054839. OCLC 842350865.[stránka potřebná ]
- ^ Classen, Meinhard; Tytgat, G.N.J .; Lightdale, Charles J. (2002). Gastroenterologická endoskopie. Thieme. p. 303. ISBN 1-58890-013-4.
- ^ A b Townsend CM, Beauchamp RD, Evers BM, Mattox KL, eds. (2015). E-kniha učebnice chirurgie Sabiston (19. vydání). Philadelphia, Pensylvánie: Elsevier Saunders. ISBN 978-1-4377-1560-6 - prostřednictvím Knih Google (náhled).
- ^ Valle L, de Voer RM, Goldberg Y, Sjursen W, Försti A, Ruiz-Ponte C, Caldés T, Garré P, Olsen MF, Nordling M, Castellvi-Bel S, Hemminmki K (říjen 2019). „Aktualizace genetické predispozice ke vzniku kolorektálního karcinomu a polypózy“. Molekulární aspekty medicíny. Elsevier. 69: 10–26. doi:10.1016 / j.mam.2019.03.001. PMID 30862463.
- ^ A b C d E F G h i j k l m n Ó str q r s t u proti w X y z aa ab ac inzerát ae af ag ah ai aj ak Najjia N. Mahmoud, Joshua I.S. Bleier, Cary B.Aarons, E. Carter Paulson, Skandan Shanmugan a Robert D. Fry (2017). Sabistonova učebnice chirurgie. Elsevier.CS1 maint: více jmen: seznam autorů (odkaz)[stránka potřebná ]
- ^ A b C Finlay A Macrae. "Přehled polypů tlustého střeva". UpToDate. Toto téma bylo naposledy aktualizováno: 10. prosince 2018.
- ^ A b C Robert V Rouse (01.01.2010). „Hyperplastický polyp tlustého střeva a konečníku“. Lékařská fakulta Stanfordské univerzity. Poslední aktualizace 2. 6. 2015
- ^ Minhhuyen Nguyen. „Polypy tlustého střeva a konečníku“. Příručka MSD. Poslední úplná kontrola / revize červen 2019
- ^ Robert V Rouse. "Adenom tlustého střeva a konečníku". Původní zveřejnění / poslední aktualizace: 1/31/10, 1/19/14
- ^ A b C Bosman, F. T. (2010). WHO klasifikace nádorů trávicího systému. Lyon: Mezinárodní agentura pro výzkum rakoviny. ISBN 978-92-832-2432-7. OCLC 688585784.CS1 maint: ref = harv (odkaz)
- ^ A b Amersi, Farin; Agustin, Michelle; Ko, Clifford Y (2005). „Rakovina tlustého střeva a konečníku: epidemiologie, rizikové faktory a zdravotní služby“. Kliniky chirurgie tlustého střeva a konečníku. 18 (3): 133–140. doi:10.1055 / s-2005-916274. ISSN 1531-0043. PMC 2780097. PMID 20011296.
- ^ Alnoor Ramji. „Sledování Villous Adenoma“. Medscape. Aktualizováno: 24. října 2016
- ^ Rosty, C; Hewett, D. G .; Brown, I. S .; Leggett, B. A .; Whitehall, V. L. (2013). „Zoubkované polypy tlustého střeva: současné chápání diagnózy, patogeneze a klinického managementu“. Journal of Gastroenterology. 48 (3): 287–302. doi:10.1007 / s00535-012-0720-r. PMC 3698429. PMID 23208018.
- ^ A b C d E F Kumar, Vinay (2010). „17 — Polypy“. Robbins a Cotran patologické základy nemoci (8. vydání). Philadelphia, PA: Saunders / Elsevier. ISBN 978-1-4160-3121-5.
- ^ A b Stoler, Mark A .; Mills, Stacey E .; Carter, Darryl; Joel K Greenson; Reuter, Victor E. (2009). Sternbergova diagnostická chirurgická patologie. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7942-5.[stránka potřebná ]
- ^ Calva, Daniel; Howe, James R (2008). „Syndromy hamartomatózní polypózy“. Chirurgické kliniky Severní Ameriky. 88 (4): 779–817, vii. doi:10.1016 / j.suc.2008.05.002. PMC 2659506. PMID 18672141.
- ^ A b C Summers, Ronald M (2010). „Měření velikosti polypů na kolonografii CT: Co víme a co potřebujeme vědět?“. Radiologie. 255 (3): 707–20. doi:10.1148 / radiol.10090877. PMC 2875919. PMID 20501711.
- ^ Luis Bujanda Fernández de Piérola, Joaquin Cubiella Fernández, Fernando Múgica Aguinaga, Lander Hijona Muruamendiaraz a Carol Julyssa Cobián Malaver (2013). „Maligní kolorektální polypy: diagnostika, léčba a prognóza“. Kolonoskopie a screening rakoviny tlustého střeva a konečníku: budoucí směry. doi:10.5772/52697. ISBN 9789535109495.CS1 maint: více jmen: seznam autorů (odkaz) Licence Creative Commons Attribution 3.0
- ^ Hattori, Santa (2014). „Úzkopásmové pozorování kolorektálních lézí pomocí klasifikace NICE, aby se zabránilo vyřazení významných lézí“. World Journal of Gastrointestinal Endoscopy. 6 (12): 600. doi:10,4253 / wjge.v6.i12.600. ISSN 1948-5190.
- ^ Tantamango, Yessenia M; Knutsen, Synnove F; Beeson, W. Lawrence; Fraser, Gary; Sabate, Joan (2011). „Potraviny a skupiny potravin spojené s výskytem kolorektálních polypů: Studie zdraví adventistů“. Výživa a rakovina. 63 (4): 565–72. doi:10.1080/01635581.2011.551988. PMC 3427008. PMID 21547850.
- ^ Hoff, RT; Lakha, A (1. února 2020). "Rektální tubulovilózní adenom". The Journal of the American Osteopathic Association. 120 (2): 121. doi:10,7556 / jaoa.2020.024. PMID 31985762.
- ^ [1], Fisichella M. Laparoskopická slepá resekce slepého střeva. J Med Ins. 2016; 2016 (207) doi:https://jomi.com/article/207
- ^ „How I Do It“ - Odstranění velkých nebo přisedlých polypů tlustého střeva. Archivováno 2008-04-11 na Wayback Machine Brian Saunders; Akademický institut svatého Marka; Harrow, Middlesex, Velká Británie. Získaný 9. dubna 2008.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |










