Hematopoetické kmenové buňky - Hematopoietic stem cell - Wikipedia
tento článek může být pro většinu čtenářů příliš technická na to, aby tomu rozuměli. (Srpna 2015) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| Hematopoetické kmenové buňky | |
|---|---|
 Přehled normální lidské hematopoézy | |
| Detaily | |
| Systém | Hematopoetický systém |
| Umístění | Kostní dřeň |
| Funkce | Kmenové buňky které dávají vzniknout dalším krvinky |
| Identifikátory | |
| latinský | Cellula haematopoietica praecursoria |
| Zkratka (y) | HSC |
| Pletivo | D006412 |
| TH | H2.00.01.0.00006 |
| Anatomické termíny mikroanatomie | |
Hematopoetické kmenové buňky (HSC) jsou kmenové buňky které dávají vzniknout dalším krvinky. Tento proces se nazývá krvetvorba.[1] K tomuto procesu dochází v červená kostní dřeň, v jádru většiny kostí. V embryonálním vývoji je červená kostní dřeň odvozena z vrstvy embryo volal mezoderm.
Krvetvorba je proces, při kterém se produkují všechny zralé krvinky. Musí vyvážit obrovské výrobní potřeby (průměrný člověk produkuje více než 500 miliard krvinek každý den) s potřebou regulovat počet jednotlivých typů krvinek v oběhu. U obratlovců se převážná většina hematopoézy vyskytuje v kostní dřeni a je odvozena z omezeného počtu hematopoetických kmenových buněk, které jsou multipotentní a schopné rozsáhlé sebeobnovy.
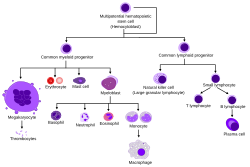
Hematopoetické kmenové buňky dávají vzniknout různým typům krvinek v tzv. Liniích myeloidní a lymfoidní. Myeloidní a lymfoidní linie se podílejí na tvorbě dendritických buněk. Myeloidní buňky zahrnují monocyty, makrofágy, neutrofily, bazofily, eosinofily, erytrocyty, a megakaryocyty na krevní destičky. Lymfoidní buňky zahrnují T buňky, B buňky, přirozené zabijácké buňky, a vrozené lymfoidní buňky. Definice hematopoetických kmenových buněk se vyvinula od jejich prvního objevení v roce 1961.[2] Krvotvorná tkáň obsahuje buňky s dlouhodobou a krátkodobou regenerační schopností a oddané multipotentní, oligopotentní, a unipotentní předci. Hematopoetické kmenové buňky tvoří 1: 10 000 buněk v myeloidní tkáň.
Transplantace HSC se používají při léčbě rakoviny a jiných poruch imunitního systému.[3]
Struktura
Jsou kulaté, nepřilnavé, se zaobleným jádrem a nízkým poměrem cytoplazmy k jádru. Tvarem se hematopoetické kmenové buňky podobají lymfocyty.
Umístění
Hematopoetické kmenové buňky se nacházejí v kostní dřeň dospělých, zejména v pánev, stehenní kost, a hrudní kost. Oni jsou také nalezeni v pupeční šňůra krev a v malém počtu i periferní krev.[4]
Kmenové a progenitorové buňky lze odebírat z pánve na kyčelním hřebenu pomocí jehly a stříkačky.[5] Buňky mohou být odstraněny jako kapalina (k provedení nátěru ke sledování morfologie buněk) nebo mohou být odstraněny pomocí biopsie jádra (pro zachování architektury nebo vztahu buněk k sobě navzájem a ke kosti).[Citace je zapotřebí ]
Podtypy
Jednotka tvořící kolonie je podtypem HSC. (Tento smysl termínu se liší od jednotky tvořící kolonie mikrobů, což je a počítání buněk Existuje řada druhů jednotek tvořících kolonie HSC:
- Jednotka tvořící kolonie -granulocyty -červená krvinka -monocyt -megakaryocyt (CFU-GEMM )
- Jednotka tvořící kolonie -lymfocyt (CFU-L )
- Jednotka tvořící kolonie -červená krvinka (CFU-E )
- Jednotka tvořící kolonie -granulocyty -makrofág (CFU-GM )
- Jednotka tvořící kolonie -megakaryocyt (CFU-Meg )
- Jednotka tvořící kolonie -bazofil (CFU-B)
- Jednotka tvořící kolonie -eosinofil (CFU-Eos )
Výše uvedené CFU jsou založeny na rodové linii. Další CFU, kolonie tvořící jednotka - slezina (CFU-S), byla základem in vivo tvorba klonálních kolonií, která závisí na schopnosti infundovaných buněk kostní dřeně po 8 až 12 dnech vést ke vzniku klonů dozrávajících hematopoetických buněk ve slezinách ozářených myší. To bylo používáno značně v raných studiích, ale nyní se považuje za měření zralejšího předka nebo buňky zesilující tranzit spíše než kmenové buňky[Citace je zapotřebí ].
Izolace kmenových buněk
Protože hemopoetické kmenové buňky nelze izolovat jako čistou populaci, není možné je identifikovat v mikroskopu.[Citace je zapotřebí ] Hematopoetické kmenové buňky lze identifikovat nebo izolovat pomocí průtoková cytometrie kde kombinace několika různých markerů buněčného povrchu (zejména CD34 ) se používají k oddělení vzácných krvetvorných kmenových buněk od okolních krevních buněk. Hematopoetické kmenové buňky postrádají expresi markerů zralých krevních buněk a proto se jim říká Lin-. Nedostatečná exprese markerů linie se používá v kombinaci s detekcí několika pozitivních markerů buněčného povrchu k izolaci hematopoetických kmenových buněk. Kromě toho jsou hematopoetické kmenové buňky charakterizovány svou malou velikostí a nízkým barvením vitálními barvivy, jako jsou rhodamin 123 (rhodamin hle) nebo Hoechst 33342 (vedlejší populace).
Funkce

Krvetvorba
Hematopoetické kmenové buňky jsou nezbytné pro hematopoézu, tvorbu buněk v krvi. Hematopoetické kmenové buňky mohou doplňovat všechny typy krvinek (tj. Jsou multipotentní ) a samoobnovení. Malý počet hematopoetických kmenových buněk se může rozšířit a generovat velmi velké množství dceřiných hematopoetických kmenových buněk. Tento jev se používá v transplantace kostní dřeně,[6] když malý počet hematopoetických kmenových buněk rekonstituuje hematopoetický systém. Tento proces naznačuje, že po transplantaci kostní dřeně musí dojít k symetrickému dělení buněk na dvě dceřiné hematopoetické kmenové buňky.
Předpokládá se, že k samoobnovení kmenových buněk dochází v výklenek kmenových buněk v kostní dřeni a je rozumné předpokládat, že klíčové signály přítomné v tomto výklenku budou důležité pro sebeobnovu.[1] Existuje velký zájem o environmentální a molekulární požadavky na samoobnovu HSC, protože pochopení schopnosti HSC doplňovat se nakonec umožní generování rozšířených populací HSC in vitro které lze použít terapeuticky.
Klid
Hematopoetické kmenové buňky, jako všechny dospělé kmenové buňky, většinou existují ve stavu klid nebo reverzibilní zastavení růstu. Změněný metabolismus klidových HCS pomáhá buňkám přežít po delší dobu v hypoxickém prostředí kostní dřeně.[7] Když jsou vyprovokovány buněčnou smrtí nebo poškozením, krvetvorné kmenové buňky opouštějí klid a znovu se aktivně dělí. Přechod z vegetačního klidu na rozmnožování a zpět reguluje Cesta MEK / ERK a Cesta PI3K / AKT / mTOR.[8] Dysregulace těchto přechodů může vést k vyčerpání kmenových buněk nebo k postupné ztrátě aktivních hematopoetických kmenových buněk v krevním systému.[8]
Mobilita
Hematopoetické kmenové buňky mají vyšší potenciál než jiné nezralé krevní buňky projít bariéra kostní dřeně, a tak může cestovat v krvi z kostní dřeně v jedné kosti do jiné kosti. Pokud se usadí v brzlík se mohou vyvinout T buňky. V případě plodů a dalších extramedulární hematopoéza „Hematopoetické kmenové buňky se mohou také usadit v játra nebo slezina a rozvíjet se.
To umožňuje, aby byly hematopoetické kmenové buňky odebírány přímo z krve.
Poškození DNA stárnutím
Přerušení řetězců DNA se během stárnutí hromadí v dlouhodobých hematopoetických kmenových buňkách.[9] Tato akumulace je spojena se širokým útlumem opravných a reakčních drah DNA, který závisí na klidovém stavu HSC.[9] Nehomologní spojování konců (NHEJ) je cesta, která opravuje dvouřetězcové zlomy v DNA. NHEJ se označuje jako „nehomologní“, protože zlomené konce jsou přímo ligovány bez potřeby homologního templátu. Dráha NHEJ závisí na několika proteinech včetně ligáza 4, DNA polymeráza mu a Faktor NHEJ 1 (NHEJ1, také známý jako Cernunnos nebo XLF).
DNA ligáza 4 (Lig4) má vysoce specifickou roli při opravě dvouřetězcových zlomů NHEJ. Nedostatek Lig4 u myši způsobuje postupnou ztrátu hematopoetických kmenových buněk během stárnutí.[10] Nedostatek lig4 v pluripotentních kmenových buňkách má za následek akumulaci dvouřetězcových zlomů DNA a zvýšenou apoptózu.[11]
U myší s mutantou polymerázy mu je vývoj hematopoetických buněk defektní v několika populacích periferních buněk a buněk kostní dřeně s přibližně 40% poklesem počtu buněk kostní dřeně, který zahrnuje několik hematopoetických linií.[12] Snižuje se také expanzní potenciál hematopoetických progenitorových buněk. Tyto vlastnosti korelují se sníženou schopností opravit dvouřetězcové zlomy v hematopoetické tkáni.
Nedostatek NHEJ faktoru 1 u myší vede k předčasnému stárnutí hematopoetických kmenových buněk, jak naznačuje několik řad důkazů, včetně důkazů, že dlouhodobá repopulace je defektní a časem se zhoršuje.[13] Použitím modelu pluripotentní kmenové buňky indukovaného nedostatkem NHEJ1 se ukázalo, že NHEJ1 má důležitou roli při podpoře přežití primitivních hematopoetických progenitorů.[14] Tyto buňky s nedostatkem NHEJ1 mají slabou schopnost opravy zprostředkovanou NHEJ1, která je zjevně neschopná vyrovnat se s poškozením DNA vyvolaným fyziologickým stresem, normálním metabolismem a ionizujícím zářením.[14]
Citlivost hematopoetických kmenových buněk na nedostatek Lig4, DNA polymerázy mu a NHEJ1 naznačuje, že NHEJ je klíčovým determinantem schopnosti kmenových buněk udržovat se v průběhu času proti fyziologickému stresu.[10] Rossi a kol.[15] zjistili, že endogenní poškození DNA se s věkem akumuluje i v divokých krvotvorných kmenových buňkách, a navrhli, že narůstající poškození DNA může být důležitým fyziologickým mechanismem stárnutí kmenových buněk.
Klinický význam
Transplantace
Transplantace hematopoetických kmenových buněk (HSCT) je transplantace multipotentní hematopoetické kmenové buňky, obvykle odvozené z kostní dřeně, periferní krve nebo pupečníkové krve.[16][17][18] Může to být autologní (používají se vlastní kmenové buňky pacienta), allogenní (kmenové buňky pocházejí od dárce) nebo syngenní (od identického dvojčete).[16][17]
Nejčastěji se provádí u pacientů s určitými rakoviny z krev nebo kostní dřeň, jako mnohočetný myelom nebo leukémie.[17] V těchto případech je imunitní systém příjemce před transplantací obvykle zničen radiací nebo chemoterapií. Infekce a nemoc štěpu proti hostiteli jsou hlavní komplikace allogenní HSCT.[17]
Za účelem odběru kmenových buněk z cirkulující periferní krve se dárcům krve injekčně podá a cytokin, jako je faktor stimulující kolonie granulocytů (G-CSF), který indukuje buňky, aby opustily kostní dřeň a cirkulovaly v cévách.[19]V embryologii savců jsou první definitivní hematopoetické kmenové buňky detekovány v AGM (aorta-gonad-mesonephros ), a poté masivně expandoval ve fetálních játrech před kolonizací kostní dřeně před narozením.[20]
Transplantace hematopoetických kmenových buněk zůstává nebezpečným postupem s mnoha možnými komplikacemi; je vyhrazen pro pacienty s život ohrožujícími chorobami. Jak se přežití po postupu zvýšilo, jeho použití se rozšířilo od rakoviny až k autoimunitní onemocnění[21][22] a dědičné kosterní dysplázie; zejména maligní infantilní osteopetróza[23][24] a mukopolysacharidóza.[25]
Výzkum
Chování v kultuře
A dlážděná oblast formující buňka (CAFC) test je empirický test založený na buněčné kultuře. Při nanesení na konfluentní kulturu stromálu podávací vrstva, zlomek hematopoetických kmenových buněk se plazí mezi mezerami (i když se stromální buňky navzájem dotýkají) a nakonec se usazují mezi stromálními buňkami a substrátem (zde povrch misky) nebo se zachycují v buněčných procesech mezi stromálními buňkami. Emperipolesis je in vivo jev, při kterém je jedna buňka zcela pohlcena jinou (např. thymocyty do thymické sesterské buňky ); na druhou stranu, když in vitro, buňky lymfoidní linie se plazí pod buňky podobné sestře, proces se nazývá pseudoemperipolesis. Tento podobný jev je v oboru HSC běžněji známý terminologií buněčných kultur buňky tvořící dlažební kámen (CAFC), což znamená, že oblasti nebo shluky buněk vypadají matně dlažební kamen - jako pod mikroskopem s fázovým kontrastem, ve srovnání s jinými hematopoetickými kmenovými buňkami, které jsou refrakční. Stává se to proto, že buňky, které volně plovou na stromálních buňkách, jsou sférické a tak refrakční. Buňky, které se plazí pod stromálními buňkami, jsou však zploštělé, a tedy refrakční. Mechanismus pseudoemperipolesis vychází na světlo teprve nedávno. Může to být zprostředkováno interakcí prostřednictvím CXCR4 (CD184) receptor pro CXC chemokiny (např. SDF1 ) a α4β1 integriny.[26]
Kinetika repopulace
Hematopoetické kmenové buňky (HSC) nelze snadno pozorovat přímo, a proto je třeba jejich chování odvodit nepřímo. Klonální studie jsou pravděpodobně nejbližší technikou pro jednobuněčné studie HSC in vivo. Zde se používají sofistikované experimentální a statistické metody k ujištění, že s vysokou pravděpodobností je v transplantaci podávané smrtelně ozářenému hostiteli obsažen jeden HSC. Klonální expanzi této kmenové buňky lze poté pozorovat v průběhu času sledováním procenta buněk dárcovského typu v krvi, když je hostitel rekonstituován. Výsledná časová řada je definována jako repopulační kinetika HSC.
Kinetika rekonstituce je velmi heterogenní. Nicméně pomocí symbolická dynamika lze ukázat, že spadají do omezeného počtu tříd.[27] To dokazuje několik set experimentální kinetiky repopulace z klonální Thy-1hle SCA-1+ lin− c-kit+ HSC byly přeloženy do symbolických sekvencí přiřazením symbolů „+“, „-“, „~“, kdykoli dvě po sobě jdoucí měření procenta buněk dárcovského typu mají pozitivní, negativní nebo nezměněný sklon. Pomocí Hammingova vzdálenost, repopulační vzorce byly podrobeny klastrové analýze, což poskytlo 16 odlišných skupin kinetiky. Abych dokončil empirický důkaz, Přístup Laplaceova typu jedna[je zapotřebí objasnění ] byla použita k určení, že pravděpodobnost nalezení kinetiky, která není obsažena v těchto 16 skupinách, je velmi malá. Z tohoto vyplývá, že výsledek ukazuje, že kompartment hematopoetických kmenových buněk je podle dynamických kritérií také heterogenní.
Původně se věřilo, že všechny hematopoetické kmenové buňky jsou si podobné ve svých schopnostech obnovy a diferenciace. Tento pohled byl poprvé zpochybněn objevem skupiny Muller-Sieburg v San Diegu v roce 2002, který ilustroval, že různé kmenové buňky mohou vykazovat odlišné repopulační vzorce, které jsou epigeneticky předurčenými vnitřními vlastnostmi klonálních Thy-1hle Sca-1+ lin− c-kit+ HSC.[28][29][30] Výsledky těchto klonálních studií vedly k představě zkreslení linie. Pomocí poměru lymfoidních (L) až myeloidních (M) buněk v krvi jako kvantitativního markeru lze kompartment kmenových buněk rozdělit do tří kategorií HSC. Vyvážené (bala) hematopoetické kmenové buňky repopulovat periferní bílé krvinky ve stejném poměru myeloidních k lymfoidním buňkám, jaký je pozorován u nemanipulovaných myší (v průměru asi 15% myeloidních a 85% lymfoidních buněk, nebo 3 ≤ ρ ≤ 10). Myeloidně zkreslené (My-bi) hematopoetické kmenové buňky vedou k velmi malému počtu lymfocytů, což vede k poměrům 0 <ρ <3, zatímco lymfoidně předpjaté (Ly-bi) hematopoetické kmenové buňky generují velmi málo myeloidních buněk, což vede k poměru lymfoidů k myeloidům ρ> 10. Všechny tři typy jsou normálními typy HSC a nepředstavují stadia diferenciace. Jedná se spíše o tři třídy HSC, každá s epigeneticky fixovaným diferenciačním programem. Tyto studie také ukázaly, že zkreslení řádků není stochasticky regulováno nebo závislé na rozdílech v vlivu prostředí. My-bi HSC se obnovuje déle než vyvážený nebo Ly-bi HSC. Myeloidní zkreslení je výsledkem snížené odezvy na lymfopoetin interleukin 7 (IL-7).[29]
Následně další skupiny potvrdily a zvýraznily původní nálezy.[31] Například skupina Eaves v roce 2007 potvrdila, že kinetika repopulace, dlouhodobá kapacita obnovy a My-bi a Ly-bi jsou stabilně zděděné vnitřní HSC vlastnosti.[32] V roce 2010 poskytla skupina Goodell další poznatky o molekulárním základě zkreslení linie v vedlejší populace (SP) SCA-1+ lin− c-kit+ HSC.[33] Jak již bylo ukázáno pro signalizaci IL-7, bylo zjištěno, že člen transformující růstový faktor rodina (TGF-beta) indukuje a inhibuje proliferaci My-bi a Ly-bi HSC.
Etymologie
Z řečtiny haimato-, kombinující formu haima „krev“, a to z latinizované formy řečtiny poietikos "schopný tvorby, kreativní, produktivní", od poiein "udělat, vytvořit".[34]
Viz také
Reference
- ^ A b Birbrair A, Frenette PS (duben 2016). „Niche heterogenita v kostní dřeni“. Annals of the New York Academy of Sciences. 1370 (1): 82–96. Bibcode:2016NYASA1370 ... 82B. doi:10.1111 / nyas.13016. PMC 4938003. PMID 27015419.
- ^ Till JE, McCulloch EA (únor 1961). „Přímé měření radiační citlivosti normálních buněk myší kostní dřeně“. Radiační výzkum. 14 (2): 213–22. Bibcode:1961RadR ... 14..213T. doi:10.2307/3570892. hdl:1807/2781. JSTOR 3570892. PMID 13776896.
- ^ "5. Krvetvorné kmenové buňky." Informace o kmenových buňkách. National Institutes of Health, U.S. Department of Health and Human Services, 17. června 2011. http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx Archivováno 29. 09. 2015 na Wayback Machine
- ^ „Cord Blood 2.0: Umbilical Cord Stem Cell Banking - Americord“. cordadvantage.com. Archivovány od originál dne 2014-06-23.
- ^ „Proces transplantace kostní dřeně“. Klinika Mayo. Citováno 18. března 2015.
- ^ Mahla RS (2016). „Aplikace kmenových buněk v regenerativní medicíně a nemocech“. International Journal of Cell Biology. 2016 (7): 6940283. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.
- ^ Srikanth L, Sunitha MM, Venkatesh K, Kumar PS, Chandrasekhar C, Vengamma B, Sarma PV (2015). „Anaerobní glykolýza a exprese HIF1α v hematopoetických kmenových buňkách vysvětluje její klidovou povahu“. Žurnál kmenových buněk. 10 (2): 97–106. PMID 27125138.
- ^ A b Baumgartner C, Toifl S, Farlik M, Halbritter F, Scheicher R, Fischer I, Sexl V, Bock C, Baccarini M (červen 2018). „Mechanismus zpětné vazby závislý na ERK předchází vyčerpání hematopoetických kmenových buněk“. Buňková kmenová buňka. 22 (6): 879–892.e6. doi:10.1016 / j.stem.2018.05.003. PMC 5988582. PMID 29804890.
- ^ A b Beerman I, Seita J, Inlay MA, Weissman IL, Rossi DJ (červenec 2014). „Klidové hematopoetické kmenové buňky akumulují poškození DNA během stárnutí, které je napraveno po vstupu do buněčného cyklu“. Buňková kmenová buňka. 15 (1): 37–50. doi:10.1016 / j.stem.2014.04.016. PMC 4082747. PMID 24813857.
- ^ A b Nijnik A, Woodbine L, Marchetti C, Dawson S, Lambe T, Liu C, Rodrigues NP, Crockford TL, Cabuy E, Vindigni A, Enver T, Bell JI, Slijepcevic P, Goodnow CC, Jeggo PA, Cornall RJ (červen 2007 ). "Oprava DNA je omezující pro hematopoetické kmenové buňky během stárnutí". Příroda. 447 (7145): 686–90. Bibcode:2007Natur.447..686N. doi:10.1038 / nature05875. PMID 17554302. S2CID 4332976.
- ^ Tilgner K, Neganova I, Moreno-Gimeno I, Al-Aama JY, Burks D, Yung S, Singhapol C, Saretzki G, Evans J, Gorbunova V, Gennery A, Przyborski S, Stojkovic M, Armstrong L, Jeggo P, Lako M (srpen 2013). „Model lidského iPSC deficitu ligázy IV odhaluje důležitou roli opravy NHEJ zprostředkovaného DSB při přežití a genomické stabilitě indukovaných pluripotentních kmenových buněk a vznikajících hematopoetických progenitorů.“. Buněčná smrt a diferenciace. 20 (8): 1089–100. doi:10.1038 / cdd.2013.44. PMC 3705601. PMID 23722522.
- ^ Lucas D, Escudero B, Ligos JM, Segovia JC, Estrada JC, Terrados G, Blanco L, Samper E, Bernad A (únor 2009). „Změněná hematopoéza u myší bez DNA polymerázy mu je způsobena neúčinnou opravou dvouřetězcového zlomu“. Genetika PLOS. 5 (2): e1000389. doi:10.1371 / journal.pgen.1000389. PMC 2638008. PMID 19229323.
- ^ Avagyan S, Churchill M, Yamamoto K, Crowe JL, Li C, Lee BJ, Zheng T, Mukherjee S, Zha S (září 2014). „Dysfunkce hematopoetických kmenových buněk je základem progresivní lymfocytopenie u deficitu XLF / Cernunnos“. Krev. 124 (10): 1622–5. doi:10.1182 / krev-2014-05-574863. PMC 4155271. PMID 25075129.
- ^ A b Tilgner K, Neganova I, Singhapol C, Saretzki G, Al-Aama JY, Evans J, Gorbunova V, Gennery A, Przyborski S, Stojkovic M, Armstrong L, Jeggo P, Lako M (září 2013). „Stručná zpráva: model plunipotentních kmenových buněk indukovaný nedostatkem cernunnosů odhaluje důležitou roli XLF při přežití primitivních hematopoetických předků“. Kmenové buňky. 31 (9): 2015–23. doi:10.1002 / kmen.1456. PMID 23818183. S2CID 3623309.
- ^ Rossi DJ, Bryder D, Seita J, Nussenzweig A, Hoeijmakers J, Weissman IL (červen 2007). „Nedostatky v opravách poškození DNA omezují s věkem funkci hematopoetických kmenových buněk.“ Příroda. 447 (7145): 725–9. Bibcode:2007 Natur.447..725R. doi:10.1038 / nature05862. PMID 17554309. S2CID 4416445.
- ^ A b Felfly, H; Haddad, GG (2014). „Hematopoetické kmenové buňky: potenciální nové aplikace pro translační medicínu“. Žurnál kmenových buněk. 9 (3): 163–97. PMID 25157450.
- ^ A b C d Park, B; Yoo, KH; Kim, C (prosinec 2015). „Expanze a generace hematopoetických kmenových buněk: způsoby, jak dosáhnout průlomu“. Výzkum krve. 50 (4): 194–203. doi:10.5045 / br.2015.50.4.194. PMC 4705045. PMID 26770947.
- ^ Mahla RS (2016). "Aplikace kmenových buněk v regenerativní medicíně a threpeutice nemocí". International Journal of Cell Biology. 2016 (7): 1–24. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.CS1 maint: používá parametr autoři (odkaz)
- ^ "5. Hematopoetické kmenové buňky - stemcells.nih.gov". stemcells.nih.gov.
- ^ Dzierzak E, Speck NA (únor 2008). "O původu a odkazu: vývoj savčích hematopoetických kmenových buněk". Přírodní imunologie. 9 (2): 129–36. doi:10.1038 / ni1560. PMC 2696344. PMID 18204427.
- ^ Tyndall A, Fassas A, Passweg J a kol. (1999). "Autologní transplantace hematopoetických kmenových buněk pro autoimunitní onemocnění - proveditelnost a úmrtnost související s transplantací. Pracovní skupiny pro autoimunitní onemocnění a lymfomy Evropské skupiny pro transplantaci krve a kostní dřeně, Evropské ligy proti revmatismu a mezinárodního projektu kmenových buněk pro autoimunitní onemocnění". Transplantace kostní dřeně. 24 (7): 729–34. doi:10.1038 / sj.bmt.1701987. PMID 10516675.
- ^ Burt RK, Loh Y, Pearce W a kol. (2008). „Klinické aplikace kmenových buněk získaných z krve a kostní dřeně pro nezhoubná onemocnění“. JAMA. 299 (8): 925–36. doi:10.1001 / jama.299.8.925. PMID 18314435.
- ^ EL-Sobky TA, El-Haddad A, Elsobky E, Elsayed SM, Sakr HM (březen 2017). „Zvrat rentgenové patologie skeletu v případě maligní infantilní osteopetrózy po transplantaci hematopoetických kmenových buněk“. Egyptský žurnál radiologie a nukleární medicíny. 48 (1): 237–43. doi:10.1016 / j.ejrnm.2016.12.013.
- ^ Hashemi Taheri AP, Radmard AR, Kooraki S, Behfar M, Pak N, Hamidieh AA, Ghavamzadeh A (září 2015). "Radiologické rozlišení maligních infantilních kostních změn osteopetrózy po transplantaci hematopoetických kmenových buněk". Dětská krev a rakovina. 62 (9): 1645–49. doi:10,1002 / pbc.25524. PMID 25820806. S2CID 11287381.
- ^ Langereis EJ, den Os MM, Breen C, Jones SA, Knaven OC, Mercer J, Miller WP, Kelly PM, Kennedy J, Ketterl TG, O'Meara A, Orchard PJ, Lund TC, van Rijn RR, Sakkers RJ, bílý KK, Wijburg FA (březen 2016). „Průběh dysplazie kyčelního kloubu u hurlerů mukopolysacharidózy typu I po úspěšné transplantaci krvetvorných buněk“. The Journal of Bone and Joint Surgery. 98 (5): 386–95. doi:10.2106 / JBJS.O.00601. PMID 26935461.
- ^ Burger JA, Spoo A, Dwenger A, Burger M, Behringer D (srpen 2003). „Chemokinové receptory CXCR4 (CD184) a integriny alfa4beta1 zprostředkovávají spontánní migraci lidských progenitorů CD34 + a buněk akutní myeloidní leukémie pod buňky stromatu dřeně (pseudoemperipolesis).“ British Journal of Hematology. 122 (4): 579–89. doi:10.1046 / j.1365-2141.2003.04466.x. PMID 12899713. S2CID 8764752.
- ^ Sieburg HB, Müller-Sieburg CE (2004). Msgstr "Klasifikace krátké kinetiky podle tvaru". In Silico Biology. 4 (2): 209–17. PMID 15107024.
- ^ Müller-Sieburg CE, Cho RH, Thoman M, Adkins B, Sieburg HB (srpen 2002). „Deterministická regulace sebeobnovy a diferenciace hematopoetických kmenových buněk“. Krev. 100 (4): 1302–9. doi:10.1182 / krev.V100.4.1302.h81602001302_1302_1309. PMID 12149211.
- ^ A b Muller-Sieburg CE, Cho RH, Karlsson L, Huang JF, Sieburg HB (červen 2004). „Krvotvorné kmenové buňky s myeloidně předpojatými buňkami mají rozsáhlou schopnost samoobnovy, ale generují snížené lymfoidní potomstvo se sníženou schopností reagovat na IL-7“. Krev. 103 (11): 4111–8. doi:10.1182 / krev-2003-10-3448. PMID 14976059.
- ^ Sieburg HB, Cho RH, Dykstra B, Uchida N, Eaves CJ, Muller-Sieburg CE (březen 2006). „Oddělení hematopoetických kmenů se skládá z omezeného počtu samostatných podskupin kmenových buněk“. Krev. 107 (6): 2311–6. doi:10.1182 / krev-2005-07-2970. PMC 1456063. PMID 16291588.
- ^ Schroeder T (březen 2010). "Heteropoetická kmenová buňka heterogenita: podtypy, nepředvídatelné chování". Buňková kmenová buňka. 6 (3): 203–7. doi:10.1016 / j.stem.2010.02.006. PMID 20207223.
- ^ Dykstra B, Kent D, Bowie M, McCaffrey L, Hamilton M, Lyons K, Lee SJ, Brinkman R, Eaves C (srpen 2007). "Dlouhodobé šíření odlišných hematopoetických diferenciačních programů in vivo". Buňková kmenová buňka. 1 (2): 218–29. doi:10.1016 / j.stem.2007.05.015. PMID 18371352.
- ^ Challen GA, Boles NC, Chambers SM, Goodell MA (březen 2010). „Zřetelné subtypy hematopoetických kmenových buněk jsou rozdílně regulovány TGF-beta1“. Buňková kmenová buňka. 6 (3): 265–78. doi:10.1016 / j.stem.2010.02.002. PMC 2837284. PMID 20207229.
- ^ Flexner S, Hauck L, eds. (1993). Random House Nezkrácený slovník (2. vyd.). New York City: Random House. p. 890. ISBN 0-679-42917-4.

