Pyruvát, fosfát dikináza - Pyruvate, phosphate dikinase
| pyruvát, fosfát dikináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.7.9.1 | ||||||||
| Číslo CAS | 9027-40-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Pyruvát, fosfát dikináza | |
|---|---|
 | |
| Identifikátory | |
| Symbol | PPDK |
| InterPro | IPR010121 |
| Viz domény níže. | |
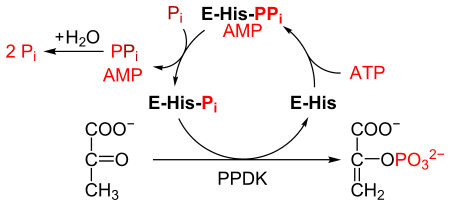
Pyruvát, fosfát dikinázanebo PPDK (ES 2.7.9.1 ) je enzym v rodině transferázy že katalyzuje the chemická reakce
- ATP + pyruvát + fosfát AMP + fosfoenolpyruvát + difosfát
Tento enzym byl studován primárně u rostlin, ale také u některých bakterií.[1] Jedná se o klíčový enzym v glukoneogenezi a fotosyntéze, který je zodpovědný za zvrácení reakce prováděné pyruvátkinázou při glykolýze Embden-Meyerhof-Parnas. To by nemělo být zaměňováno s pyruvát, vodní dikináza.
Patří do rodiny transferázy konkrétně ty, které přenášejí skupiny obsahující fosfor (fosfotransferázy ) se spárovanými akceptory (dikinázy ). Tento enzym se účastní metabolismus pyruvátu a uhlíková fixace.
Nomenklatura
The systematické jméno z této třídy enzymů je ATP: pyruvát, fosfát fosfotransferáza. Mezi další běžně používaná jména patří pyruvát, ortofosfát dikináza, pyruvát-fosfát dikináza (fosforylační), pyruvát fosfát dikináza, pyruvát-anorganický fosfát dikináza, pyruvát-fosfát dikináza, pyruvát-fosfát-ligáza, pyruvát-fosfát-dikináza , Pi dikináza a PPDK.
Reakční mechanismus
PPDK katalyzuje přeměnu pyruvát na fosfoenolpyruvát (PEP), konzumující 1 molekulu ATP a produkci jedné molekuly AMP v průběhu. The mechanismus skládá se ze 3 reverzibilních reakcí:[2]
- Enzym PPDK se váže na ATP, produkuje AMP a a difosforylovaný PPDK.
- Difosforylovaný PPDK se váže na anorganický fosfát, produkující difosfát a (mono) fosforylovaný PPDK.
- Fosforylovaný PPDK se váže na pyruvát, produkuje fosfoenolpyruvát a regeneruje PPDK.
Reakce je podobná reakci katalyzované pyruvátkináza, který také převádí pyruvát na PEP.[3] Pyruvátkináza však katalyzuje nevratná reakce, a nespotřebovává ATP. Naproti tomu PPDK katalyzuje reverzibilní reakci a spotřebuje 1 molekulu ATP pro každou přeměněnou molekulu pyruvátu.
V současné době nejsou podrobnosti o každém mechanickém kroku známy[3]
Struktura
Ve své aktivní formě je PPDK a homotetramer s podjednotky asi 95 kDa [4]
Existují dvě různá reakční centra kolem 45 Angstromové od sebe, ve kterém různé substráty svázat.[5] The nukleotid (ATP) vazebné místo je na N-konec, má 240 aminokyseliny a charakteristické uchopení ATP. Vazebné místo pyruvát / PEP je na C-konec, má 340 aminokyselin a záhyb α / p-barelu. K dispozici je také centrální doména, která obsahuje Jeho 455, primární zbytek zodpovědný za katalýzu. His455 je fosforylový akceptorový nebo donorový zbytek.[3] Struktura enzymu naznačuje, že rameno His455 prochází a otočný pohyb k přemístění fosforylové skupiny mezi dvěma reakčními centry.[6] Během tohoto otočení je centrální doména otáčí se alespoň 92 stupňů a překládá 0,5 angstromů.[7]
Studie z krystalové struktury PPDK ukazují, že centrální doména je umístěna v odlišné blízkosti dvou dalších domén v závislosti na zdroji enzymu.[7] v kukuřice, je blíže k C-terminálu, zatímco je v Clostridium symbiosum, je blíže k N-terminálu.
Výzkum ukázal, že vazebné mechanismy PPDK jsou podobné jako u D-Ala-D-Ala ligáza a pyruvátkináza.[5] Zejména je PPDK velmi podobný pyruvátkináze, která také katalyzuje přeměnu pyruvátu na fosfoenolpyruvát; dělá to však bez fosforylovaného enzymového meziproduktu.[3] I když jsou jejich aminokyselinové sekvence odlišné, zbytky klíčové pro katalýzu jsou zachovány v obou enzymech. Bodová mutageneze experimenty ukázaly, že zahrnují katalytické zbytky Arg 561, Arg 617, Glu 745, Asn 768 a Cys 831 (číslování vztaženo k C, symbiosum protein, PDB: 1 kB, 1KC7).[3]
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Biologická funkce a evoluce
PPDK se používá v Dráha C4, zlepšit účinnost oxid uhličitý fixace.[8] V prostředích, kde je hodně světla, je rychlost fotosyntéza v rostlinách je omezený rychlostí oxidu uhličitého (CO2) absorpce. To lze zlepšit použitím řady chemických reakcí k transportu CO2 z mezofyl buňky (které jsou umístěny na vnější straně listu) do plášť svazku buňky (které jsou umístěny uvnitř buněk). PPDK převádí pyruvát na PEP, který reaguje s CO2 k výrobě oxaloacetát. Když CO2 se uvolňuje v buňkách pláště svazku, pyruvát se regeneruje a cyklus pokračuje.[8]
Ačkoli reakce katalyzovaná PPDK je reverzibilní, je PEP upřednostňován jako produkt v biologických podmínkách. To je způsobeno základní pH v stroma, kde dochází k reakci, stejně jako vysoké koncentrace adenylát kináza a pyrofosfatáza. Protože tyto dva enzymy katalyzují exergonický reakce zahrnující AMP, respektive difosfát, pohánějí PPDK-katalyzovanou reakci vpřed.[9] Protože PPDK spotřebovává ATP, je cesta C4 nepříznivá pro rostliny v prostředích s malým přístupem ke světlu, protože nejsou schopny produkovat velké množství ATP.[8]
PPDK je velmi bohatý na listy C4, tvoří až 10% z celkového množství protein.[10] Výzkum ukázal, že enzym je asi 96% identický v různých druh rostlin. Hybridizace experimenty odhalily, že genetické rozdíly korelují s rozsahem, v jakém rostliny provádějí dráhu C4 - neobvyklé sekvence existují v rostlinách, které také vykazují charakteristiky C3.[11] PPDK se také nachází v malých množstvích v rostlinách C3. Evoluční historie naznačuje, že kdysi hrála roli glykolýza jako podobné pyruvátkináza, a nakonec vyvinul do dráhy C4.[10]
Kromě rostlin se PPDK nachází také v parazistické ameobě Entamoeba histolytica (P37213) a bakterie Clostridium symbiosum (P22983; stejně jako další bakterie).[12] V těchto dvou organismech funguje PPDK podobně (a někdy místo) pyruvátkináza, přičemž katalyzuje reakci ve směru produkce ATP jako součást glykolýzy. Inhibitory pro Entamoeba PPDK byly navrženy jako amebicidy proti tomuto organismu.[13]
Nařízení

Závod PPDK je regulován pyruvát, regulační protein fosfát dikinázy (PDRP).[4] Když je úroveň světla vysoká, PDRP defosforyluje Thr 456 na PPDK pomocí AMP, čímž aktivuje enzym.[10] PDRP deaktivuje PPDK jeho fosforylací threonin zbytek, použitím difosfát. PDRP je jedinečný regulátor protože katalyzuje aktivaci i deaktivaci PPDK prostřednictvím dvou různých mechanismů.[10]
Výzkum v oblasti kukuřice PPDK to naznačuje introny, terminátorové sekvence, a možná další sekvence zesilovače, spolupracují ke zvýšení úrovně funkční a stabilní mRNA. PPDK cDNA byl exprimován pouze mírně v transgenních rýže ve srovnání s intaktní DNA, která zaznamenala významnou expresi.[14]
Strukturální studie
Počátkem roku 2018, 14 struktur byly pro tuto třídu enzymů vyřešeny pomocí PDB přístupové kódy 1DIK, 1GGO, 1H6Z, 1JDE, 1 kB, 1KC7, 1VBG, 1 VBH, 2DIK, 2FM4, 5JVJ, 5JVL, 5JVN, 5LU4.
Reference
- ^ Pocalyko DJ, Carroll LJ, Martin BM, Babbitt PC, Dunaway-Mariano D (prosinec 1990). „Analýza sekvenčních homologií v rostlinné a bakteriální pyruvátfosfátdikináze, enzymu I bakteriálního systému fosfoenolpyruvát: cukr fosfotransferáza a dalších enzymů využívajících PEP. Identifikace potenciálních katalytických a regulačních motivů.“. Biochemie. 29 (48): 10757–65. doi:10.1021 / bi00500a006. PMID 2176881.
- ^ Evans HJ, Wood HG (prosinec 1968). „Mechanismus reakce pyruvát, fosfát dikináza“. Sborník Národní akademie věd Spojených států amerických. 61 (4): 1448–53. Bibcode:1968PNAS ... 61.1448E. doi:10.1073 / pnas.61.4.1448. PMC 225276. PMID 4303480.
- ^ A b C d E Herzberg O, Chen CC, Liu S, Tempczyk A, Howard A, Wei M a kol. (Leden 2002). „Pyruvátové místo pyruvátfosfátdikinázy: krystalová struktura komplexu enzym-fosfonopyruvát a analýza mutantů“. Biochemie. 41 (3): 780–7. doi:10.1021 / bi011799 +. PMID 11790099.
- ^ A b Chastain CJ, Failing CJ, Manandhar L, Zimmerman MA, Lakner MM, Nguyen TH (květen 2011). "Funkční vývoj C (4) pyruvátu, ortofosfát dikinázy". Journal of Experimental Botany. 62 (9): 3083–91. doi:10.1093 / jxb / err058. PMID 21414960.
- ^ A b Herzberg O, Chen CC, Kapadia G, McGuire M, Carroll LJ, Noh SJ, Dunaway-Mariano D (duben 1996). "Mechanismus otočné domény pro enzymatický fosfotransfer mezi vzdálenými reakčními místy". Sborník Národní akademie věd Spojených států amerických. 93 (7): 2652–7. Bibcode:1996PNAS ... 93.2652H. doi:10.1073 / pnas.93.7.2652. PMC 39685. PMID 8610096.
- ^ Lim K, Read RJ, Chen CC, Tempczyk A, Wei M, Ye D a kol. (Prosinec 2007). "Mechanismus otočné domény v pyruvátfosfátdikináze". Biochemie. 46 (51): 14845–53. CiteSeerX 10.1.1.421.2653. doi:10.1021 / bi701848w. PMID 18052212.
- ^ A b Nakanishi T, Nakatsu T, Matsuoka M, Sakata K, Kato H (únor 2005). „Krystalové struktury pyruvátfosfátdikinázy z kukuřice odhalily alternativní konformaci v pohybu v otočné doméně“. Biochemie. 44 (4): 1136–44. doi:10.1021 / bi0484522. PMID 15667207.
- ^ A b C Berg J, Tymoczko J, Stryer L (2012). „Calvinův cyklus a fosfátová cesta pentózy“. Biochemie (7. vydání). New York: W.H. Freeman. 599–600. ISBN 9780716787242.
- ^ Chastain C (2010). "Struktura, funkce a posttranslační regulace C4 pyruvát-ortofosfát-dikinázy". V Raghavendra A (ed.). Fotosyntéza C4 a související mechanismy koncentrace CO2. 301–305. ISBN 9789048194063.
- ^ A b C d Chastain CJ, Fries JP, Vogel JA, Randklev CL, Vossen AP, Dittmer SK a kol. (Duben 2002). „Pyruvát, ortofosfátdikináza v listech a chloroplastech rostlin C (3) prochází reverzibilní fosforylací indukovanou světlem / tmou“. Fyziologie rostlin. 128 (4): 1368–78. doi:10,1104 / pp.010806. PMC 154264. PMID 11950985.
- ^ Rosche E, Streubel M, Westhoff P (říjen 1994). „Primární struktura fotosyntetické pyruvát-ortofosfát-dikinázy rostliny C3 Flaveria pringlei a analýza exprese sekvencí pyruvát-ortofosfát-dikinázy u druhů Flaveria C3, C3-C4 a C4“. Molekulární biologie rostlin. 26 (2): 763–9. doi:10.1007 / bf00013761. PMID 7948930. S2CID 23276817.
- ^ UniProt 50% -90% klastrů: Z Clostridium PPDK
- ^ Stephen P, Vijayan R, Bhat A, Subbarao N, Bamezai RN (září 2008). "Molekulární modelování na pyruvátfosfátdikináze z Entamoeba histolytica a in silico virtual screening na nové inhibitory". Journal of Computer-Aided Molecular Design. 22 (9): 647–60. Bibcode:2008JCAMD..22..647S. doi:10.1007 / s10822-007-9130-2. PMID 17710553. S2CID 25026913.
- ^ Fukayama H, Tsuchida H, Agarie S, Nomura M, Onodera H, Ono K a kol. (Listopad 2001). "Významná akumulace C (4) specifického pyruvátu, ortofosfát dikinázy v rostlině C (3), rýže". Fyziologie rostlin. 127 (3): 1136–46. doi:10.1104 / pp.010641. PMC 129282. PMID 11706193.
Další čtení
- Hatch MD, Slack CR (leden 1968). „Nový enzym pro vzájemnou přeměnu pyruvátu a fosfopyruvátu a jeho role v cestě fotosyntézy dikarboxylové kyseliny C4“. The Biochemical Journal. 106 (1): 141–6. doi:10.1042 / bj1060141. PMC 1198479. PMID 4305612.
- Reeves RE (červen 1968). "Nový enzym s glykolytickou funkcí pyruvátkinázy". The Journal of Biological Chemistry. 243 (11): 3202–4. PMID 4297474.
- Reeves RE (listopad 1971). "Pyruvát, fosfát dikináza z Bacteroides symbiosus". The Biochemical Journal. 125 (2): 531–9. doi:10.1042 / bj1250531. PMC 1178089. PMID 5144757.
- Reeves RE, Menzies RA, Hsu DS (říjen 1968). „Reakce pyruvát-fosfát-dikináza. Osud fosfátu a rovnováha.“ The Journal of Biological Chemistry. 243 (20): 5486–91. PMID 4302788.

