Pyranóza - Pyranose
Pyranóza je souhrnný termín pro sacharidy které mají chemickou strukturu, která zahrnuje šestičlenný kruh skládající se z pěti atomů uhlíku a jednoho atomu kyslíku. Vně kruhu mohou být i jiné uhlíky. Název je odvozen od podobnosti s kyslíkovým heterocyklem pyran, ale pyranosový kruh nemá dvojné vazby. Pyranóza, ve které byl anomerní OH na C (l) převeden na skupinu OR, se nazývá pyranosid.
| Tetrahydropyran | |||
| název | Tetrahydropyran | α-D- (+) - Glukopyranóza | |
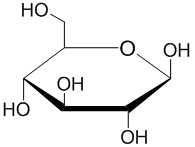
| strukturní vzorec |  |  | |
| Zvýrazněn kruh tetrahydropyranu modrý | Zvýrazněn kruh tetrahydropyranu modrý | ||
Formace
Pyranosový kruh je tvořen reakcí hydroxyl skupina na uhlíku 5 (C-5) cukru s aldehyd na uhlíku 1. Toto tvoří intramolekulární poloacetal. Pokud je reakce mezi C-4 hydroxylem a aldehydem, a furanóza místo toho se tvoří.[1] Forma pyranózy je termodynamicky stabilnější než forma furanózy, což lze vidět distribucí těchto dvou cyklických forem v roztoku.[2]

Dějiny
Hermann Emil Fischer vyhrál Nobelova cena za chemii (1902) za práci při určování struktury D-aldohexózy.[1] Lineární struktury volných aldehydů, které Fischer navrhl, však představují velmi malé procento forem, které hexosové cukry přijímají v roztoku. to bylo Edmund Hirst a Clifford Purves ve výzkumné skupině Walter Haworth, který přesvědčivě určil, že hexózové cukry přednostně tvoří pyranosový nebo šestičlenný kruh. Haworth nakreslil prsten jako plochý šestiúhelník se skupinami nad a pod rovinou prstenu - Haworthova projekce.[3]
Další zdokonalení konformace pyranózových prstenů přišlo, když si Sponsler a Dore (1926) uvědomili, že Sachseovo matematické zpracování šestičlenných prstenů lze použít na jejich Struktura rentgenového záření z celulóza.[3] Bylo zjištěno, že pyranosový kruh je svraštěn, aby všechny uhlíkové atomy kruhu mohly mít blízko k ideální čtyřboké geometrii.
Konformace
Toto svraštění vede k celkem 38 odlišným základním pyranózám konformace: 2 židle, 6 člunů, 6 šikmých člunů, 12 polosedaček a 12 obálek.[4]

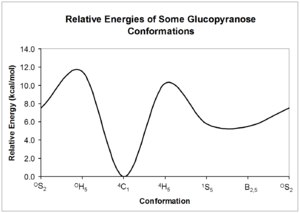
Tyto konformery se mohou vzájemně převádět; každá forma však může mít velmi odlišnou relativní energii, takže je významná bariéra může být přítomna interkonverze. Energii těchto konformací lze vypočítat z kvantová mechanika; příklad možného glukopyranóza jsou uvedeny interkonverze.[5]
Konformace pyranózového kruhu jsou povrchně podobné konformacím cyklohexan prsten. Specifická nomenklatura pyranóz však zahrnuje odkaz na kruhový kyslík a přítomnost hydroxylových skupin na kruhu má výrazné účinky na jeho konformační preference. Existují také konformační a stereochemické účinky specifické pro pyranosový kruh.
Nomenklatura

Abychom pojmenovali konformace pyranózy, nejprve se určí konformátor. Společné konforméry jsou podobné těm, které se nacházejí v cyklohexan, a tyto tvoří základ názvu. Běžné úpravy jsou židle (C), člun (B), zkosení (S), polosedačka (H) nebo obálka (E). Atomy kruhu jsou poté očíslovány; the anomerní nebo hemiacetal, uhlík je vždy 1. Atomy kyslíku ve struktuře jsou obecně označovány atomem uhlíku, ke kterému jsou připojeny v acyklické formě, a jsou označeny O. Pak:
- Umístěte prsten tak, aby při pohledu na horní stranu byly atomy očíslovány ve směru hodinových ručiček.
- V konformacích židle a zkosení by měla být vybrána referenční rovina. V křeslové konformaci je referenční rovina zvolena tak, aby atom s nejnižším číslem (obvykle C-1) byl exoplanární. V zkosené konformaci rovina obsahuje tři sousední atomy a jeden další s atomem s nejnižším možným počtem exoplanárních.[6]
- Atomy nad rovinou jsou psány před štítkem konformeru jako horní index
- Atomy pod rovinou jsou psány podle štítku konformátoru jako dolní index[7]
NMR spektroskopie
Jak ukazují relativní energie struktur ve výše uvedeném diagramu, struktury židle jsou nejstabilnější formou sacharidů. Tato relativně definovaná a stabilní konformace znamená, že atomy vodíku pyranózového kruhu jsou vzájemně drženy v relativně konstantních úhlech. Sacharidová NMR využívá je vzepětí pro stanovení konfigurace každé z hydroxylových skupin kolem kruhu.
Viz také
Reference
- ^ A b Robyt, J.F. (1998). Základy chemie sacharidů. Springer. ISBN 0-387-94951-8.
- ^ Ma, B.Y .; Schaefer, H.F .; Allinger, N.L. (1998). "Teoretické studie povrchů a složení potenciální energie D-aldo a D-ketohexózy “. Journal of the American Chemical Society. 120 (14): 3411–3422. doi:10.1021 / ja9713439.
- ^ A b Rao, V.S.R .; Qasba, P.K .; Chandrasekaran, R .; Balaji, P.V. (1998). Konformace sacharidů. CRC Press. ISBN 90-5702-315-6.
- ^ Ionescu, A.R .; Berces, A .; Zgierski, M.Z .; Whitfield, D.M .; Nukada, T. (2005). „Konformační cesty nasycených šestičlenných kruhů. Studie statické a dynamické hustoty. The Journal of Physical Chemistry A. 109 (36): 8096–8105. doi:10.1021 / jp052197t. PMID 16834195.
- ^ Biarns, X .; Ardvol, A .; Planas, A .; Rovira, C .; Laio, A .; Parrinello, M. (2007). „Konformační krajina volné energie β-D-Glukopyranóza. Důsledky pro předběžnou aktivaci substrátu v β-glukosidhydrolázách “. Journal of the American Chemical Society. 129 (35): 10686–10693. doi:10.1021 / ja068411o. PMID 17696342.
- ^ Grindley, T. Bruce (2008). "Struktura a konformace sacharidů". In Fraser-Reid, B.O .; Tatsuta, K .; Thiem, J .; Coté, G.L .; Flitsch, S .; Ito, Y .; Kondo, H .; Nishimura, S.-i .; Yu, B. (eds.). Glycoscience: Chemistry and Chemical Biology I – III. s. 3–55. doi:10.1007/978-3-540-30429-6_1. ISBN 978-3-540-30429-6.
- ^ Furhop, J.H .; Endisch, C. (2000). Molekulární a supramolekulární chemie přírodních produktů a jejich modelových sloučenin. CRC Press. ISBN 0-8247-8201-1.
