Trombofilie - Thrombophilia
| Trombofilie | |
|---|---|
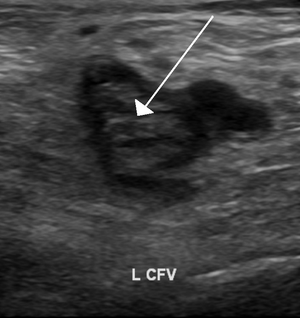 | |
| Ultrazvukový snímek ukazující krevní sraženinu v levé společné femorální žíle. | |
| Specialita | Hematologie |

Trombofilie (někdy nazývané hyperkoagulabilita nebo a protrombotický stav) je abnormalita srážení krve což zvyšuje riziko trombóza (krevní sraženiny v cévách).[1][2] Takové abnormality lze identifikovat u 50% lidí, kteří mají epizodu trombózy (např hluboká žilní trombóza v noze), která nebyla vyvolána jinými příčinami.[3] Významná část populace má detekovatelnou trombofilní abnormalitu, ale u většiny z nich se trombóza vyvine pouze za přítomnosti dalšího rizikového faktoru.[2]
U většiny trombofilií neexistuje žádná specifická léčba, ale opakované epizody trombózy mohou být indikací pro dlouhodobou preventivní léčbu. antikoagulace.[2] První hlavní forma trombofilie identifikovaná lékařskou vědou, nedostatek antitrombinu, byl identifikován v roce 1965, zatímco nejčastější abnormality (včetně faktor V Leiden ) byly popsány v 90. letech.[4][5]
Příznaky a symptomy

Nejběžnější stavy spojené s trombofilií jsou hluboká žilní trombóza (DVT) a plicní embolie (PE), které jsou souhrnně označovány jako žilní tromboembolismus (VTE). DVT se obvykle vyskytuje v nohách a je charakterizována bolestí, otokem a zarudnutím končetiny. Může to vést k dlouhodobý otok a tíha v důsledku poškození chlopní v žilách.[6] Sraženina se může také odlomit a migrovat (embolizovat ) do tepen v plicích. V závislosti na velikosti a umístění sraženiny to může vést k náhlému nástupu dušnost, bolest na hrudi, bušení srdce a může být komplikováno kolaps, šokovat a srdeční zástava.[2][7]
Venózní trombóza se může objevit také na neobvyklejších místech: v mozkové žíly, játra (trombóza portální žíly a trombóza jaterních žil ), mezenterická žíla, ledvina (trombóza ledvinových žil ) a žíly paží.[2] Zda trombofilie také zvyšuje riziko arteriální trombóza (což je základní příčinou infarkty a tahy ) je méně dobře zavedený.[2][8][9]
Trombofilie byla spojena s opakovaný potrat,[10] a možná různé komplikace těhotenství, jako je omezení nitroděložního růstu, mrtvé dítě, těžké preeklampsie a abruptio placentae.[2]
Nedostatek proteinu C. může způsobit purpura fulminans, závažná porucha srážení krve u novorozence, která vede jak ke smrti tkáně, tak ke krvácení do kůže a dalších orgánů. Tento stav byl také popsán u dospělých. Protein C a nedostatek proteinu S. byly také spojeny se zvýšeným rizikem kožní nekróza o zahájení antikoagulační léčby přípravkem warfarin nebo související léky.[2][11]
Příčiny
Trombofilie může být vrozená nebo získaná. Vrozená trombofilie odkazuje na vrozené stavy (a obvykle dědičné, v takovém případě "dědičná trombofilie„mohou být použity), které zvyšují tendenci k rozvoji trombózy, zatímco na druhé straně získaná trombofilie odkazuje na podmínky, které nastanou později v životě.
Kongenitální
Nejběžnějším typem vrozené trombofilie jsou ty, které vznikají v důsledku nadměrné aktivity koagulačních faktorů. Jsou relativně mírné, a proto jsou klasifikovány jako defekty typu II.[12] Nejběžnější jsou faktor V Leiden (mutace v F5 gen v poloze 1691) a protrombin G20210A mutace v protrombin (v poloze 20210 v 3 'nepřekládaná oblast genu).[1][13]
Vzácné formy vrozené trombofilie jsou obvykle způsobeny nedostatkem přírodních antikoagulancií. Jsou klasifikovány jako „typ I“ a jsou náchylnější k trombóze.[12] Hlavní jsou antitrombin III nedostatek, nedostatek proteinu C. a nedostatek proteinu S..[1][13] Mírnější vzácné vrozené trombofilie jsou faktor XIII mutace[13] a familiární dysfibrinogenemie (nenormální fibrinogen ).[13] Není jasné, zda vrozené poruchy fibrinolýza (systém, který ničí sraženiny) významně přispívají k riziku trombózy.[12] Vrozený nedostatek plazminogen například způsobuje hlavně oční příznaky a někdy i problémy v jiných orgánech, ale souvislost s trombózou byla nejistější.[14]
Krevní skupina významně určuje riziko trombózy. Ti, kteří mají jiné krevní skupiny než typ O, mají 2- až 4násobné relativní riziko. O krevní skupina je spojena se sníženou hladinou von Willebrandova faktoru - kvůli zvýšené clearance - a faktorem VIII, který souvisí s trombotickým rizikem.[5]
Získané
Řada získaných stavů zvyšuje riziko trombózy. Výrazným příkladem je antifosfolipidový syndrom,[1][13] který je způsoben protilátky zejména proti složkám buněčné membrány lupus antikoagulant (poprvé zjištěno u lidí s touto chorobou systémový lupus erythematodes ale často zjištěny u lidí bez onemocnění), anti-kardiolipinové protilátky, a anti-β2-glykoprotein 1 protilátky; považuje se proto za autoimunitní onemocnění. V některých případech může antifosfolipidový syndrom způsobit arteriální i venózní trombózu. Je také silněji spojena s potratem a může způsobit řadu dalších příznaků (např liveso reticularis kůže a migréna ).[15]
Trombocytopenie vyvolaná heparinem (HIT) je důsledkem reakce imunitního systému proti antikoagulačnímu léku heparin (nebo jeho deriváty).[1] Ačkoli je pojmenován pro související nízký počet krevních destiček, HIT je silně spojen s rizikem žilní a arteriální trombózy.[16] Paroxysmální noční hemoglobinurie (PNH) je vzácný stav způsobený získanými změnami v PIGA gen, který hraje roli při ochraně krevních buněk před doplňkový systém. PNH zvyšuje riziko žilní trombózy, ale je také spojován s hemolytická anémie (anémie způsobená destrukcí červených krvinek).[17] Jak HIT, tak PNH vyžadují zvláštní zacházení.[16][17]
Hematologické stavy spojené s pomalým průtokem krve mohou zvýšit riziko trombózy. Například, srpkovitá nemoc (způsobené mutacemi hemoglobin ) je považován za mírný protrombotický stav vyvolaný zhoršeným průtokem.[1] Podobně, myeloproliferativní poruchy, ve kterých kostní dřeň produkuje příliš mnoho krevních buněk, předisponují k trombóze, zejména v polycythemia vera (přebytek červených krvinek) a esenciální trombocytóza (nadbytek krevních destiček). Opět platí, že tyto podmínky obvykle vyžadují specifické zacházení, pokud jsou identifikovány.[18]
Rakovina, zvláště když metastazující (šíří se na další místa v těle), je uznávaným rizikovým faktorem trombózy.[2][13] Byla navržena řada mechanismů, jako je aktivace koagulačního systému rakovinovými buňkami nebo sekrece prokoagulačních látek. Kromě toho konkrétní léčba rakoviny (jako je použití centrální žilní katétry pro chemoterapie ) může dále zvyšovat riziko trombózy.[19]
Nefrotický syndrom, ve kterém se bílkovina z krevního řečiště uvolňuje do moči v důsledku onemocnění ledvin, může předisponovat k trombóze;[1] to platí zejména v závažnějších případech (jak je naznačeno hladinami albumin pod 25 g / l) a pokud je syndrom způsoben tímto stavem membranózní nefropatie.[20] Zánětlivé onemocnění střev (ulcerózní kolitida a Crohnova nemoc ) predisponují k trombóze, zejména pokud je onemocnění aktivní. Byly navrženy různé mechanismy.[2][21]
Těhotenství je spojeno se zvýšeným rizikem trombózy 2- až 7krát.[22] To pravděpodobně vyplývá z fyziologického hyperkoagulabilita v těhotenství který chrání před poporodní krvácení.[23] Tato hyperkoagulačnost zase pravděpodobně souvisí s vysokými hladinami estradiol a progesteron které se vyskytují během těhotenství.[24]
Estrogeny, pokud se používá v kombinovaná hormonální antikoncepce a v menopauzální hormonální terapie (v kombinaci s progestogeny ), byly spojeny s 2- až 6násobným zvýšeným rizikem žilní trombózy. Riziko závisí na typech použitých hormonů, dávce estrogenu a přítomnosti dalších trombofilních rizikových faktorů.[25] Různé mechanismy, jako je nedostatek protein S. a inhibitor dráhy tkáňového faktoru, se říká, že jsou zodpovědní.[26]
Obezita je již dlouho považován za rizikový faktor pro žilní trombózu. V mnoha studiích více než zdvojnásobuje riziko, zejména v kombinaci s užíváním perorálních kontraceptiv nebo v období po chirurgická operace. U obézních byly popsány různé abnormality srážení. Inhibitor aktivátoru plazminogenu-1, inhibitor fibrinolýzy, je přítomen ve vyšších hladinách u lidí s obezitou. Obézní lidé mají také větší počet cirkulující mikrovezikuly (fragmenty poškozených buněk), které nesou tkáňový faktor. Destička agregace může být zvýšena a existují vyšší hladiny koagulačních proteinů, jako je von Willebrandův faktor, fibrinogen, faktor VII a faktor VIII. Obezita také zvyšuje riziko recidivy po počáteční epizodě trombózy.[27]
Nejasný
Řada stavů, které jsou spojeny s venózní trombózou, je pravděpodobně genetická a možná získaná.[13] Mezi ně patří: zvýšené hladiny faktoru VIII, faktor IX, faktor XI, fibrinogen a inhibitor fibrinolýzy aktivovatelný trombinem a snížené hladiny inhibitor dráhy tkáňového faktoru. Rezistence na aktivovaný protein C. to nelze přičíst mutacím faktoru V, je pravděpodobně způsobeno jinými faktory a zůstává rizikovým faktorem pro trombózu.[13]
Existuje souvislost mezi hladinami v krvi homocystein a trombóza,[13] ačkoli toto nebylo hlášeno důsledně ve všech studiích.[5] Hladiny homocysteinu jsou určovány mutacemi v MTHFR a CBS geny, ale také podle úrovní kyselina listová, vitamin B6 a vitamin B12, které závisí na stravě.[12]
Mechanismus

Trombóza je multifaktoriální problém, protože u člověka může často dojít k rozvoji trombózy. Tyto rizikové faktory může zahrnovat jakoukoli kombinaci abnormalit ve stěně cév, abnormalit v průtoku krve (jako při imobilizaci) a abnormalit v konzistenci krve. Trombofilie je způsobena abnormalitami v konzistenci krve, která je určena hladinami koagulačních faktorů a dalších cirkulujících krevních proteinů, které se účastní „koagulační kaskády“.[13]
Normální koagulace je zahájena uvolněním tkáňový faktor z poškozené tkáně. Tkáňový faktor se váže na cirkulující faktor VIIa. Kombinace se aktivuje faktor X na faktor Xa a faktor IX na faktor IXa. Faktor Xa (v přítomnosti faktor V ) se aktivuje protrombin do trombinu. Trombin je ústředním enzymem v procesu srážení: generuje fibrin fibrinogen, a aktivuje řadu dalších enzymů a kofaktorů (faktor XIII, faktor XI, faktor V a faktor VIII, TAFI), které posilují fibrinovou sraženinu.[12] Proces je inhibován TFPI (který inaktivuje první krok katalyzovaný faktorem VIIa / tkáňovým faktorem), antitrombinem (který inaktivuje trombin, faktor IXa, Xa a XIa), proteinem C (který inhibuje faktory Va a VIIIa v přítomnosti proteinu S ), a protein Z (který inhibuje faktor Xa).[12]
U trombofilie je narušena rovnováha mezi „prokoagulační“ a „antikoagulační“ aktivitou. Závažnost nerovnováhy určuje pravděpodobnost, že u někoho dojde k trombóze. I malé poruchy bílkovin, jako je snížení antitrombinu pouze na 70–80% normální hladiny, mohou zvýšit riziko trombózy; to je v rozporu s hemofilie, který vzniká, pouze pokud jsou výrazně sníženy hladiny koagulačních faktorů.[12]
Kromě účinků na trombózu mohou hyperkoagulační stavy urychlit vývoj ateroskleróza arteriální onemocnění, které je základem infarkt myokardu a další formy kardiovaskulárních onemocnění.[28][29]
Diagnóza

Testy na trombofilii zahrnují kompletní krevní obraz (s přezkoumáním krevní film ), protrombinový čas, částečný tromboplastinový čas, test trombodyamics, trombinový čas a doba plazení, lupus antikoagulant, anti-kardiolipinová protilátka, protilátka anti-β2 glykoprotein 1, aktivovaný protein C rezistence, fibrinogen testy, faktor V Leiden a protrombin mutace a bazální homocystein úrovně.[2] Testování může být více či méně rozsáhlé v závislosti na klinickém úsudku a abnormalitách zjištěných při počátečním hodnocení.[2]
U dědičných případů musí mít pacient alespoň dva abnormální testy a rodinnou anamnézu.
Promítání
Existují odlišné názory na to, zda by měl být u každého s nevyprovokovanou epizodou trombózy vyšetřován výskyt trombofilie. Dokonce i ti s formou trombofilie nemusí být nutně vystaveni riziku další trombózy, zatímco recidivující trombóza je pravděpodobnější u těch, kteří měli předchozí trombózu, dokonce iu těch, kteří nemají detekovatelné trombofilní abnormality.[8][11][30] Opakovaný tromboembolismus nebo trombóza na neobvyklých místech (např jaterní žíla v Budd-Chiariho syndrom ), je obecně přijímanou indikací pro screening. Je pravděpodobnější, že bude nákladově efektivní u lidí se silnou osobní nebo rodinnou anamnézou trombózy.[31] Naproti tomu kombinace trombofilie s dalšími rizikovými faktory může poskytnout indikaci pro preventivní léčbu, a proto mohou být testy na trombofilii prováděny i u těch, kteří nesplňují přísná kritéria pro tyto testy.[30] Hledání abnormality koagulace se obvykle neprovádí u pacientů, u nichž má trombóza zjevnou příčinu. Například pokud je trombóza způsobena imobilizací po nedávné době ortopedická operace, je to považováno za „vyprovokované“ imobilizací a chirurgickým zákrokem a je méně pravděpodobné, že vyšetřování přinese klinicky důležité výsledky.[11][30]
Dojde-li k venózní tromboembolii, když pacient trpí přechodnými hlavními rizikovými faktory, jako je prodloužená nehybnost, chirurgický zákrok nebo trauma, není testování trombofilie vhodné, protože výsledek testu by nezměnil pacientem indikovanou léčbu.[32][33] V roce 2013 Americká společnost pro hematologii jako součást doporučení v Moudře vybírat kampaň varovala před nadužíváním screeningu trombofilie; falešně pozitivní výsledky testování by vedly k tomu, že by lidé byli nevhodně označeni jako pacienti s trombofilií a byli by léčeni antikoagulancii bez klinické potřeby[32]
Ve Spojeném království poskytují odborné pokyny specifické indikace pro testování trombofilie. Doporučuje se, aby testování bylo prováděno až po náležitém poradenství, a proto se vyšetřování obvykle neprovádí v době, kdy je diagnostikována trombóza, ale později.[11] V konkrétních situacích, jako např trombóza žil sítnice, testování se zcela nedoporučuje, protože trombofilie není považována za hlavní rizikový faktor. U jiných vzácných stavů obecně souvisejících s hyperkoagulabilitou, jako je trombóza mozkových žil a trombóza portálních žil, není k dispozici dostatek údajů, aby bylo možné určit, zda je screening trombofilie užitečný, a rozhodnutí o screeningu trombofilie za těchto podmínek proto nejsou považována za na základě důkazů.[11] Pokud je nákladová efektivita (roky života upravené podle kvality výměnou za výdaje) je vodítkem, obecně není jasné, zda vyšetřování trombofilie ospravedlňuje často vysoké náklady,[34] pokud není testování omezeno na vybrané situace.[35]
Opakovaný potrat je indikací pro screening trombofilie, zejména antifosfolipidových protilátek (anti-kardiolipinové IgG a IgM, stejně jako lupusové antikoagulanty), mutace faktoru V Leiden a protrombin, aktivace rezistence na aktivovaný protein C a obecného hodnocení koagulace vyšetřováním známým tromboelastografie.[10]
Ženy, které plánují užívání perorálních kontraceptiv, nemají prospěch z rutinního screeningu trombofilií, protože absolutní riziko trombotických příhod je nízké. Pokud buď žena nebo příbuzný prvního stupně trpí trombózou, riziko vzniku trombózy se zvyšuje. Screening této vybrané skupiny může být prospěšný,[26] ale i když negativní může stále znamenat zbytkové riziko.[11] Odborné pokyny proto navrhují, aby byly použity spíše jiné formy antikoncepce než spoléhat se na screening.[11]
Screening trombofilie u lidí s arteriální trombózou je obecně považován za nevhodný a obecně se nedoporučuje,[11] s výjimkou pravděpodobně pro neobvykle mladé pacienty (zvláště pokud jsou vysráženy kouření nebo použití estrogenu hormonální antikoncepce ) a ti, u nichž revaskularizace, jako je koronární arteriální bypass selže z důvodu rychlé okluze štěpu.[9]
Léčba
Neexistuje žádná specifická léčba trombofilie, pokud není způsobena základním zdravotním onemocněním (jako je nefrotický syndrom), kde je nutná léčba základního onemocnění. U pacientů s nevyprovokovanou a / nebo opakující se trombózou nebo u osob s vysoce rizikovou formou trombofilie je nejdůležitějším rozhodnutím, zda užívat antikoagulační léky, jako je warfarin dlouhodobě snižovat riziko dalších epizod.[3] Toto riziko je třeba zvážit proti riziku, že léčba způsobí významné krvácení, protože hlášené riziko závažného krvácení je více než 3% ročně a v důsledku toho může zemřít 11% pacientů s velkým krvácením.[3]
Kromě výše zmíněných forem trombofilie je riziko recidivy po epizodě trombózy určováno faktory, jako je rozsah a závažnost původní trombózy, ať už byla vyprovokována (například imobilizací nebo těhotenstvím), počet předchozích trombotik události, mužské pohlaví, přítomnost filtr dolní duté žíly, přítomnost rakoviny, příznaky posttrombotický syndrom, a obezita.[3] Tyto faktory mají tendenci být při rozhodování důležitější než přítomnost nebo nepřítomnost detekovatelné trombofilie.[11][36]
Pacientům s antifosfolipidovým syndromem může být nabídnuta dlouhodobá antikoagulace po první nevyprovokované epizodě trombózy. Riziko je určeno podtypem detekované protilátky, metodou titr protilátek (množství protilátek), zda je detekováno více protilátek a zda je detekováno opakovaně nebo pouze jednou.[15]
Ženy s trombofilií, které uvažují o těhotenství nebo jsou těhotné, obvykle vyžadují během těhotenství alternativy k warfarinu, zejména v prvních 13 týdnech, kdy může dojít k abnormalitám u nenarozeného dítěte. Nízkomolekulární heparin (LMWH, jako např enoxaparin ) se obecně používá jako alternativa.[37] Warfarin a LMWH lze bezpečně používat při kojení.[37]
Pokud se u žen vyskytne opakovaná ztráta těhotenství sekundárně po trombofilii, některé studie naznačují, že nízkomolekulární heparin snižuje riziko potratu. Pokud jsou výsledky všech studií analyzovány společně, nelze prokázat žádný statisticky významný přínos.[38]
Prognóza
U lidí bez detekovatelné trombofilie je kumulativní riziko vzniku trombózy ve věku 60 let přibližně 12%. Asi 60% lidí s nedostatkem antitrombinu zažije trombózu alespoň jednou ve věku 60 let, stejně jako asi 50% lidí s nedostatkem proteinu C a asi třetina lidí s nedostatkem proteinu S. Lidé s aktivovanou rezistencí na protein C (obvykle vyplývající z faktoru V Leiden) mají naopak mírně zvýšené absolutní riziko trombózy, přičemž 15% mělo alespoň jednu trombotickou příhodu do šedesáti let.[12] Obecně platí, že u mužů je větší pravděpodobnost opakovaných žilních trombóz než u žen.[5]
Lidé s faktorem V Leiden mají relativně nízké riziko trombózy, ale může se u nich vyvinout trombóza za přítomnosti dalšího rizikového faktoru, jako je imobilizace. U většiny lidí s protrombinovou mutací (G20210A) se nikdy neobjeví trombóza.[12]
Epidemiologie
Hlavní („typ 1“) trombofilie jsou vzácné. Nedostatek antitrombinu je přítomen u 0,2% běžné populace a 0,5–7,5% lidí s žilní trombózou. Nedostatek proteinu C je také přítomen u 0,2% populace a lze jej nalézt u 2,5–6% lidí s trombózou. Přesná prevalence deficitu proteinu S v populaci není známa; zjistí se 1,3–5% lidí s trombózou.[12]
Menší ("typ 2") trombofilie jsou mnohem častější. Faktor V Leiden je přítomen u 5% populace severoevropského původu, ale mnohem vzácnější u asijské nebo africké těžby. U lidí s trombózou má 10% faktor V Leiden. U pacientů, kteří jsou doporučeni k testování trombofilie, má defekt 30–50%. Protrombinová mutace se vyskytuje v míře 1–4% v běžné populaci, 5–10% osob s trombózou a 15% osob doporučených k testování trombofilie. Stejně jako faktor V Leiden je tato abnormalita u Afričanů a Asiatů neobvyklá.[12]
Přesná prevalence antifosfolipidového syndromu není dobře známa, protože různé studie používají různé definice stavu. Antifosfolipidové protilátky jsou detekovány u 24% těch, které byly podrobeny testování trombofilie.[15]
Dějiny

Německý lékař Rudolf Virchow kategorizoval abnormality v konzistenci krve jako faktor ve vývoji trombózy v roce 1856. Přesná povaha těchto abnormalit zůstávala nepolapitelná až do první formy trombofilie, nedostatek antitrombinu, byl uznán v roce 1965 norským hematologem Olavem Egebergem.[39] Nedostatek proteinu C následoval v roce 1981, kdy jej popsali vědci z Výzkumný ústav Scripps a USA Centra pro kontrolu nemocí.[40] Nedostatek proteinu S. následovaný v roce 1984, popsaný výzkumníky z University of Oklahoma.[4][5][41]
Antifosfolipidový syndrom byl plně popsán v 80. letech po různých předchozích zprávách o specifických protilátkách u lidí se systémovým lupus erythematodes a trombózou.[15][42] Tento syndrom je často připisován britskému revmatologovi Grahamovi R.V. Hughes, a je často označován jako Hughesův syndrom kvůli tomu důvodu.[43]
Častější genetické trombofilie byly popsány v 90. letech. Mnoho studií již dříve naznačovalo, že mnoho lidí s trombózou vykazovalo rezistencí aktivovaný protein C. V roce 1994 skupina v Leidene „Nizozemsko identifikovalo nejběžnější základní defekt - mutaci faktoru V, která ho činila rezistentním vůči působení aktivovaného proteinu C. Defekt byl nazýván faktor V Leiden, protože genetické abnormality jsou obvykle pojmenovány podle místa, kde jsou objeveny.[44] O dva roky později popsala stejná skupina běžnou mutaci v genu pro protrombin, která způsobila zvýšení hladin protrombinu a mírné zvýšení rizika trombózy.[4][5][45]
Je podezření, že v budoucnu budou objeveny další genetické abnormality, které jsou základem familiární trombózy studie celého genetického kódu, hledat malé alterace v genech.[4][5]
Reference
- ^ A b C d E F G Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). „Kapitola 4“. Robbinsova základní patologie (Osmá ed.). Philadelphia: Saunders. ISBN 978-1-4160-2973-1.
- ^ A b C d E F G h i j k l Heit JA (2007). „Trombofilie: běžné otázky týkající se laboratorního hodnocení a řízení“. Hematology Am. Soc. Hematol. Educ. Program. 2007 (1): 127–35. doi:10.1182 / asheducation-2007.1.127. PMID 18024620.
- ^ A b C d Kyrle PA, Rosendaal FR, Eichinger S (prosinec 2010). "Hodnocení rizik pro opakující se žilní trombózu". Lanceta. 376 (9757): 2032–9. doi:10.1016 / S0140-6736 (10) 60962-2. PMID 21131039. S2CID 31610364.
- ^ A b C d Dahlbäck B (červenec 2008). „Pokrok v porozumění patogenním mechanismům trombofilních poruch“. Krev. 112 (1): 19–27. doi:10.1182 / krev-2008-01-077909. PMID 18574041.
- ^ A b C d E F G Rosendaal FR, Reitsma PH (červenec 2009). „Genetika žilní trombózy“. J. Thromb. Haemost. 7 Suppl 1: 301–4. doi:10.1111 / j.1538-7836.2009.03394.x. PMID 19630821.
- ^ Scarvelis D, Wells PS (říjen 2006). „Diagnostika a léčba hluboké žilní trombózy“. CMAJ. 175 (9): 1087–92. doi:10,1503 / cmaj.060366. PMC 1609160. PMID 17060659.
- ^ Agnelli G, Becattini C (červenec 2010). „Akutní plicní embolie“. N. Engl. J. Med. 363 (3): 266–74. doi:10.1056 / NEJMra0907731. PMID 20592294.
- ^ A b Middeldorp S, van Hylckama Vlieg A (srpen 2008). „Pomáhá testování trombofilie při klinické léčbě pacientů?“. Br. J. Haematol. 143 (3): 321–35. doi:10.1111 / j.1365-2141.2008.07339.x. PMID 18710381.
- ^ A b de Moerloose P, Boehlen F (duben 2007). „Zděděná trombofilie u arteriálních onemocnění: selektivní přehled“. Semin. Hematol. 44 (2): 106–13. doi:10.1053 / j.seminhematol.2007.01.008. PMID 17433903.
- ^ A b Rai R, Regan L (srpen 2006). "Opakovaný potrat". Lanceta. 368 (9535): 601–11. doi:10.1016 / S0140-6736 (06) 69204-0. PMID 16905025. S2CID 42968924.
- ^ A b C d E F G h i Baglin T, Gray E, Greaves M a kol. (Duben 2010). "Klinické pokyny pro testování dědičné trombofilie". Br. J. Haematol. 149 (2): 209–20. doi:10.1111 / j.1365-2141.2009.08022.x. PMID 20128794.
- ^ A b C d E F G h i j k Crowther MA, Kelton JG (2003). „Vrozené trombofilní stavy spojené s žilní trombózou: kvalitativní přehled a navrhovaný klasifikační systém“. Ann. Internovat. Med. 138 (2): 128–34. doi:10.7326/0003-4819-138-2-200301210-00014. PMID 12529095. S2CID 43161448. Shrnutí ležel.
- ^ A b C d E F G h i j Rosendaal FR (2005). „Venózní trombóza: role genů, prostředí a chování“. Hematology Am. Soc. Hematol. Educ. Program. 2005 (1): 1–12. doi:10.1182 / asheducation-2005.1.1. PMID 16304352.
- ^ Mehta R, Shapiro AD (listopad 2008). "Nedostatek plazminogenu". Hemofilie. 14 (6): 1261–8. doi:10.1111 / j.1365-2516.2008.01825.x. PMID 19141167.
- ^ A b C d Ruiz-Irastorza G, Crowther M, pobočka W, Khamashta MA (říjen 2010). "Antifosfolipidový syndrom". Lanceta. 376 (9751): 1498–509. doi:10.1016 / S0140-6736 (10) 60709-X. hdl:2318/1609788. PMID 20822807. S2CID 25554663.
- ^ A b Keeling D, Davidson S, Watson H (květen 2006). „Řízení trombocytopenie vyvolané heparinem“. Br. J. Haematol. 133 (3): 259–69. doi:10.1111 / j.1365-2141.2006.06018.x. PMID 16643427. Archivovány od originál dne 2012-12-10.
- ^ A b Brodsky RA (duben 2008). „Narativní recenze: paroxysmální noční hemoglobinurie: fyziologie hemolytické anémie související s komplementem“. Ann. Internovat. Med. 148 (8): 587–95. CiteSeerX 10.1.1.668.4942. doi:10.7326/0003-4819-148-8-200804150-00003. PMID 18413620. S2CID 19715590.
- ^ Papadakis E, Hoffman R, Brenner B (listopad 2010). "Trombohemoragické komplikace myeloproliferativních poruch". Blood Rev. 24 (6): 227–32. doi:10.1016 / j.blre.2010.08.002. PMID 20817333.
- ^ Prandoni P, Falanga A, Piccioli A (červen 2005). „Rakovina a žilní tromboembolismus“. Lancet Oncol. 6 (6): 401–10. doi:10.1016 / S1470-2045 (05) 70207-2. PMID 15925818.
- ^ Hull RP, Goldsmith DJ (květen 2008). "Nefrotický syndrom u dospělých". BMJ. 336 (7654): 1185–9. doi:10.1136 / bmj.39576.709711.80. PMC 2394708. PMID 18497417.
- ^ Quera R, Shanahan F (říjen 2004). „Tromboembolismus - důležitý projev zánětlivého onemocnění střev“. Dopoledne. J. Gastroenterol. 99 (10): 1971–3. PMID 15447758.
- ^ Abdul Sultan A, West J, Stephansson O, Grainge MJ, Tata LJ, Fleming KM, Humes D, Ludvigsson JF (listopad 2015). „Definice venózního tromboembolismu a měření jeho výskytu pomocí švédských zdravotních registrů: celostátní studie kohorty těhotenství“. BMJ Otevřeno. 5 (11): e008864. doi:10.1136 / bmjopen-2015-008864. PMC 4654387. PMID 26560059.
- ^ Bourjeily G, Paidas M, Khalil H, Rosene-Montella K, Rodger M (únor 2010). „Plicní embolie v těhotenství“. Lanceta. 375 (9713): 500–12. doi:10.1016 / S0140-6736 (09) 60996-X. PMID 19889451. S2CID 8633455.
- ^ Daughety, Molly M .; Samuelson Bannow, Bethany T. (2019). „Hemostáza a trombóza v těhotenství“: 197–206. doi:10.1007/978-3-030-19330-0_30. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Gomes MP, Deitcher SR (říjen 2004). „Riziko žilní tromboembolické nemoci spojené s hormonální antikoncepcí a hormonální substituční terapií: klinický přehled“. Oblouk. Internovat. Med. 164 (18): 1965–76. doi:10.1001 / archinte.164.18.1965. PMID 15477430.
- ^ A b Čajkovskij SN, Rosing J (červenec 2010). "Mechanismy estrogenem indukovaného venózního tromboembolismu". Tromb. Res. 126 (1): 5–11. doi:10.1016 / j.thromres.2010.01.045. PMID 20163835.
- ^ Stein PD, Goldman J (září 2009). „Obezita a tromboembolická nemoc“. Clin. Chest Med. 30 (3): 489–93, viii. doi:10.1016 / j.ccm.2009.05.006. PMID 19700047.
- ^ Borissoff JI, Spronk HM, Heeneman S, ten Cate H (2009). „Je trombin klíčovým hráčem v bludišti„ koagulační aterogeneze “?“. Cardiovasc. Res. 82 (3): 392–403. doi:10.1093 / cvr / cvp066. PMID 19228706.
- ^ Borissoff JI, Spronk HM, ten Cate H (2011). "Hemostatický systém jako modulátor aterosklerózy". N. Engl. J. Med. 364 (18): 1746–1760. doi:10.1056 / NEJMra1011670. PMID 21542745.
- ^ A b C Dalen JE (červen 2008). „Měli by být pacienti s žilní tromboembolií vyšetřováni na trombofilii?“. Dopoledne. J. Med. 121 (6): 458–63. doi:10.1016 / j.amjmed.2007.10.042. PMID 18501222.
- ^ Wu O, Robertson L, Twaddle S a kol. (Říjen 2005). „Screening na trombofilii ve vysoce rizikových situacích: metaanalýza a analýza efektivity nákladů“. Br. J. Haematol. 131 (1): 80–90. doi:10.1111 / j.1365-2141.2005.05715.x. PMID 16173967.
- ^ A b Americká společnost pro hematologii (Září 2013), „Pět věcí, které by lékaři a pacienti měli zpochybňovat“, Moudře vybírat: iniciativa Nadace ABIM, Americká společnost pro hematologii, vyvoláno 10. prosince 2013, který cituje
- Chong, L. -Y .; Fenu, E .; Stansby, G .; Hodgkinson, S .; Guideline Development, G. (2012). „Management venózních tromboembolických onemocnění a role testování trombofilie: Shrnutí pokynů NICE“. BMJ. 344: e3979. doi:10.1136 / bmj.e3979. PMID 22740565. S2CID 42342532.
- Baglin, T .; Gray, E .; Greaves, M .; Hunt, B.J .; Keeling, D .; Machin, S .; MacKie, I .; Makris, M .; Nokes, T .; Perry, D .; Tait, R. C .; Walker, I .; Watson, H .; Britský výbor pro standardy v hematologii (2010). "Klinické pokyny pro testování dědičné trombofilie". British Journal of Hematology. 149 (2): 209–220. doi:10.1111 / j.1365-2141.2009.08022.x. PMID 20128794.
- ^ Hicks LK, Bering H, Carson KR a kol. (2013). „Kampaň ASH Choice Wisely (R): pět hematologických testů a léčby k otázce“. Krev. 122 (24): 3879–83. doi:10.1182 / krev-2013-07-518423. PMID 24307720.
- ^ Simpson EL, MD Stevenson, Rawdin A, Papaioannou D (leden 2009). „Testování trombofilie u lidí s venózním tromboembolismem: systematický přehled a analýza efektivity nákladů“. Health Technol. Posoudit. 13 (2): iii, ix – x, 1–91. doi:10,3310 / hta13020. PMID 19080721.
- ^ Wu O, Greer IA (září 2007). „Je screening trombofilie nákladově efektivní?“. Curr. Opin. Hematol. 14 (5): 500–3. doi:10.1097 / MOH.0b013e32825f5318. PMID 17934357. S2CID 22896788.
- ^ Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ (červen 2008). „Antitrombotická léčba žilní tromboembolické nemoci: Pokyny klinické praxe založené na důkazech American College of Chest Physicians Evidence (8. vydání)“. Hruď. 133 (6 doplňků): 454S – 545S. doi:10,1378 / hrudník.08-0658. PMID 18574272. Archivovány od originál dne 12. 1. 2013.
- ^ A b Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J (červen 2008). „Venózní tromboembolismus, trombofilie, antitrombotická léčba a těhotenství: Pokyny pro klinickou praxi založené na důkazech American College of Chest Physicians Evidence (8. vydání)“. Hruď. 133 (6 doplňků): 844S - 886S. doi:10,1378 / hrudník.08-0761. PMID 18574280. Archivovány od originál dne 12. 1. 2013.
- ^ Skeith L, Carrier M, Kaaja R, Martinelli I, Petroff D, Schleußner E, Laskin CA, Rodger MA (2016). „Metaanalýza nízkomolekulárního heparinu k prevenci ztráty těhotenství u žen se zděděnou trombofilií“. Krev. 127 (13): 1650–55. doi:10.1182 / krev-2015-12-626739. PMID 26837697.
- ^ Egeberg O (červen 1965). "Zděděný nedostatek antitrombinu způsobující trombofilii". Tromb. Diath. Krvácení. 13 (2): 516–30. doi:10.1055 / s-0038-1656297. PMID 14347873.
- ^ Griffin JH, Evatt B, Zimmerman TS, Kleiss AJ, Wideman C (listopad 1981). „Nedostatek proteinu C u vrozeného trombotického onemocnění“. J. Clin. Investovat. 68 (5): 1370–3. doi:10.1172 / JCI110385. PMC 370934. PMID 6895379.
- ^ Comp PC, Esmon CT (prosinec 1984). „Recidivující žilní tromboembolismus u pacientů s částečným nedostatkem proteinu S“. N. Engl. J. Med. 311 (24): 1525–8. doi:10.1056 / NEJM198412133112401. PMID 6239102.
- ^ Hughes GR (říjen 1983). „Trombóza, potraty, mozkové choroby a antikoagulant lupusu“. Br. Med. J. (Clin. Res. Ed.). 287 (6399): 1088–89. doi:10.1136 / bmj.287.6399.1088. PMC 1549319. PMID 6414579.
- ^ Sanna G, D'Cruz D, Cuadrado MJ (srpen 2006). "Mozkové projevy v antifosfolipidovém (Hughesově) syndromu". Rheum. Dis. Clin. North Am. 32 (3): 465–90. doi:10.1016 / j.rdc.2006.05.010. PMID 16880079.
- ^ Bertina RM, Koeleman BP, Koster T a kol. (Květen 1994). "Mutace v krevním koagulačním faktoru V spojená s rezistencí na aktivovaný protein C". Příroda. 369 (6475): 64–7. Bibcode:1994Natur.369 ... 64B. doi:10.1038 / 369064a0. PMID 8164741. S2CID 4314040.
- ^ Poort SR, Rosendaal FR, Reitsma PH, Bertina RM (listopad 1996). „Běžná genetická variace v 3'-nepřekládané oblasti protrombinového genu je spojena se zvýšenými plazmatickými hladinami protrombinu a zvýšením žilní trombózy“ (PDF). Krev. 88 (10): 3698–703. doi:10.1182 / krev.V88.10.3698.bloodjournal88103698. PMID 8916933.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
- "Trombofilie". Pacient UK.
