Syntáza kyseliny aminolevulové - Aminolevulinic acid synthase
| 5-aminolevulinát syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dimer syntázy kyseliny aminolevulové, Rhodobacter capsulatus | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.3.1.37 | ||||||||
| Číslo CAS | 9037-14-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Syntáza kyseliny aminolevulové (ALA syntáza, BĚDAnebo syntáza kyseliny delta-aminolevulinové) je enzym (ES 2.3.1.37 ), který katalyzuje syntézu kyselina 8-aminolevulinová (ALA), první společný předchůdce biosyntézy všech tetrapyrroly jako jsou hemes, kobalaminy a chlorofyly.[1] Reakce je následující:
- sukcinyl-CoA + glycin kyselina 8-aminolevulinová + CoA + CO2
Tento enzym je exprimován ve všech rostlinných eukaryotech a třídě α proteobakterií a reakce, kterou katalyzuje, se někdy označuje jako Sheminova cesta pro tvorbu ALA.[2] Jiné organismy produkují ALA cestou tří enzymů známou jako dráha C5. ALA se syntetizuje kondenzací glycin a sukcinyl-CoA. U lidí je transkripce ALA syntázy přísně kontrolována přítomností Fe2+ - vazebné prvky, aby se zabránilo hromadění porfyrinových meziproduktů v nepřítomnosti železa. V těle existují dvě formy ALA syntázy. Jedna forma je exprimována v prekurzorových buňkách červených krvinek (ALAS2 ), zatímco ostatní (ALAS1 ) je všudypřítomně vyjádřen v celém těle. Forma červených krvinek je kódována genem na chromozomu x, zatímco druhá forma je kódována genem na chromozomu 3.
Nemoc souvisí s X. sideroblastická anémie je způsoben mutacemi v genu ALA syntázy na chromozomu X, zatímco není známo, že by onemocnění bylo způsobeno mutacemi v jiném genu. Ukázalo se, že v poslední době bylo prokázáno, že zvýšení funkčních mutací v erytroidně specifickém genu ALA syntázy způsobuje dříve neznámou formu porfyrie známou jako X-vázaná dominantní protoporfyrie.
Struktura a vlastnosti enzymu
Enzymy závislé na PLP převládají, protože jsou potřebné k transformaci aminokyselin na jiné zdroje.[1] ALAS je homodimer s podobně velkými podjednotkami a aktivní místa skládající se z postranních řetězců aminokyselin, jako je arginin, threonin a lysin, existují na rozhraní subunity.[1] Protein extrahovaný z R. sféroidů obsahuje 1600krát a váží asi 80 000 daltonů.[3] Enzymatická aktivita se u různých zdrojů enzymu liší.[3]
Reakční mechanismus
Aktivní místa ALAS využívají tři klíčové aminokyselinové postranní řetězce: Arg-85 a Thr-430 a Lys-313. Ačkoli byly identifikovány tyto tři aminokyseliny, které umožňují tuto reakci pokračovat, byly by neaktivní bez přidání kofaktoru pyridoxal 5’-fosfátu (PLP), jehož role v této syntéze je podrobně uvedena na obrázku níže. Než může reakce začít, váže se kofaktor PLP na postranní řetězec lysinu za vzniku Schiffovy báze, která podporuje útok glycinovým substrátem.[4][5][6][7] Lysin působí během tohoto mechanismu jako obecná báze.[1][8] V podrobném reakčním mechanismu pocházejí přidané atomy hydronia z různých zbytků, které nabízejí vodíkové vazby k usnadnění syntézy ALA.[1]ALA syntáza odstraní karboxyl skupina z glycinu a CoA ze sukcinyl-CoA prostřednictvím své protetické skupiny pyridoxal fosfát (derivát vitaminu b6), tvořící kyselinu δ-aminolevulinovou (dALA), tzv. protože amino skupina je na čtvrtém atomu uhlíku v molekule. Tento reakční mechanismus je zvláště jedinečný ve srovnání s jinými enzymy, které používají kofaktor PLP, protože glycin je zpočátku deprotonován vysoce konzervovaným aktivním lysinem, což vede ke kondenzaci se sukcinyl-CoA a ztrátě CoA. Protonace karbonylové skupiny meziproduktu aktivním místem histidinu vede ke ztrátě karboxylové skupiny. Poslední meziprodukt je nakonec reprotonován k produkci ALA. Disociace ALA z enzymu je krok omezující rychlost enzymatické reakce a bylo prokázáno, že závisí na pomalé konformační změně enzymu. Funkce pyridoxal fosfát je usnadnit odstranění vodíku využitím elektrofilní pyridinium prsten jako jímka elektronů.
Umístění tohoto enzymu v biologických systémech svědčí o zpětné vazbě, kterou může obdržet. ALA syntáza byla nalezena v bakteriích, kvasinkách, ptačích a savčích játrech a krevních buňkách a kostní dřeni. Umístění tohoto enzymu ve zvířecích buňkách je v mitochondriích.[3] Jelikož se zdá, že se enzym nachází poblíž zdroje sukcinyl-CoA a konec hemové dráhy naznačuje, že výchozí a koncový bod biosyntézy hemu slouží jako zpětná vazba pro ALA syntázu.[3] ALA syntáza je také inhibována hemin a glukóza.[9]

Biologická funkce
ALAS1 a ALAS2 katalyzují první krok v procesu syntézy hemu. Je to první nevratný krok a také omezuje rychlost. To znamená, že začátek tvorby lemů je velmi úmyslný a podléhá různým oblastem zpětné vazby. Například dva substráty, oxaloacetát a glycin, jsou vysoce produkovány a využívány v dalších základních biologických procesech, jako je glykolýza a TCA cyklus. Obrázek níže ilustruje cestu syntézy hemu a roli, kterou hraje ALAS.
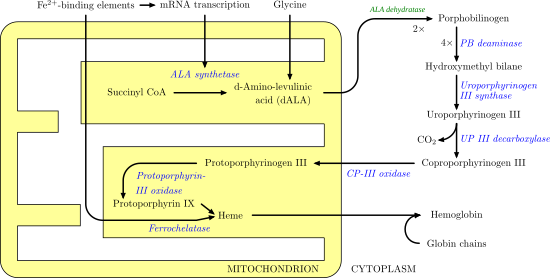
Relevance nemoci
Nedostatek syntázy aminolevulinové kyseliny má za následek nedostatečnou schopnost vytvářet hem, protože jeho úkolem je katalyzovat první krok procesu. Tyto nedostatky jsou často výsledkem genetické mutace, která může vést k řadě nemocí. Jedním z takových onemocnění je x-vázaná sideroblastická anémie, která vede k výskytu červených krvinek v kostní dřeni.[10] Toto onemocnění je spojeno konkrétně s mutacemi v genech, které kódují ALAS2.[10]
Reference
- ^ A b C d E Hunter, Gregory A .; Ferreira, Gloria C. (listopad 2011). „Molekulární enzymologie 5-aminolevulinát syntázy, strážce biosyntézy hemu“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1814 (11): 1467–1473. doi:10.1016 / j.bbapap.2010.12.015. PMC 3090494. PMID 21215825.
- ^ Shemin, David; Rittenberg, D (18. června 1945). "Využití glycinu pro syntézu porfyrinu". Journal of Biological Chemistry. 159: 567–568.
- ^ A b C d Beale, S I (červen 1978). „Kyselina δ-aminolevulinová v rostlinách: její biosyntéza, regulace a role ve vývoji plastidů“. Roční přehled fyziologie rostlin. 29 (1): 95–120. doi:10.1146 / annurev.pp.29.060178.000523.
- ^ „ALA syntáza“. flipper e nuvola. Turínská univerzita. Citováno 10. března 2016.
- ^ Shoolingin-Jordan, Peter M .; Al-Daihan, Sooad; Alexejev, Dmitrij; Baxter, Robert L .; Bottomley, Sylvia S .; Kahari, I.Donald; Roy, Ipsita; Sarwar, Muhammad; Sawyer, Lindsay; Wang, Shu-Fen (duben 2003). "Syntáza kyseliny 5-aminolevulové: mechanismus, mutace a medicína". Biochim Biophys Acta. 1647 (1–2): 361–6. doi:10.1016 / s1570-9639 (03) 00095-5. PMID 12686158.
- ^ CHOI, H (červenec 2004). „Klonování, exprese a charakterizace syntázy kyseliny 5-aminolevulinové z Rhodopseudomonas palustris KUGB306“. Mikrobiologické dopisy FEMS. 236 (2): 175–181. doi:10.1016 / j.femsle.2004.05.048. PMID 15251194.
- ^ Ferreira, Gloria C .; Neame, Peter J .; Dailey, Harry A. (listopad 1993). „Hémová biosyntéza v savčích systémech: Důkazy o schiffové vazbě báze mezi pyridoxal 5'-fosfátovým kofaktorem a lysinovým zbytkem v 5-aminolevulinát syntáze“. Věda o bílkovinách. 2 (11): 1959–1965. doi:10.1002 / pro.5560021117. PMC 2142290. PMID 8268805.
- ^ Hunter, Gregory A .; Ferreira, Gloria C. (březen 1999). „Lysin-313 z 5-aminolevulinátsyntázy působí jako obecná báze během tvorby meziproduktů chinonoidní reakce“. Biochemie. 38 (12): 3711–3718. doi:10.1021 / bi982390w. PMID 10090759.
- ^ Doss M, Sixel-Dietrich F, Verspohl F (1985). ""Účinek glukózy „a rychlost omezující funkce uroporfyrinogen syntázy na metabolismus porfyrinu v kultuře hepatocytů: vztah s lidskými akutními jaterními porfyriemi“ (PDF). J Clin Chem Clin Biochem. 23 (9): 505–13. doi:10,1515 / cclm.1985.23.9.505. PMID 4067519.
- ^ A b Ajioka, Richard S .; Phillips, John D .; Kushner, James P. (Červenec 2006). "Biosyntéza hemu u savců". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1763 (7): 723–736. doi:10.1016 / j.bbamcr.2006.05.005. PMID 16839620.
externí odkazy
- NIH
- Abu-Farha M, Niles J, Willmore W (2005). „Erythroid-specifický 5-aminolevulinát syntázový protein je stabilizován nízkou kyslíkovou a proteazomální inhibicí“. Biochem Cell Biol. 83 (5): 620–30. doi:10.1139 / o05-045. PMID 16234850.
- Shemin, D; Rittenberg, D (1945). „Využití glycinu pro syntézu porfyrinu“. J. Biol. Chem. 159: 567–8.
- Nemoc defektu SIDEROBLASTICKÉ ANEMIAS -ALAS-2


