Thymidinkináza v klinické chemii - Thymidine kinase in clinical chemistry
Thymidinkináza je enzym, a fosfotransferáza (A kináza ): 2'-deoxythymidinkináza, ATP-thymidin 5'-fosfotransferáza, EC 2.7.1.21 [1][2] který katalyzuje reakci:
Čt + ATP → TMP + ADP
kde Thd je (deoxy) thymidin, ATP je adenosin 5’-trifosfát, TMP je (deoxy) thymidin 5’-fosfát a ADP je adenosin 5’-difosfát. V klinické chemii byl navržen jako proliferační marker pro prognózu, ověření diagnózy, kontrolu léčby (zejména jako doprovodnou diagnostiku) a sledování maligního onemocnění. Používá se hlavně ve vztahu k hematologickým malignitám, ale vývoj citlivějších testů podnítil vyšetřování jeho použití ve vztahu k solidním nádorům.
Dějiny
Začlenění thymidinu do DNA bylo prokázáno kolem roku 1950.[3] O něco později se ukázalo, že tomuto začlenění předcházela fosforylace[4] a kolem roku 1960 byl odpovědný enzym purifikován a charakterizován.[5][6] Potenciální použití jako nádorového markeru navrhli Gronowitz a kol.[7]
Biochemie
Savci mají dva izoenzymy, které jsou chemicky velmi odlišné, thymidinkináza 1 (TK1) a thymidinkináza 2 (TK2). První byl poprvé nalezen ve fetální tkáni, druhý byl shledán hojnějším v dospělé tkáni, a tak se zpočátku označovaly jako fetální a dospělé thymidinkinázy. Brzy se ukázalo, že TK1 je v cytoplazmě přítomen pouze v očekávání buněčného dělení (závislé na buněčném cyklu)[8][9] zatímco přítomnost TK2, která se nachází v mitochondriích, je nezávislá na buněčném cyklu.[10][11]TK1 je buňkou syntetizován během S fáze buněčného dělení. Po dokončení buněčného dělení je TK1 degradován intracelulárně, takže po normálním dělení buněk neprochází do tělesných tekutin.[12] Enzym TK navrhl jako a nádorový marker je cytosolický buněčný cyklus závislý na TK1. Je přítomen během buněčného dělení v mnohem vyšších koncentracích než TK2 a uvolňuje se v množství, které zcela dominuje aktivitě thymidinkinázy v krvi a jiných tělesných tekutinách.
Kromě buněčných TK byly virově specifické thymidinkinázy identifikovány u viru Herpes simplex, viru Varicella zoster a viru Epstein-Barr.[13][14][15][16][17][18][19] Biochemicky se liší od thymidinkinázy z buněk savců a jsou inhibovány specifickými inhibitory, které neovlivňují aktivitu savčích thymidinkináz. Stanovení virové thymidinkinázy bylo navrženo pro potvrzení diagnózy a pro kontrolu léčby virových infekcí.
 + ATP --->
+ ATP ---> 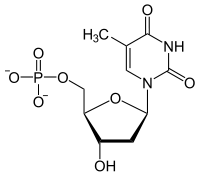 + ADP
+ ADP
Thymidin reaguje s ATP za vzniku thymidinmonofosfátu a ADP.
Fyziologický kontext
Thymidin monofosfát, produkt reakce katalyzovaný thymidinkinázou, je zase fosforylovaný na thymidindifosfát enzymem thymidylát kináza a dále do thymidin trifosfát enzymem nukleosid difosfát kináza. Trifosfát je obsažen v a DNA molekula, reakce katalyzovaná a DNA polymeráza a a komplementární DNA molekula (nebo RNA molekula v případě reverzní transkriptáza, enzym přítomný v retrovirus ). Thymidinmonofosfát je buňkou produkován ve dvou různých reakcích - buď fosforylace z thymidin jak je popsáno výše nebo methylace z deoxyuridin monofosfát, enzym, produkt jiných metabolických drah, které nesouvisí s thymidinem thymidylát syntáza (De novo syntéza). Tuto druhou cestu používá buňka za normálních podmínek a je dostatečná k dodání thymidinmonofosfátu pro opravu DNA. Když se buňka připraví na rozdělení, je zapotřebí úplné nové uspořádání DNA a zvyšuje se požadavek na stavební kameny, včetně thymidin trifosfátu. Buňky se připravují na dělení buněk tím, že produkují některé z enzymů potřebných během dělení. Normálně nejsou přítomny v buňkách a jsou následně regulovány a degradovány. Takovým enzymům se říká záchranné enzymy. Thymidinkináza 1 je takový záchranný enzym, zatímco thymidinkináza 2 není závislá na buněčném cyklu.[20][21][22][23][24][25][26][27][28]
Thymidinkináza v séru
Pozadí
Thymidinkináza je záchranný enzym, který je přítomen pouze v očekávání buněčného dělení. Enzym není uvolňován z buněk podstupujících normální dělení, kde mají buňky speciální mechanismus k degradaci proteinů, které již nejsou po dokončení dělení buněk zapotřebí.[9] U normálních subjektů je proto množství thymidinkinázy v séru nebo plazmě velmi nízké. Nádorové buňky uvolňují enzym do oběhu, pravděpodobně v souvislosti s narušením odumřelých nebo umírajících nádorových buněk. Hladina thymidinkinázy v séru proto slouží jako míra maligní proliferace a nepřímo jako míra agresivity nádoru. Forma enzymu přítomného v oběhu neodpovídá proteinu kódovanému genem: gen odpovídá proteinu s molekulovou hmotností kolem 25 kD. Jedná se o dimer s molekulovou hmotností kolem 50 kD, pokud je aktivován ATP, tetramer s molekulovou hmotností kolem 100 kD.[29] Hlavní frakce aktivního enzymu v oběhu má molekulovou hmotnost 730 kD a je pravděpodobně vázána v komplexu na jiné proteiny.[30]
Měření
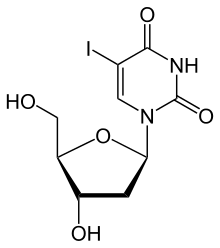
Hladiny thymidinkinázy 1 (TK1) v sérum nebo plazma mohou být měřeny na základě jejich enzymatické aktivity nebo z hlediska hmotnosti pomocí imunotestů. V testech enzymové aktivity se to provádí inkubací vzorku séra s analogem substrátu. Nejstarší komerčně dostupná technika používá joddeoxyuridin (idoxuridin ) kde methylová skupina v thymidinu byla nahrazena radioaktivním jodem.[31][32][33] Tento substrát je enzymem dobře přijímán. Monofosfát joddeoxyuridinu je adsorbován na oxidu hlinitém, který je suspendován v inkubačním médiu. Po dekantaci a promytí dává radioaktivita oxidu hlinitého míru množství thymidinkinázy ve vzorku. Soupravy využívající tento princip jsou komerčně dostupné od společností Immunotech / Beckman a DiaSorin.
Neradioaktivní metoda stanovení byla vyvinuta společností Dia-Sorin. V této technice 3'-azido-2 ', 3'-deoxythymidin (Zidovudin, AZT) se nejprve fosforyluje na AZT 5'-monofosfát (AZTMP) pomocí TK1 ve vzorku. AZTMP se měří v imunotest s anti-AZTMP protilátkami a AZTMP-značené peroxidáza. Stanovení probíhá v uzavřeném systému na laboratorní robot od DiaSorin.[34][35] Stanovení DiviTum od společnosti Biovica International používá další analog thymidinu, bromodeoxyuridin jako substrát pro enzym. Produkt reakce se dále fosforyluje na trifosfát a začlení se do řetězců DNA polythymidinu. Polythymidin se váže na řetězce polyadeninu navázané na dno jamek na mikrotitračních destičkách. Tam je detekován pomocí ELISA technika: Jamky jsou naplněny roztokem a monoklonální protilátka na brom-deoxyuridin. Monoklonální protilátka byla navázána (konjugována) na enzym alkalická fosfatáza. Po odplavení nenavázaného konjugátu protilátky se přidá roztok substrátu k alkalické fosfatáze, para-nitrofenylfosfát, je přidáno. Produkt reakce, para-nitrofenol, je žlutá při alkalickém pH a lze ji měřit pomocí fotometrie.[36] Tato metoda byla hodnocena oproti předchozí radioaktivní technice. Je podstatně citlivější než předchozí enzymatické metody, a proto může být vhodnější pro použití u solidních nádorů, kde se v tělních tekutinách nachází nižší zvýšení TK1. Byly publikovány srovnání metod.[37][38] Ve studii Nisman et al.,[37] zatímco Divitum bylo celkově citlivější než Liaisonova metoda, autoři navrhli, že Liaisonova metoda mohla být citlivější pro formy TK1 nalezené u normálních subjektů. Nedávno byla zveřejněna kontinuální a homogenní fluorescenční metoda založená na technologii zhášení. Tato technika využívá jako substrát přírodní thymidin a může také stanovit deoxycytidinkinázu současně s TK1.[39]
Nyní byly vyvinuty imunotesty umožňující přímé stanovení proteinu TK1.[40][41][42] Imunologické testy mají oproti metodám enzymové aktivity výhody v tom, že mohou měřit izoformy TK1, které jsou enzymaticky neaktivní, a navíc nejsou ovlivněny inhibitory TK1 v séru.[41] Specifická aktivita séra TK1 se u různých typů rakoviny liší[43] a použití metody imunotestu může pomoci při srovnání hladin TK1 mezi subjekty a typy malignity. Kvůli základním rozdílům v testovacích metodách se mohou výsledky získané při testech aktivity TK1 a imunotestech lišit, např. test ELISA založený na protilátkách proti epitopu TK1 TK 210 byl dvakrát odlišnější než test aktivity TK1 při rozlišování mezi zdravými ženami a subjekty s rakovinou prsu[44]
Byly vyvinuty dva imunotesty proti exponovanému epitopu „210“ pokrývajícímu C-koncovou aminokyselinovou sekvenci 194-225,[45] přímý dot-blot test s koncovým bodem chemiluminiscence[46] a mikrotitrační sendvič ELISA.[44] Dot-blot test je test na bázi nitrocelulózové membrány s chemiluminiscenčním substrátem využívající primární kuřecí IgY protilátku a sekundárně značenou anti-IgY protilátku. Stručně řečeno, vzorek je nanesen na nitrocelulózovou membránu, kde se váží proteiny ve vzorku. Po blokování je membrána inkubována s primární anti-TK1 protilátkou, která se váže na TK1 na membráně. Po promytí se přidá biotinylovaná druhá protilátka namířená proti IgY protilátkám, následovaná streptavidinem značeným HRP a chemiluminiscenčním substrátem. Mikrotitrační ELISA na základě monoklonálních protilátek namířených proti epitopu „210“ je k dispozici od společnosti AroCell. Systém AroCell TK 210 ELISA používá pufr pro předúpravu k rozrušení vysokomolekulárních komplexů TK1 a vystavení epitopu TK 210. Ošetřené vzorky se přidají na mikrotitrační destičku potaženou anti TK 210 monoklonálními protilátkami. Po inkubaci a promytí se přidá druhá anti-TK 210 protilátka značená biotinem. Po dalším promytí se barva vyvolá streptavidinem značenou křenovou peroxidázou s TMP jako substrátem.
Byl popsán mikročipový elektroforetický imunoafinitní test pro stanovení koncentrace thymidinkinázy v séru. Jeho funkce byla demonstrována použitím rekombinantního TK1. Tvrdí se, že je rychlý a snadno proveditelný.[47]
Sérová thymidinkináza 1 u různých malignit
Hematologické malignity
Nejdramatičtější zvýšení sérového TK1 lze pozorovat u hematologické malignity. Zvýšení pozorované v aktivitě i koncentraci TK1 je větší u hematologických malignit ve srovnání se solidními nádory.[43][48]
Non-Hodgkinův lymfom
Hlavní použití testů aktivity TK1 v séru je v non-Hodgkinův lymfom. Toto onemocnění má širokou škálu agresivity, od pomalu rostoucího indolentního onemocnění, které sotva vyžaduje léčbu, až po vysoce agresivní a rychle rostoucí formy, které by měly být léčeny urgentně. To se odráží v hodnotách aktivity TK1 v séru, které se pohybují od blízkého normálnímu rozsahu pro pomalu rostoucí nádory až po velmi vysoké hladiny pro rychle rostoucí formy.[7][49][50][51][52][53][54][55][56][57][58][59]
Leukemias
Leukemias normálně nepředstavují zásadní diagnostické potíže, protože mikroskopická analýza buněk v krvi obvykle poskytuje jednoznačné výsledky. Testy TK1 však mohou poskytnout doplňující informace o agresivitě a riziku progrese.[60][61][62][63][64][65][66][67]
Myelom
Taky myelomy často představují diagnostickou výzvu. Maligní buňky často nejsou k dispozici pro mikroskopickou analýzu a prognóza je často nejistá. Informace o prognóze proto mohou být při rozhodování o léčbě zásadní. Několik studií ověřuje úzkou souvislost mezi prognózou a aktivitou thymidinkinázy v myelomech.[38][68][69]
Myelodysplastický syndrom
Velmi zajímavým případem je myelodysplastický syndrom: Některé rychle přecházejí na akutní leukémii, zatímco jiné zůstávají po dlouhou dobu lhostejné. Pro léčbu je důležitá identifikace osob, které mají sklon ke změně na zjevnou leukémii. U myelodysplastického syndromu byl prokázán vztah mezi prognózou a hodnotami TK1 v séru.[70][71]
Pevné nádory
Zvýšené hladiny TK1 v séru lze nalézt u subjektů se solidními nádory. Zvýšení hladin aktivity TK1 v séru u subjektů se solidními nádory není tak velké jako u hematologických malignit. První metody pro stanovení aktivity TK1 v séru měly omezenou citlivost. V případě metod využívajících radioaktivitu bylo jedním z důvodů to, že množství radioaktivity povolené zákonem v normálních radioimunoanalytických laboratořích je přísně omezeno. Experimentální metoda, kterou poprvé vyvinuli Gronowitz a kol.[31] použité množství radioizotopu mnohem vyšší než množství použité v komerčních radioanalýzách, a proto byla senzitivita dostatečná k detekci zvýšení sérové TK1 u subjektů se solidními nádory. U komerčních radioanalýz to bylo obtížné a výsledky nebyly příliš přesvědčivé. Citlivější neradioaktivní techniky později umožnily přesné měření nižších přírůstků solidních nádorů. Nižší koncentrace TK1 a nižší specifická aktivita TK1 nalezené v solidních nádorech mohou učinit imunotesty TK1 vhodnějšími.[46][44]
Rakovina plic
Rakovina plic je jednou z nejčastějších potíží, a to jak incidencí (asi 15% u mužů i žen v USA a v Evropě), tak podle úmrtnosti (25% u žen a 30% u mužů). Jedním z hlavních důvodů, proč je úmrtnost vyšší než incidence, je to, že rakovina plic je většinou detekována a diagnostikována v pozdním stadiu. Včasné odhalení by mohlo snížit úmrtnost. Dalším důvodem je, že rakovina plic, zejména malobuněčný karcinom plic, je velmi agresivní a má velmi nízkou míru přežití 5 let.
Existuje několik zpráv o užitečnosti měření aktivity TK1 v séru u rakoviny plic.[72][73][74][75][76] Pro diagnostiku může být obzvláště cenná kombinace imunotestu TK1 s jinými biomarkery[77] zatímco poklesy koncentrace TK1 po terapii mohou poskytnout prognostické informace.[78]
Rakovina prsu
Rakovina prsu je nejčastější rakovinou u žen podle výskytu (asi 25% případů rakoviny v USA a Evropě) a druhou největší podle úmrtnosti (asi 15%). Důvodem tohoto rozdílu je pokrok během poslední dekády v léčbě případů rakoviny prsu a především povědomí veřejnosti, které umožnilo dřívější diagnostiku. Jedním z přispívajících faktorů je rozšířené používání mamografie pro včasnou detekci, druhým je samovyšetření.
Mnoho nádorových markerů včetně TK1 se používá pro sledování a detekci recidiv u pacientek s rakovinou prsu.[37][79][80][81][82][83][84] Imunologické testy mohou být pro detekci forem TK1 nalezených v séru pacientů s rakovinou prsu citlivější než testy enzymové aktivity.[44] Pro diagnostiku je kombinace testů TK1 s jinými biomarkery, např. CA 15-3, může být obzvláště cenné.[44]
Rakovina prostaty
Mezi muži rakovina prostaty je zdaleka nejběžnější formou rakoviny a tvoří přibližně 25% z celkového výskytu rakoviny u mužů v USA a Evropě. Úmrtnost je mnohem nižší, než by se dalo očekávat z výskytu, přibližně 10% z celkové úmrtnosti na rakovinu u mužů v USA a Evropě. Hlavním důvodem nižší úmrtnosti je to, že mnoho rakovin prostaty roste pomalu, takže pacienti nezemřou na tuto rakovinu, ale z jiných nesouvisejících důvodů.
Při léčbě rakoviny prostaty je proto velmi důležité umět rozlišovat mezi pomalu a rychle rostoucími druhy rakoviny. Thymidinkináza byla navržena jako doplněk k PSA (prostatický specifický antigen), což je nádorový marker nejčastěji používaný u rakoviny prostaty. Zatímco se má za to, že PSA indikuje hmotnost nádoru, aktivita thymidinkinázy indikuje rychlost proliferace a markery se tak navzájem doplňují.[85][86][87][88]
Jiné solidní nádory
Zvýšení TK1 bylo také hlášeno ve spojení s mnoha typy solidních nádorů, včetně:
rakovina ledvin,[89] rakovina močového měchýře,[90] rakovina žaludku,[91][92][93] rakovina jater,[94] neurologické rakoviny[95] a melanom.[96] Rakoviny vaječníků, děložního čípku a jícnu.[97]
Nezhoubné výšky
Existuje několik nezhoubných příčin zvýšení thymidinkinázy v séru, včetně nedostatku vitaminu B12, což vede k perniciózní anémie[98][99] virové infekce (zejména virem z herpes skupina ) [100][101][99] a hojení ran po traumatu a operaci.
Thymidinkináza u domácích zvířat
Existují také zprávy o použití thymidinkinázy jako nádorového markeru u domácích zvířat, u koní,[102] u psů[34][103][104][105][106][107] u koček[108] a u krav.[109] Rovněž byla hlášena zvýšení u psů s bakteriálními infekcemi.[110]
Thymidinkináza v tkáni
Thymidinkináza byla stanovena ve vzorcích tkáně po extrakci tkáně a byla prokázána souvislost mezi výsledky a progresí onemocnění. Nebyla však vyvinuta žádná standardní metoda pro extrakci ani pro stanovení a stanovení TK v extraktech z buněk a tkání nebylo validováno ve vztahu ke konkrétní klinické otázce, viz nicméně Arnér et al.[111] Romain a kol.[112] a Alegre a kol.[113]
Ve studiích uvedených níže jsou použité metody a způsob uvádění výsledků natolik odlišné, že srovnání mezi různými studiemi není možné.
Hladiny TK1 ve fetálních tkáních během vývoje jsou vyšší než hladiny odpovídajících tkání později.[114][115][116][117]
Některá nezhoubná onemocnění také vedou k dramatickému zvýšení hodnot TK v buňkách a tkáních: v periferních lymfocytech během monocytózy[118] a v kostní dřeni během perniciózní anémie.[119][120] Protože TK1 je přítomný v buňkách během dělení buněk, je rozumné předpokládat, že aktivita TK v maligní tkáni by měla být vyšší než v odpovídající normální tkáni. To je také potvrzeno ve většině studií: vyšší aktivita TK se nachází v neoplastických než v normální tkáni,[115][121][122][123] v mozkových nádorech,[124] při hematologických malignitách,[125] u rakoviny a polypů v tlustém střevě,[126][127][128][129][130][131] u rakoviny prsu,[132][133][134][135][136][137] u rakoviny plic,[138][139][140] při rakovině žaludku,[141] u rakoviny vaječníků,[142] v mezoteliomu,[143] v melanomech,[144] u nádorů štítné žlázy[145][146] při leukémii[147] a v rakovině prsu.[148]
Terapie, která ovlivňuje rychlost buněčné proliferace, odpovídajícím způsobem ovlivňuje hodnoty TK. Ačkoli to většina studií neukazuje, je pravděpodobné, že rozdíly mezi vzorky ze zdravé tkáně a vzorky z nádorové tkáně primárně představují změny v hladinách TK1, protože tento enzym je mnohem silněji spojen s buněčnou proliferací než TK2.
Byla vyvinuta metoda pro specifické stanovení TK2 v buněčných extraktech s použitím substrátového analogu 5-bromvinyl 2'-deoxyuridinu.[117]
Použití stanovení thymidinkinázy
Značky nádorů lze použít pro následující účely
- Promítání buď pro specifické druhy rakoviny, nebo obecně pro maligní růst. Brzy byl navržen široký screening na všechny nebo většinu typů rakoviny[149][150] ale od té doby se ukázalo, že to není realistický cíl. Screening konkrétních typů nebo míst rakoviny vyžaduje úroveň specificity a citlivosti, které u nádorových markerů bylo dosud dosaženo pouze u PSA.[151] Thymidinkináza nedosahuje ani klinické citlivosti, ani klinické specificity, která by byla užitečná pro účely screeningu, viz nicméně Huang et al.,[152] Xiang a kol.[153] a Cao a kol.[154]
- Monitorování přeživších po léčbě, detekce opakující se nemoc je nejčastější použití nádorové markery včetně thymidinkinázy, která se používá jako standardní metoda pro sledování hematologických poruch, zejména lymfomu, ale je také studována pro monitorování solidních nádorů.
- Diagnóza specifických typů nádorů. Typy nádorů, které jsou zajímavé pro thymidinkinázu, jsou diagnostikovány jinými technikami než měřením nádorových markerů.
- Potvrzení diagnózy ověřit vlastnosti jako velikost a agresivita nádoru a tím pomoci při vyhodnocení vhodného léčebného plánu bylo ověřeno jako vhodná aplikace stanovení thymidinkinázy pro několik typů nádorů. Thymidinkináza byla potvrzena jako cenný nástroj k ověření agresivity jak hematologických nádorů (zejména non-Hodgkinova lymfomu), tak karcinomu prostaty.
- Inscenace: bylo navrženo zahrnutí thymidinkinázy do stagingových kritérií pro non-Hodgkinův lymfom [63]
- Prognóza: Ukázalo se, že thymidinkináza je důležitým prognostickým parametrem zejména u hematologických malignit (lymfom a leukémie).
- Ověření účinku léčby je důležité použití thymidinkinázy. Protože tento nádorový marker reaguje spíše na aktivitu nádoru než na hmotu nádoru, poskytuje velmi časnou indikaci účinku léčby.
- A doprovodná diagnostika se používá k ověření, zda je léčba vhodná pro typ nebo podtyp nádoru, zejména v personalizovaná medicína. Silná vazba exprese TK1 na buněčný cyklus poskytuje speciální důvody pro vyšetřování thymidinkinázy jako markeru účinku inhibitorů na cyklin-dependentní kinázy. Tyto inhibiční sloučeniny představují slibné nové terapie rakoviny. Cyklin-dependentní kinázy podporují přechod buněčným cyklem a inhibitory cyklin-dependentních kináz jsou určeny k zastavení přechodu do S fáze buněčného cyklu, kde je syntetizována thymidinkináza. Sérová TK aktivita je proto nyní zahrnuta jako biomarker do klinických studií s těmito inhibičními sloučeninami.[155]
Viz také
Další čtení
- O'Neill KL, Buckwalter M, Murray BK (2001). "Thymidinkináza: diagnostický a prognostický potenciál". Expert Rev. Mol. Diagn. 1 (4): 428–33. doi:10.1586/14737159.1.4.428. PMID 11901857.
- Topolcan O, Holubec Jr L (2008). "Úloha thymidinkinázy při rakovinových onemocněních". Znalecký posudek. Med. Diagn. 2 (2): 129–41. doi:10.1517/17530059.2.2.129. PMID 23485133.
- Jagarlamudi KK, Shaw M (2018). „Thymidinkináza 1 jako nádorový biomarker: Technické pokroky nabízejí nový potenciál pro starý biomarker“. Biomark. Med. 12 (9): 1035–48. doi:10,2217 / bmm-2018-0157. PMID 30039979.
Reference
- ^ Kit S (1985). "Thymidinkináza". Microbiol. Sci. 2 (12): 369–75. PMID 3939993.
- ^ Wintersberger E (1997). "Regulace a biologická funkce thymidinkinázy". Biochem. Soc. Trans. 25 (1): 303–8. doi:10.1042 / bst0250303. PMID 9056888.
- ^ Reichard P, Estborn B (1951). "Využití desoxyribosidů při syntéze polynukleotidů". J. Biol. Chem. 188 (2): 839–46. PMID 14824173.
- ^ Bessman MJ, Kornberg A, Lehman IR, Simms ES (1956). "Enzymatická syntéza deoxyribonukleové kyseliny". Biochim. Biophys. Acta. 21 (1): 197–8. doi:10.1016/0006-3002(56)90127-5. PMID 13363894.
- ^ Bollum FJ, Potter VR (1958). „Inkorporace thymidinu do deoxyribonukleové kyseliny enzymy z tkání potkana“. J. Biol. Chem. 233 (2): 478–82. PMID 13563524.
- ^ Weissman SM, Smellie RM, Paul J (1960). „Studie o biosyntéze deoxyribonukleové kyseliny extrakty z buněk savců. IV. Fosforylace thymidinu“. Biochim. Biophys. Acta. 45: 101–10. doi:10.1016 / 0006-3002 (60) 91430-x. PMID 13784139.
- ^ A b Gronowitz JS, Hagberg H, Källander CF, Simonsson B (1983). „Použití deoxythymidinkinázy v séru jako prognostického markeru a při monitorování pacientů s non-Hodgkinovým lymfomem“. Br. J. Cancer. 47 (4): 487–95. doi:10.1038 / bjc.1983.78. PMC 2011337. PMID 6849793.
- ^ Blasco R, López-Otín C, Muñóz M, Bockamp EO, Simón-Mateo C, Viñuela E (1990). "Sekvence a evoluční vztahy thymidinkinázy viru afrického moru prasat". Virologie. 178 (1): 301–4. doi:10.1016 / 0042-6822 (90) 90409-k. PMID 2389555.
- ^ A b Littlefield JW (1966). "Periodická syntéza thymidinkinázy v myších fibroblastech". Biochim. Biophys. Acta. 114 (2): 398–403. doi:10.1016/0005-2787(66)90319-4. PMID 4223355.
- ^ Berk AJ, Clayton DA (1973). "Geneticky odlišná thymidinkináza v savčích mitochondriích. Výhradní značení mitochondriální deoxyribonukleové kyseliny." J. Biol. Chem. 248 (8): 2722–9. PMID 4735344.
- ^ Berk AJ, Meyer BJ, Clayton DA (1973). "Mitochondriálně specifická thymidinkináza". Oblouk. Biochem. Biophys. 154 (2): 563–5. doi:10.1016 / 0003-9861 (73) 90009-x. PMID 4632422.
- ^ Zhu C, Harlow LS, Berenstein D, Munch-Petersen S, Munch-Petersen B (2006). "Vliv C-konce lidské cytosolické thymidinkinázy (TK1) na stabilitu in vitro a enzymatické vlastnosti". Nukleosidy Nukleotidy Nukleové kyseliny. 25 (9–11): 1185–8. doi:10.1080/15257770600894436. PMID 17065087.
- ^ Kit S, Dubbs DR (1963). "Získání aktivity thymidinkinázy myšími fibroblastovými buňkami infikovanými herpes simplex". Biochem. Biophys. Res. Commun. 11: 55–9. doi:10.1016 / 0006-291x (63) 90027-5. PMID 14033128.
- ^ McKnight SL (1980). „Nukleotidová sekvence a přepisová mapa genu thymidinkinázy viru herpes simplex“. Nucleic Acids Res. 8 (24): 5949–64. doi:10.1093 / nar / 8.24.5949. PMC 328064. PMID 6258156.
- ^ Halliburton IW, Morse LS, Roizman B, Quinn KE (1980). "Mapování genů thymidinkinázy virů herpes simplex typu 1 a typu 2 pomocí intertypických rekombinantů". J. Gen. Virol. 49 (2): 235–53. doi:10.1099/0022-1317-49-2-235. PMID 6255066.
- ^ McDougall JK, Masse TH, Galloway DA (1980). „Umístění a klonování genu thymidinkinázy viru herpes simplex typu 2“. J. Virol. 33 (3): 1221–4. doi:10.1128 / JVI.33.3.1221-1224.1980. PMC 288658. PMID 6245273.
- ^ Kit S, Kit M, Qavi H, Trkula D, Otsuka H (1983). „Nukleotidová sekvence genu thymidinkinázy viru herpes simplex typu 2 (HSV-2) a předpokládaná aminokyselinová sekvence polypeptidu thymidinkinázy a její srovnání s genem thymidinkinázy HSV-1“. Biochim. Biophys. Acta. 741 (2): 158–70. doi:10.1016/0167-4781(83)90056-8. PMID 6317035.
- ^ Sawyer MH, Ostrove JM, Felser JM, Straus SE (1986). „Mapování genu deoxypyrimidinkinázy viru varicella zoster a předběžná identifikace jeho transkriptu“. Virologie. 149 (1): 1–9. doi:10.1016/0042-6822(86)90081-4. PMID 3004022.
- ^ Littler E, Zeuthen J, McBride AA, Trøst Sørensen E, Powell KL, Walsh-Arrand JE, Arrand JR (1986). "Identifikace thymidinkinázy kódované virem Epstein-Barrové". EMBO J.. 5 (8): 1959–66. doi:10.1002 / j.1460-2075.1986.tb04450.x. PMC 1167064. PMID 3019675.
- ^ Schlosser CA, Steglich C, deWet JR, Scheffler IE (1981). „Regulace aktivity thymidinkinázy závislá na buněčném cyklu zavedená do myších buněk LMTK pomocí přenosu DNA a chromatinu zprostředkovaného přenosu“. Proc. Natl. Acad. Sci. USA. 78 (2): 1119–23. Bibcode:1981PNAS ... 78.1119S. doi:10.1073 / pnas.78.2.1119. PMC 319958. PMID 6940130.
- ^ Coppock DL, Pardee AB (1987). "Kontrola mRNA thymidinkinázy během buněčného cyklu". Mol. Buňka. Biol. 7 (8): 2925–32. doi:10.1128 / MCB.7.8.2925. PMC 367911. PMID 3670299.
- ^ Stewart CJ, Ito M, Conrad SE (1987). "Důkazy pro transkripční a post-transkripční kontrolu buněčného genu thymidinkinázy". Mol. Buňka. Biol. 7 (3): 1156–63. doi:10.1128 / MCB.7.3.1156. PMC 365188. PMID 3561412.
- ^ Piper AA, Tattersall MH, Fox RM (1980). „Činnosti enzymů metabolizujících thymidin během buněčného cyklu buněčné linie lidských lymfocytů LAZ-007 synchronizované odstředivou elutriací“. Biochim. Biophys. Acta. 633 (3): 400–9. doi:10.1016/0304-4165(80)90198-1. PMID 6260157.
- ^ Pelka-Fleischer R, Ruppelt W, Wilmanns W, Sauer H, Schalhorn A (1987). „Vztah mezi fází buněčného cyklu a aktivitou enzymů syntetizujících DNA v kultivovaných lidských lymfoblastech: vyšetřování buněčných frakcí obohacených podle fází buněčného cyklu pomocí odstředivé elutriace“. Leukémie. 1 (3): 182–7. PMID 3669741.
- ^ Sherley JL, Kelly TJ (1988). "Regulace lidské thymidinkinázy během buněčného cyklu". J. Biol. Chem. 263 (17): 8350–8. PMID 3372530.
- ^ Gross MK, Kainz MS, Merrill GF (1987). „Kuřecí thymidinkinázový gen je transkripčně potlačován během terminální diferenciace: související pokles TK mRNA nemůže plně odpovídat za zmizení aktivity TK enzymu.“ Dev. Biol. 122 (2): 439–51. doi:10.1016/0012-1606(87)90308-3. PMID 3596017.
- ^ Kauffman MG, Kelly TJ (1991). „Regulace buněčného cyklu thymidinkinázy: zbytky poblíž karboxylového konce jsou nezbytné pro specifickou degradaci enzymu při mitóze“. Mol. Buňka. Biol. 11 (5): 2538–46. doi:10.1128 / MCB.11.5.2538. PMC 360023. PMID 1708095.
- ^ Sutterluety H, Bartl S, Karlseder J, Wintersberger E, Seiser C (1996). „Karboxy-terminální zbytky myší thymidinkinázy jsou nezbytné pro rychlou degradaci v klidových buňkách“. J. Mol. Biol. 259 (3): 383–92. doi:10.1006 / jmbi.1996.0327. PMID 8676376.
- ^ Welin M, Kosinska U, Mikkelsen NE, Carnrot C, Zhu C, Wang L, Eriksson S, Munch-Petersen B, Eklund H (2004). "Struktury thymidinkinázy 1 lidského a mykoplazmatického původu". Proc. Natl. Acad. Sci. USA. 101 (52): 17970–5. Bibcode:2004PNAS..10117970W. doi:10.1073 / pnas.0406332102. PMC 539776. PMID 15611477.
- ^ Karlström AR, Neumüller M, Gronowitz JS, Källander CF (1990). "Molekulární formy v lidském séru enzymů syntetizujících prekurzory DNA a DNA". Mol. Buňka. Biochem. 92 (1): 23–35. doi:10.1007 / BF00220716. PMID 2155379.
- ^ A b Gronowitz JS, Källander CF (1980). „Optimalizovaný test na thymidinkinázu a její aplikace na detekci protilátek proti thymidinkináze indukované virem herpes simplex typu 1 a 2“. Infekce a imunita. 29 (2): 425–34. PMC 551136. PMID 6260651.
- ^ Gronowitz JS, Källander FR, Diderholm H, Hagberg H, Pettersson U (1984). "Aplikace in vitro testu na thymidinkinázu v séru: výsledky virových onemocnění a malignit u lidí". International Journal of Cancer. 33 (1): 5–12. doi:10.1002 / ijc.2910330103. PMID 6693195.
- ^ Gronowitz JS, Källander CF (1983). "Citlivý test na detekci deoxythymidinkinázy a její aplikace na diagnostiku herpesviru". Aktuální témata v mikrobiologii a imunologii. 104: 235–45. doi:10.1007/978-3-642-68949-9_14. ISBN 978-3-642-68951-2. PMID 6307593.
- ^ A b von Euler HP, Öhrvik AB, Eriksson SK (2006). "Neradiometrická metoda pro měření aktivity thymidinkinázy v séru u maligního lymfomu u psů". Výzkum ve veterinární vědě. 80 (1): 17–24. doi:10.1016 / j.rvsc.2005.05.001. PMID 16140350.
- ^ Öhrvik A, Lindh M, Einarsson R, Grassi J, Eriksson S (2004). "Citlivá neradiometrická metoda pro stanovení aktivity thymidinkinázy 1". Klinická chemie. 50 (9): 1597–606. doi:10.1373 / clinchem.2003.030379. PMID 15247154.
- ^ WO přihláška 2006000246 „Metoda a souprava pro stanovení aktivity thymidinkinázy a její použití“, publikovaná 24. 2. 2006, přidělená společnosti Gronowitz JS
- ^ A b C Nisman B, Allweis T, Kadouri L, Mali B, Hamburger T, Baras M, Gronowitz S, Peretz T (2013). "Srovnání diagnostické a prognostické výkonnosti dvou testů měřících aktivitu thymidinkinázy 1 v séru pacientek s rakovinou prsu". Clin. Chem. Laboratoř. Med. 51 (2): 439–47. doi:10.1515 / cclm-2012-0162. PMID 23093267.
- ^ A b Bačovský J, Mysliveček M, Minárik J, Scudla V, Pika T, Zapletalálová J, Petrova P, Bartková M, Adam T, Gronowitz SJ (2015). „Analýza sérových hladin thymidinkinázy novou metodou DiviTum u mnohočetného myelomu a monoklonální gamapatie neurčeného významu - srovnání se zobrazovacími metodami 99mTc-MIBI scintigrafie a 18F-FDG PET / CT“. Biomedicínské práce Lékařské fakulty Univerzity Palackého v Olomouci, Československo. 159 (1): 135–8. doi:10,5507 / bp.2014.008. PMID 24572488.
- ^ Stålhandske P, Wang L, Westberg S, von Euler H, Groth E, Gustafsson SA, Eriksson S, Lennerstrand J (2013). "Homogenní test pro real-time a simultánní detekci aktivity thymidinkinázy 1 a deoxycytidinkinázy". Anální. Biochem. 432 (2): 155–64. doi:10.1016 / j.ab.2012.08.004. PMID 22902741.
- ^ Alegre, MM; Weyant, MJ; Bennett, DT; Yu, JA; Ramsden, MK; Elnaggar, A; Robison, RA; O'Neill, KL (květen 2014). „Sérová detekce thymidinkinázy 1 jako prostředku včasné detekce rakoviny plic“. Protinádorový výzkum. 34 (5): 2145–51. PMID 24778016.
- ^ A b On, Q; Zhang, P; Zou, L; Li, H; Wang, X; Zhou, S; Fornander, T; Skog, S (říjen 2005). „Koncentrace thymidinkinázy 1 v séru (S-TK1) je citlivějším markerem proliferace v lidských pevných nádorech než jeho aktivita“. Zprávy o onkologii. 14 (4): 1013–9. PMID 16142366.
- ^ Jagarlamudi, KK; Hansson, LO; Eriksson, S (18. února 2015). „Pacienti s rakovinou prsu a prostaty se významně liší ve svých specifických aktivitách s tymidinkinázou 1 (TK1) ve srovnání s těmi hematologickými malignitami a dárci krve: důsledky používání sérového TK1 jako biomarkeru“. Rakovina BMC. 15: 66. doi:10.1186 / s12885-015-1073-8. PMC 4336758. PMID 25881026.
- ^ A b Jagarlamudi KK, Hansson LO, Eriksson S (2015). „Pacienti s rakovinou prsu a prostaty se významně liší ve svých specifických aktivitách s tymidinkinázou 1 (TK1) ve srovnání s těmi hematologickými malignitami a dárci krve: důsledky používání sérového TK1 jako biomarkeru“. Rakovina BMC. 15: 66. doi:10.1186 / s12885-015-1073-8. PMC 4336758. PMID 25881026.
- ^ A b C d E Kumar, JK; Aronsson, AC; Pilko, G; Zupan, M; Kumer, K; Fabjan, T; Osredkar, J; Eriksson, S (září 2016). „Klinické hodnocení testu TK 210 ELISA v séru pacientů s rakovinou prsu ukazuje vysokou senzitivitu a specificitu ve všech stadiích onemocnění“. Biologie nádorů. 37 (9): 11937–11945. doi:10.1007 / s13277-016-5024-z. PMC 5080325. PMID 27079872.
- ^ On, Q; Skog, S; Wang, N; Eriksson, S; Tribukait, B (červen 1996). "Charakterizace peptidové protilátky proti C-koncové části lidské a myší cytosolické thymidinkinázy, která je markerem pro buněčnou proliferaci". European Journal of Cell Biology. 70 (2): 117–24. PMID 8793383.
- ^ A b He Q, Zou L, Zhang PA, Lui JX, Skog S, Fornander T (2000). "Klinický význam měření thymidinkinázy 1 v séru pacientek s rakovinou prsu s použitím protilátky anti-TK1". Mezinárodní žurnál biologických markerů. 15 (2): 139–46. doi:10.1177/172460080001500203. PMID 10883887.
- ^ Pagaduan JV, Ramsden M, O'Neill K, Woolley AT (2015). „Mikročipová imunoafinitní elektroforéza komplexu protilátka-thymidinkináza 1“. Elektroforéza. 36 (5): 813–7. doi:10.1002 / elps.201400436. PMC 4346389. PMID 25486911.
- ^ Doi S, Naito K, Yamada K (1990). „Sérová deoxythymidinkináza jako progresivní marker hematologické malignity“. Nagoya J Med Sci. 52 (1–4): 19–26. PMID 2381458.
- ^ Ellims PH, Van der Weyden MB, Medley G (1981). "Izoenzymy tymidinkinázy v lidském maligním lymfomu". Cancer Res. 41 (2): 691–5. PMID 7448815.
- ^ Hagberg H, Glimelius B, Gronowitz S, Killander A, Källander C, Schröder T (1984). „Biochemické markery u nehodgkinských lymfomů ve stadiích III a IV a prognóza: multivariační analýza“. Scand J Haematol. 33 (1): 59–67. doi:10.1111 / j.1600-0609.1984.tb02211.x. PMID 6379852.
- ^ Hallek M, Wanders L, Strohmeyer S, Emmerich B (1992). „Thymidinkináza: nádorový marker s prognostickou hodnotou pro non-Hodgkinův lymfom a širokou škálou potenciálních klinických aplikací“. Ann. Hematol. 65 (1): 1–5. doi:10.1007 / bf01715117. PMID 1643153.
- ^ Bogni A, Cortinois A, Grasselli G, Seregni E, Crippa F, Castellani MR, Bombardieri E (1994). „Aktivita thymidinkinázy (TK) jako prognostický parametr přežití u pacientů s lymfomem“. J. Biol. Regul. Homeost. Agenti. 8 (4): 121–5. PMID 7660854.
- ^ Rehn S, Gronowitz JS, Källander C, Sundström C, Glimelius B (1995). „Deoxythymidinkináza v nádorových buňkách a séru pacientů s nehodgkinskými lymfomy“. Br. J. Cancer. 71 (5): 1099–105. doi:10.1038 / bjc.1995.213. PMC 2033808. PMID 7734308.
- ^ Suki S, Swan F, Tucker S, Fritsche HA, Redman JR, Rodriguez MA, McLaughlin P, Romaguera J, Hagemeister FB, Velasquez WS (1995). "Klasifikace rizika pro velkobuněčný lymfom s použitím laktátdehydrogenázy, beta-2 mikroglobulinu a thymidinkinázy". Leukémie a lymfom. 18 (1–2): 87–92. doi:10.3109/10428199509064927. PMID 8580834.
- ^ Suzuki K, Terui Y, Nakano K, Nara E, Nasu K, Ueda K, Nishimura N, Mishima Y, Sakajiri S, Yokoyama M, Takahashi S, Hatake K (2012). „Vysoká aktivita thymidinkinázy je silným prediktivním faktorem pro špatnou prognózu u periferních T-buněčných lymfomů léčených cyklofosfamidem, adriamycinem, vinkristinem a prednisonem.“ Leukémie a lymfom. 53 (5): 849–54. doi:10.3109/10428194.2011.635858. PMID 22035416.
- ^ Procházka V, Faber E, Raida L, Langová K, Indrák K, Papajík T (2012). „Vysoká základní hladina thymidinkinázy 1 v séru předpovídá nepříznivý výsledek u pacientů s folikulárním lymfomem“. Leukémie a lymfom. 53 (7): 1306–10. doi:10.3109/10428194.2011.654339. PMID 22263569.
- ^ Suzuki K, Terui Y, Yokoyama M, Ueda K, Nishimura N, Mishima Y, Sakajiri S, Tsuyama N, Takeuchi K, Hatake K (2013). „Prognostická hodnota vysoké aktivity thymidinkinázy u pacientů s dříve neléčeným difuzním velkobuněčným B-buněčným lymfomem léčeným rituximabem, cyklofosfamidem, doxorubicinem, vinkristinem a prednisolonem.“ Leukémie a lymfom. 54 (11): 2412–7. doi:10.3109/10428194.2013.779690. PMID 23488601.
- ^ Tsuji T, Satoh K, Nakano H, Nishide Y, Uemura Y, Tanaka S, Kogo M (2015). „Prediktory nutnosti biopsie lymfatických uzlin cervikální lymfadenopatie“. J. Craniomaxillofac Surg. 43 (10): 2200–4. doi:10.1016 / j.jcms.2015.09.010. PMID 26545929.
- ^ Gatt ME, Goldschmidt N, Kalichman I, Friedman M, Aronson AC, Barak V (2015). „Hladiny thymidinkinázy korelují s prognózou agresivního lymfomu a mohou diskriminovat pacienty s klinickým podezřením na indolentní až agresivní transformaci.“ Protinádorový výzkum. 35 (5): 3019–26. PMID 25964590.
- ^ Källander CF, Simonsson B, Hagberg H, Gronowitz JS (1984). „Sérová deoxythymidinkináza poskytuje prognostické informace u chronické lymfocytární leukémie“. Rakovina. 54 (11): 2450–5. doi:10.1002 / 1097-0142 (19841201) 54:11 <2450 :: aid-cncr2820541123> 3.0.co; 2-r. PMID 6498737.
- ^ Källander CF, Simonsson B, Gronowitz JS, Nilsson K (1987). „Sérová deoxythymidinkináza koreluje s absorpcí thymidinu periferními lymfocyty u chronické lymfocytární leukémie.“ Eur. J. Haematol. 38 (4): 331–7. doi:10.1111 / j.1600-0609.1987.tb00007.x. PMID 3609253.
- ^ Hallek M, Wanders L, Ostwald M, Busch R, Senekowitsch R, Stern S, Schick HD, Kuhn-Hallek I, Emmerich B (1996). „Sérum beta (2) -mikroglobulin a sérová thymidinkináza jsou nezávislé prediktory přežití bez progrese u chronické lymfocytární leukémie a imunocytomu.“ Leukémie a lymfom. 22 (5–6): 439–47. doi:10.3109/10428199609054782. PMID 8882957.
- ^ A b Rivkina A, Vitols G, Murovská M, Lejniece S (2011). "Identifikace stádia nových pacientů s CLL pomocí úrovní TK, ZAP-70, CD38". Experimentální onkologie. 33 (2): 99–103. PMID 21716207.
- ^ Bazargan A, Tam CS, Keating MJ (2012). „Predikce přežití u chronické lymfocytární leukémie“. Odborná recenze protinádorové terapie. 12 (3): 393–403. doi:10.1586 / era.12.2. PMID 22369330.
- ^ Pflug N, Bahlo J, Shanafelt TD, Eichhorst BF, Bergmann MA, Elter T, Bauer K, Malchau G, Rabe KG, Stilgenbauer S, Döhner H, Jäger U, Eckart MJ, Hopfinger G, Busch R, Fink AM, Wendtner CM , Fischer K, Kay NE, Hallek M (2014). „Vývoj komplexního prognostického indexu pro pacienty s chronickou lymfocytární leukémií“. Krev. 124 (1): 49–62. doi:10.1182 / krev-2014-02-556399. PMC 4260976. PMID 24797299.
- ^ Hagag AA, Saad MA, Mohamed SA (2015). "Klinický význam thymidinkinázy u egyptských dětí s akutní lymfoblastickou leukémií". Jihoasijský deník rakoviny. 4 (2): 72–4. doi:10,4103 / 2278-330X.155675. PMC 4418086. PMID 25992345.
- ^ López-Martínez B, Vilchis Ordoñez A, Salazar Garcia M, Klünder-Klünder M, Parra-Ortega I, Dorantes-Acosta E, Angeles-Floriano T (2015). „Thymidinkináza: Biomarker pro nedávno diagnostikovanou akutní leukémii u pediatrických pacientů podle zapojené buněčné linie“. Oblouk. Med. Res. 46 (8): 630–4. doi:10.1016 / j.arcmed.2015.11.005. PMID 26656666.
- ^ Simonsson B, Källander CF, Brenning G, Killander A, Ahre A, Gronowitz JS (1985). "Hodnocení sérové deoxythymidinkinázy jako markeru u mnohočetného myelomu". British Journal of Hematology. 61 (2): 215–24. doi:10.1111 / j.1365-2141.1985.tb02820.x. PMID 4041368.
- ^ Simonsson B, Källander CF, Brenning G, Killander A, Gronowitz JS, Bergström R (1988). "Biochemické markery u mnohočetného myelomu: multivariační analýza". British Journal of Hematology. 69 (1): 47–53. doi:10.1111 / j.1365-2141.1988.tb07601.x. PMID 3289607.
- ^ Musto P, Bodenizza C, Falcone A, D'Arena G, Scalzulli P, Perla G, Modoni S, Parlatore L, Valvano MR, Carotenuto M (1995). "Prognostický význam sérové thymidinkinázy u primárních myelodysplastických syndromů: vztah k rozvoji akutní myeloidní leukémie". British Journal of Hematology. 90 (1): 125–30. doi:10.1111 / j.1365-2141.1995.tb03390.x. PMID 7786774.
- ^ Aul C, Germing U, Gattermann N, Söhngen D, Heyll A (1996). "[Prognostický význam sérové thymidinkinázy v myelodysplastickém syndromu]". Deutsche Medizinische Wochenschrift (v němčině). 121 (37): 1113–8. doi:10.1055 / s-2008-1043114. PMID 8925725.
- ^ Gronowitz JS, Steinholtz L, Källander CF, Hagberg H, Bergh J (1986). "Sérová deoxythymidinkináza v malobuněčném karcinomu plic. Vztah ke klinickým rysům, prognóze a dalším biochemickým markerům". Rakovina. 58 (1): 111–8. doi:10.1002 / 1097-0142 (19860701) 58: 1 <111 :: aid-cncr2820580120> 3.0.co; 2-k. PMID 3011236.
- ^ Gronowitz JS, Bergström R, Nôu E, Påhlman S, Brodin O, Nilsson S, Källander CF (1990). „Klinické a sérologické markery stadia a prognózy u malobuněčného karcinomu plic. Mnohorozměrná analýza“. Rakovina. 66 (4): 722–32. doi:10.1002 / 1097-0142 (19900815) 66: 4 <722 :: aid-cncr2820660421> 3.0.co; 2-j. PMID 2167141.
- ^ Korkmaz T, Seber S, Okutur K, Basaran G, Yumuk F, Dane F, Ones T, Polat O, Madenci OC, Demir G, Turhal NS (2013). „Hladiny thymidinkinázy 1 v séru korelují s absorpcí FDG a prognózou u pacientů s nemalobuněčným karcinomem plic“. Biomarkery. 18 (1): 88–94. doi:10.3109 / 1354750X.2012.738250. PMID 23116493.
- ^ Nisman B, Nechushtan H, Biran H, Gantz-Sorotsky H, Peled N, Gronowitz S, Peretz T (2014). "Serum thymidine kinase 1 activity in the prognosis and monitoring of chemotherapy in lung cancer patients: a brief report". Journal of Thoracic Oncology. 9 (10): 1568–72. doi:10.1097/JTO.0000000000000276. PMID 25521401.
- ^ Alegre MM, Weyant MJ, Bennett DT, Yu JA, Ramsden MK, Elnaggar A, Robison RA, O'Neill KL (2014). "Serum detection of thymidine kinase 1 as a means of early detection of lung cancer". Protinádorový výzkum. 34 (5): 2145–51. PMID 24778016.
- ^ Jiang, ZF; Wang, M; Xu, JL (1 February 2018). "Thymidine kinase 1 combined with CEA, CYFRA21-1 and NSE improved its diagnostic value for lung cancer". Humanitní vědy. 194: 1–6. doi:10.1016/j.lfs.2017.12.020. PMID 29247745.
- ^ Lou, X; Zhou, J; Ma, H; Xu, S; He, E; Skog, S; Wang, H (August 2017). "The Half-Life of Serum Thymidine Kinase 1 Concentration Is an Important Tool for Monitoring Surgical Response in Patients with Lung Cancer: A Meta-Analysis". Genetické testování a molekulární biomarkery. 21 (8): 471–478. doi:10.1089/gtmb.2017.0003. PMID 28817340.
- ^ Chen F, Tang L, Xia T, He E, Hu G, Li Y, Zhang M, Zhou J, Eriksson S, Skog S (2013). "Serum thymidine kinase 1 levels predict cancer-free survival following neoadjuvant, surgical and adjuvant treatment of patients with locally advanced breast cancer". Molecular and Clinical Oncology. 1 (5): 894–902. doi:10.3892/mco.2013.149. PMC 3915673. PMID 24649267.
- ^ Nisman B, Allweis T, Kaduri L, Maly B, Gronowitz S, Hamburger T, Peretz T (2010). "Serum thymidine kinase 1 activity in breast cancer". Cancer Biomarkers. 7 (2): 65–72. doi:10.3233/CBM-2010-0148. PMID 21178264.
- ^ Huang ZH, Tian XS, Li R, Wang XM, Wen W, Guan H, Yang YJ (2012). "Elevated thymidine kinase 1 in serum following neoadjuvant chemotherapy predicts poor outcome for patients with locally advanced breast cancer". Experimental and Therapeutic Medicine. 3 (2): 331–335. doi:10.3892/etm.2011.395. PMC 3438657. PMID 22969891.
- ^ Nisman B, Kadouri L, Allweis T, Maly B, Hamburger T, Gronowitz S, Peretz T (2013). "Increased proliferative background in healthy women with BRCA1/2 haploinsufficiency is associated with high risk for breast cancer". Cancer Epidemiol. Biomarkery Předchozí. 22 (11): 2110–5. doi:10.1158/1055-9965.EPI-13-0193. PMID 23966579.
- ^ Bjöhle J, Bergqvist J, Gronowitz JS, Johansson H, Carlsson L, Einbeigi Z, Linderholm B, Loman N, Malmberg M, Söderberg M, Sundquist M, Walz TM, Fernö M, Bergh J, Hatschek T (2013). "Serum thymidine kinase activity compared with CA 15-3 in locally advanced and metastatic breast cancer within a randomized trial". Výzkum a léčba rakoviny prsu. 139 (3): 751–8. doi:10.1007/s10549-013-2579-x. PMID 23736998.
- ^ Bolayirli M, Papila C, Korkmaz GG, Papila B, Aydoğan F, Karataş A, Uzun H (2013). "Serum thymidine kinase 1 activity in solid tumor (breast and colorectal cancer) patients treated with adjuvant chemotherapy". Journal of Clinical Laboratory Analysis. 27 (3): 220–6. doi:10.1002/jcla.21587. PMC 6807516. PMID 23686779.
- ^ Larson A, Fritjofsson A, Norlén BJ, Gronowitz JS, Ronquist G (1985). "Prostate specific acid phosphatase versus five other possible tumor markers: a comparative study in men with prostatic carcinoma". Scandinavian Journal of Clinical and Laboratory Investigation. Supplementum. 179: 81–8. PMID 2417306.
- ^ Lewenhaupt A, Ekman P, Eneroth P, Nilsson B (1990). "Tumour markers as prognostic aids in prostatic carcinoma". British Journal of Urology. 66 (2): 182–7. doi:10.1111/j.1464-410x.1990.tb14900.x. PMID 1697204.
- ^ Ekman P, Lewenhaupt A (1991). "Serum tumour markers in human prostatic carcinoma. The value of a marker panel for prognostic information". Acta Oncol. 30 (2): 173–5. doi:10.3109/02841869109092345. PMID 2029401.
- ^ Letocha H, Eklöv S, Gronowitz S, Norlén BJ, Nilsson S (1996). "Deoxythymidine kinase in the staging of prostatic adenocarcinoma". Prostata. 29 (1): 15–9. doi:10.1002/(SICI)1097-0045(199607)29:1<15::AID-PROS2>3.0.CO;2-H. PMID 8685050.
- ^ Nisman B, Yutkin V, Nechushtan H, Gofrit ON, Peretz T, Gronowitz S, Pode D (2010). "Circulating tumor M2 pyruvate kinase and thymidine kinase 1 are potential predictors for disease recurrence in renal cell carcinoma after nephrectomy". Urologie. 76 (2): 513.e1–6. doi:10.1016/j.urology.2010.04.034. PMID 20573390.
- ^ Rausch S, Hennenlotter J, Teepe K, Kuehs U, Aufderklamm S, Bier S, Mischinger J, Gakis G, Stenzl A, Schwentner C, Todenhöfer T (2015). "Muscle-invasive bladder cancer is characterized by overexpression of thymidine kinase 1". Urologic Oncology. 33 (10): 426.e21–9. doi:10.1016/j.urolonc.2015.06.007. PMID 26231311.
- ^ Liu, Y; Ling, Y; Qi, Q; Tang, Y; Xu, J; Tong, Z; Sheng, G; Yang, Q; Pan, Y (November 2011). "Changes in serum thymidine kinase 1 levels during chemotherapy correlate with objective response in patients with advanced gastric cancer". Experimental and Therapeutic Medicine. 2 (6): 1177–1181. doi:10.3892/etm.2011.338. PMC 3440839. PMID 22977640.
- ^ Liu Y, Ling Y, Qi Q, Tang Y, Xu J, Tong Z, Sheng G, Yang Q, Pan Y (2011). "Changes in serum thymidine kinase 1 levels during chemotherapy correlate with objective response in patients with advanced gastric cancer". Experimental and Therapeutic Medicine. 2 (6): 1177–1181. doi:10.3892/etm.2011.338. PMC 3440839. PMID 22977640.
- ^ Ji Y, Wu XB, Chen JY, Hu B, Zhu QK, Zhu XF, Zheng MF (2015). "Serum thymidine kinase 1 levels correlate with clinical characteristics of esophageal squamous cell carcinoma". Int J Clin Exp Med. 8 (8): 12850–7. PMC 4612885. PMID 26550200.
- ^ Zhang SY, Lin BD, Li BR (2015). "Evaluation of the diagnostic value of alpha-l-fucosidase, alpha-fetoprotein and thymidine kinase 1 with ROC and logistic regression for hepatocellular carcinoma". FEBS Open Bio. 5: 240–4. doi:10.1016/j.fob.2015.03.010. PMC 4392066. PMID 25870783.
- ^ Kolberg M, Høland M, Lind GE, Ågesen TH, Skotheim RI, Hall KS, Mandahl N, Smeland S, Mertens F, Davidson B, Lothe RA (2015). "Protein expression of BIRC5, TK1, and TOP2A in malignant peripheral nerve sheath tumours--A prognostic test after surgical resection". Molekulární onkologie. 9 (6): 1129–39. doi:10.1016/j.molonc.2015.02.005. PMC 5528761. PMID 25769404.
- ^ Wu BJ, Li WP, Qian C, Ding W, Zhou ZW, Jiang H (2013). "Increased serum level of thymidine kinase 1 correlates with metastatic site in patients with malignant melanoma". Tumour Biology. 34 (2): 643–8. doi:10.1007/s13277-012-0591-0. PMID 23179401.
- ^ Wang, Y; Jiang, X; Dong, S; Shen, J; Yu, H; Zhou, J; Li, J; Ma, H; He, E; Skog, S (11 March 2016). "Serum TK1 is a more reliable marker than CEA and AFP for cancer screening in a study of 56,286 people". Cancer Biomarkers. 16 (4): 529–36. doi:10.3233/CBM-160594. PMID 27002755.
- ^ Ellims PH, Hayman RJ, Van der Weyden MB (1979). "Expression of fetal thymidine kinase in human cobalamin or folate deficient lymphocytes". Sdělení o biochemickém a biofyzikálním výzkumu. 89 (1): 103–7. doi:10.1016/0006-291x(79)90949-5. PMID 475797.
- ^ A b Neumüller M, Källander CF, Gronowitz JS (1989). "Detection and characteristics of DNA polymerase activity in serum from patients with malignant, viral, or B12-deficiency disease". Enzym. 41 (1): 6–16. doi:10.1159/000469045. PMID 2543552.
- ^ Källander CF, Gronowitz JS, Olding-Stenkvist E (1983). "Rapid diagnosis of varicella-zoster virus infection by detection of viral deoxythymidine kinase in serum and vesicle fluid". Journal of Clinical Microbiology. 17 (2): 280–7. doi:10.1128/JCM.17.2.280-287.1983. PMC 272623. PMID 6339548.
- ^ Tufveson G, Tötterman TH, Källander CF, Hagström A, Gronowitz JS (1988). "Serum thymidine-kinase and cytomegalovirus-specific antibodies after renal transplantation". Řízení o transplantaci. 20 (3): 405–7. PMID 2837850.
- ^ Larsdotter S, Nostell K, von Euler H (2015). "Serum thymidine kinase activity in clinically healthy and diseased horses: a potential marker for lymphoma". Veterinární věstník. 205 (2): 313–6. doi:10.1016/j.tvjl.2015.01.019. PMID 25744802.
- ^ von Euler H, Einarsson R, Olsson U, Lagerstedt AS, Eriksson S (2004). "Serum thymidine kinase activity in dogs with malignant lymphoma: a potent marker for prognosis and monitoring the disease". Journal of Veterinary Internal Medicine. 18 (5): 696–702. doi:10.1111/j.1939-1676.2004.tb02608.x. PMID 15515587.
- ^ Jagarlamudi KK, Westberg S, Rönnberg H, Eriksson S (2014). "Properties of cellular and serum forms of thymidine kinase 1 (TK1) in dogs with acute lymphocytic leukemia (ALL) and canine mammary tumors (CMTs): implications for TK1 as a proliferation biomarker". BMC Veterinární výzkum. 10: 228. doi:10.1186/s12917-014-0228-1. PMC 4195903. PMID 25293656.
- ^ Selting KA, Sharp CR, Ringold R, Knouse J (2015). "Serum thymidine kinase 1 and C-reactive protein as biomarkers for screening clinically healthy dogs for occult disease". Veterinary and Comparative Oncology. 13 (4): 373–84. doi:10.1111/vco.12052. PMID 23859156.
- ^ Elliott JW, Cripps P, Blackwood L (2013). "Thymidine kinase assay in canine lymphoma". Veterinary and Comparative Oncology. 11 (1): 1–13. doi:10.1111/j.1476-5829.2011.00296.x. PMID 22236202.
- ^ Jagarlamudi KK, Moreau L, Westberg S, Rönnberg H, Eriksson S (2015). "A New Sandwich ELISA for Quantification of Thymidine Kinase 1 Protein Levels in Sera from Dogs with Different Malignancies Can Aid in Disease Management". PLOS ONE. 10 (9): e0137871. Bibcode:2015PLoSO..1037871J. doi:10.1371/journal.pone.0137871. PMC 4569288. PMID 26366881.
- ^ Taylor SS, Dodkin S, Papasouliotis K, Evans H, Graham PA, Belshaw Z, Westberg S, von Euler HP (2013). "Serum thymidine kinase activity in clinically healthy and diseased cats: a potential biomarker for lymphoma". Journal of Feline Medicine and Surgery. 15 (2): 142–7. doi:10.1177/1098612X12463928. PMID 23076596.
- ^ Tawfeeq MM, Miura S, Horiuchi N, Kobayashi Y, Furuoka H, Inokuma H (2013). "Utility of serum thymidine kinase activity measurements for cases of bovine leukosis with difficult clinical diagnoses". The Journal of Veterinary Medical Science. 75 (9): 1167–72. doi:10.1292/jvms.12-0572. PMID 23628971.
- ^ Sharif H, Hagman R, Wang L, Eriksson S (2013). "Elevation of serum thymidine kinase 1 in a bacterial infection: canine pyometra". Theriogenologie. 79 (1): 17–23. doi:10.1016/j.theriogenology.2012.09.002. PMID 23102844.
- ^ Arnér ES, Spasokoukotskaja T, Eriksson S (1992). "Selective assays for thymidine kinase 1 and 2 and deoxycytidine kinase and their activities in extracts from human cells and tissues". Sdělení o biochemickém a biofyzikálním výzkumu. 188 (2): 712–8. doi:10.1016/0006-291x(92)91114-6. PMID 1359886.
- ^ Romain S, Spyratos F, Guirou O, Deytieux S, Chinot O, Martin PM (1994). "Technical evaluation of thymidine kinase assay in cytosols from breast cancers. EORTC Receptor Study Group Report". European Journal of Cancer. 30A (14): 2163–5. doi:10.1016/0959-8049(94)00376-g. PMID 7857717.
- ^ Alegre MM, Robison RA, O'Neill KL (2012). "Thymidine kinase 1 upregulation is an early event in breast tumor formation". J Oncol. 2012: 1–5. doi:10.1155/2012/575647. PMC 3388419. PMID 22778736.
- ^ Machovich R, Greengard O (1972). "Thymidine kinase in rat tissues during growth and differentiation". Biochimica et Biophysica Acta (BBA) - Obecné předměty. 286 (2): 375–81. doi:10.1016/0304-4165(72)90273-5. PMID 4660462.
- ^ A b Herzfeld A, Greengard O (1980). "Enzyme activities in human fetal and neoplastic tissues". Rakovina. 46 (9): 2047–54. doi:10.1002/1097-0142(19801101)46:9<2047::aid-cncr2820460924>3.0.co;2-q. PMID 6253048.
- ^ Herzfeld A, Raper SM, Gore I (1980). "The ontogeny of thymidine kinase in tissues of man and rat". Pediatrický výzkum. 14 (12): 1304–10. doi:10.1203/00006450-198012000-00006. PMID 7208144.
- ^ A b Wang L, Eriksson S (2008). "5-Bromovinyl 2'-deoxyuridine phosphorylation by mitochondrial and cytosolic thymidine kinase (TK2 and TK1) and its use in selective measurement of TK2 activity in crude extracts". Nukleosidy, nukleotidy a nukleové kyseliny. 27 (6): 858–62. doi:10.1080/15257770802146510. PMID 18600552.
- ^ Schollenberger S, Taureck D, Wilmanns W (1972). "[Enzymes of thymidine and thymidylate metabolism in normal and pathological blood and bone marrow cells]". Blut (v němčině). 25 (5): 318–34. doi:10.1007/BF01631814. PMID 4508724.
- ^ Nakao K, Fujioka S (1968). "Thymidine kinase activity in the human bone marrow from various blood diseases". Humanitní vědy. 7 (8): 395–9. doi:10.1016/0024-3205(68)90039-8. PMID 5649653.
- ^ Wickramasinghe SN, Olsen I, Saunders JE (1975). "Thymidine kinase activity in human bone marrow cells". Scandinavian Journal of Haematology. 15 (2): 139–44. doi:10.1111/j.1600-0609.1975.tb01065.x. PMID 1059244.
- ^ Gordon HL, Bardos TJ, Chmielewicz ZF, Ambrus JL (1968). "Comparative study of the thymidine kinase and thymidylate kinase activities and of the feedbach inhibition of thymidine kinase in normal and neoplastic human tissue". Výzkum rakoviny. 28 (10): 2068–77. PMID 5696936.
- ^ Stafford MA, Jones OW (1972). "The presence of "fetal" thymidine kinase in human tumors". Biochimica et Biophysica Acta (BBA) - syntéza nukleových kyselin a bílkovin. 277 (2): 439–42. doi:10.1016/0005-2787(72)90423-6. PMID 4672678.
- ^ Maehara Y, Nakamura H, Nakane Y, Kawai K, Okamoto M, Nagayama S, Shirasaka T, Fujii S (1982). "Activities of various enzymes of pyrimidine nucleotide and DNA syntheses in normal and neoplastic human tissues". Gan. 73 (2): 289–98. PMID 6288502.
- ^ Persson L, Gronowitz SJ, Källander CF (1986). "Thymidine kinase in extracts of human brain tumours". Acta Neurochirurgica. 80 (3–4): 123–7. doi:10.1007/bf01812286. PMID 3012969.
- ^ Filanovskaia LI, Togo AV, Shcherbakova EG, Blinov MN (1994). "[Thymidine kinase activity in leukocytes from patients with chronic myeloid leukemia at various periods in the disease]". Voprosy Medit︠S︡Inskoĭ Khimii (v Rusku). 40 (1): 29–32. PMID 8122406.
- ^ Lipkin M, Deschner E, Troncale F (1970). "Cell differentiation and the development of colonic neoplasms". CA: Časopis o rakovině pro klinické lékaře. 20 (6): 386–90. doi:10.3322/canjclin.20.6.386. PMID 4992499.
- ^ Lipkin M (1971). "Proliferation and differentiation of normal and neoplastic cells in the colon of man". Rakovina. 28 (1): 38–40. doi:10.1002/1097-0142(197107)28:1<38::aid-cncr2820280108>3.0.co;2-w. PMID 5110642.
- ^ Weber G, Lui MS, Takeda E, Denton JE (1980). "Enzymology of human colon tumors". Humanitní vědy. 27 (9): 793–9. doi:10.1016/0024-3205(80)90333-1. PMID 7412505.
- ^ Sagara T, Tsukada K, Iwama T, Mishima Y, Sakamoto S, Okamoto R (1985). "[Thymidine kinase isozymes in human colon polyps]". Nihon Gan Chiryo Gakkai Shi (v japonštině). 20 (7): 1312–6. PMID 4078430.
- ^ Sakamoto S, Sagara T, Iwama T, Kawasaki T, Okamoto R (1985). "Increased activities of thymidine kinase isozymes in human colon polyp and carcinoma". Karcinogeneze. 6 (6): 917–9. doi:10.1093/carcin/6.6.917. PMID 4006080.
- ^ Sakamoto S, Okamoto R (1992). "Thymidine kinase activity in familial adenomatous polyposis". Tohoku Journal of Experimental Medicine. 168 (2): 291–301. doi:10.1620/tjem.168.291. PMID 1339104.
- ^ Sakamoto S, Iwama T, Ebuchi M, Tsukada K, Sagara T, Kawasaki T, Murakami S, Kasahara N, Kudo H, Okamoto R (1986). "Increased activities of thymidine kinase isozymes in human mammary tumours". British Journal of Surgery. 73 (4): 272–3. doi:10.1002/bjs.1800730409. PMID 3697655.
- ^ Galloux H, Javre JL, Guerin D, Sampérez S, Jouan P (1988). "[Prognostic value of fetal thymidine kinase measurements in breast cancer]". Comptes Rendus de l'Académie des Sciences, Série III (francouzsky). 306 (3): 89–92. PMID 3126994.
- ^ Romain S, Javre JL, Samperez S, Jouan P, Bressac C, Varette I, Brandone H, Martin PM (1990). "[Prognostic value of thymidine kinase in cancer of the breast]". Bulletin du Cancer (francouzsky). 77 (10): 973–83. PMID 2249017.
- ^ O'Neill KL, Hoper M, Odling-Smee GW (1992). "Can thymidine kinase levels in breast tumors predict disease recurrence?". Journal of the National Cancer Institute. 84 (23): 1825–8. doi:10.1093/jnci/84.23.1825. PMID 1433372.
- ^ O'Neill KL, McKelvey VJ, Hoper M, Monteverde H, Odling-Smee GW, Logan H, Abram WP, McKenna PG (1992). "Breast tumour thymidine kinase levels and disease recurrence". Lékařské laboratorní vědy. 49 (4): 244–7. PMID 1339926.
- ^ Romain S, Chinot O, Guirou O, Soullière M, Martin PM (1994). "Biological heterogeneity of ER-positive breast cancers in the post-menopausal population". International Journal of Cancer. 59 (1): 17–9. doi:10.1002/ijc.2910590105. PMID 7927897.
- ^ Greengard O, Head JF, Goldberg SL, Kirschner PA (1982). "Enzyme pathology and the histologic categorization of human lung tumors: the continuum of quantitative biochemical indices of neoplasticity". Rakovina. 49 (3): 460–7. doi:10.1002/1097-0142(19820201)49:3<460::aid-cncr2820490312>3.0.co;2-y. PMID 6277448.
- ^ Greengard O, Head JF, Goldberg SL, Kirschner PA (1985). "Biochemical measure of the volume doubling time of human pulmonary neoplasms". Rakovina. 55 (7): 1530–5. doi:10.1002/1097-0142(19850401)55:7<1530::aid-cncr2820550720>3.0.co;2-v. PMID 2983858.
- ^ Yusa T, Tamiya N, Yamaguchi Y, Takeda T, Ogawa T, Kimura H, Fujimura S (1994). "[A study of thymidine kinase activity in lung cancer tissue]". Nihon KyōBu Shikkan Gakkai Zasshi (v japonštině). 32 (3): 211–5. PMID 8189640.
- ^ Konishi T, Miyama T, Sakamoto S, Hirata T, Mafune K, Hiraishi M, Idezuki Y (1992). "Activities of thymidylate synthetase and thymidine kinase in gastric cancer". Chirurgická onkologie. 1 (3): 215–21. doi:10.1016/0960-7404(92)90067-u. PMID 1341254.
- ^ Look KY, Moore DH, Sutton GP, Prajda N, Abonyi M, Weber G (1997). "Increased thymidine kinase and thymidylate synthase activities in human epithelial ovarian carcinoma". Protinádorový výzkum. 17 (4A): 2353–6. PMID 9252646.
- ^ Greengard O, Head JF, Chahinian AP, Goldberg SL (1987). "Enzyme pathology of human mesotheliomas". Journal of the National Cancer Institute. 78 (4): 617–22. doi:10.1093/jnci/78.4.617. PMID 2882044.
- ^ Borovanský J, Stríbrná J, Elleder M, Netíková I (1994). "Thymidine kinase in malignant melanoma". Výzkum melanomu. 4 (5): 275–9. doi:10.1097/00008390-199410000-00001. PMID 7858409.
- ^ Sakamoto S, Murakami S, Sugawara M, Mishima Y, Okamoto R (1991). "Increased activities of thymidylate synthetase and thymidine kinase in human thyroid tumors". Štítná žláza. 1 (4): 347–51. doi:10.1089/thy.1991.1.347. PMID 1841732.
- ^ Pikner R, Ludvíkova M, Ryska A, Kholova I, Holubec L, Topolcan O, Pecen L, Fínek J (2005). "TPS, thymidine kinase, VEGF and endostatin in cytosol of thyroid tissue samples". Protinádorový výzkum. 25 (3A): 1517–21. PMID 16033053.
- ^ Wilms K, Wilmanns W (1972). "[Effects of dauno-rubidomycin and adriamycin on enzymes of DNA synthesis in leukocytes in vivo and in culture]". Klinische Wochenschrift (v němčině). 50 (18): 866–70. doi:10.1007/bf01488943. PMID 4507472.
- ^ Zhang HJ, Kennedy BJ, Kiang DT (1984). "Thymidine kinase as a predictor of response to chemotherapy in advanced breast cancer". Výzkum a léčba rakoviny prsu. 4 (3): 221–5. doi:10.1007/bf01806488. PMID 6487823.
- ^ Björklund B (1962). "Immunological approaches to the study of cancer". Rontgen Laborator. 15: L21–L28. PMID 13869604.
- ^ Björklund B (1978). "Tissue polypeptide antigen (TPA): Biology, biochemistry, improved assay methodology, clinical significance in cancer and other conditions, and future outlook". Laboratory Testing for Cancer. Antibiotics and Chemotherapy. 22. 16–31. doi:10.1159/000401148. ISBN 978-3-8055-2765-1. PMID 623439.
- ^ Vickers AJ, Eastham JA, Scardino PT, Lilja H (2016). "The Memorial Sloan Kettering Cancer Center Recommendations for Prostate Cancer Screening". Urologie. 91: 12–8. doi:10.1016/j.urology.2015.12.054. PMC 4842100. PMID 26850815.
- ^ Huang S, Lin J, Guo N, Zhang M, Yun X, Liu S, Zhou J, He E, Skog S (2011). "Elevated serum thymidine kinase 1 predicts risk of pre/early cancerous progression". Asian Pacific Journal of Cancer Prevention. 12 (2): 497–505. PMID 21545220.
- ^ Xiang Y, Zeng H, Liu X, Zhou H, Luo L, Duan C, Luo X, Yan H (2013). "Thymidine kinase 1 as a diagnostic tumor marker is of moderate value in cancer patients: A meta-analysis". Biomedical Reports. 1 (4): 629–637. doi:10.3892/br.2013.114. PMC 3916991. PMID 24648999.
- ^ Cao X, Wang Y, Yang P, Zhou H, Liu C, Chen Z (2014). "[Application of serum thymidine kinase 1 of 26 055 cases in health screening for early detection of premalignant/early malignant tumors]". Zhong Nan da Xue Xue Bao. Yi Xue Ban = Journal of Central South University. Lékařské vědy (v čínštině). 39 (10): 1029–34. doi:10.11817/j.issn.1672-7347.2014.10.007. PMID 25355255.
- ^ Asghar U, Witkiewicz AK, Turner NC, Knudsen ES (2015). "The history and future of targeting cyclin-dependent kinases in cancer therapy". Nat Rev Drug Discov. 14 (2): 130–46. doi:10.1038/nrd4504. PMC 4480421. PMID 25633797.
externí odkazy
- Thymidine+kinase v americké národní lékařské knihovně Lékařské předměty (Pletivo)
