Lithium bis (trimethylsilyl) amid - Lithium bis(trimethylsilyl)amide - Wikipedia
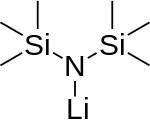 Monomer (neexistuje) | |
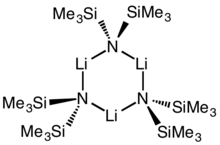 Cyklický trimer | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Lithium 1,1,1-trimethyl-N- (trimethylsilyl) silanaminid | |
| Ostatní jména Lithium hexamethyldisilazid Hexamethyldisilazan lithná sůl | |
| Identifikátory | |
3D model (JSmol ) |
|
| ChemSpider | |
| Informační karta ECHA | 100.021.569 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H18LiNSi2 | |
| Molární hmotnost | 167,326 g / mol |
| Vzhled | Bílá pevná látka |
| Hustota | 0,86 g / cm3 při 25 ° C |
| Bod tání | 71 až 72 ° C (160 až 162 ° F; 344 až 345 K) |
| Bod varu | 80 až 84 ° C (176 až 183 ° F; 353 až 357 K) (0,001 mm Hg) |
| rozkládá se | |
| Rozpustnost | Většina aprotických rozpouštědel THF, hexan, toluen |
| Kyselost (strK.A) | 26 |
| Nebezpečí | |
| Hlavní nebezpečí | hořlavý, žíravý |
| Související sloučeniny | |
Související sloučeniny | Bis (trimethylsilyl) amid sodný Bis (trimethylsilyl) amid draselný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Lithium bis (trimethylsilyl) amid je lithiovaná organokřemičitá sloučenina se vzorcem LiN (SiMe3)2. To je obyčejně zkrátil jako LiHMDS (lithium hexamethyldisilazide - odkaz na jeho konjugovaná kyselina HMDS ) a je primárně používán jako silný nenukleofilní báze a jako ligand. Stejně jako mnoho lithiových reagencií má tendenci agregovat a bude tvořit a cyklický zastřihovač při absenci koordinačních druhů.
Příprava
LiHMDS je komerčně dostupný, ale může být také připraven deprotonací bis (trimethylsilyl) amin s n-butyllithium.[1] Tuto reakci lze provést in situ.[2]
- HN (SiMe3)2 + C.4H9Li → LiN (SiMe3)2 + C.4H10
Jakmile je sloučenina vytvořena, může být čištěna sublimace nebo destilace.
Reakce a aplikace
Jako základ
LiHMDS se často používá v organické chemii jako silný nenukleofilní báze.[3] Jeho konjugovaná kyselina má pKa ~ 26,[4] takže je méně zásaditý než jiné lithiové báze, jako je LDA (pKa konjugované kyseliny ~ 36), ale je to více stéricky bráněno a tedy méně nukleofilní. Může být použit k vytvoření různých organolithium sloučeniny, včetně acetylidy[3] nebo lithium enoláty.[2]

Jako takový nachází uplatnění v celé řadě vazebných reakcí, zejména reakcí vytvářejících vazbu uhlík-uhlík, jako je Fráter – Seebachova alkylace a smíšené Claisenovy kondenzace.
Alternativní syntéza tetranitrid tetrasulfur znamená použití [(Me3Si)2N]2S jako předchůdce s předem vytvořenými vazbami S – N. [(Mě3Si)2N]2S se připravuje reakcí bis (trimethylsilyl) amidu lithného a chlorid sírový (SCl2).
- 2 [(CH3)3Si]2NLi + SCl2 → [((CH3)3Si)2N]2S + 2 LiCl
Tlačítko [((CH3)3Si)2N]2S reaguje s kombinací SCI2 a sulfurylchlorid (TAK2Cl2) za vzniku S.4N4, trimethylsilylchlorid a oxid siřičitý:[5]
- 2 [((CH3)3Si)2N]2S + 2SCl2 + 2SO2Cl2 → S.4N4 + 8 (CH3)3SiCl + 2SO2
Jako ligand
LiHMDS může reagovat širokou škálou halogenidy kovů, a reakce metathézy soli, dát bis (trimethylsilyl) amidy kovů.
- MXX + x Li (hmds) → M (hmds)X + x LiX
- (X = Cl, Br, I a někdy F)
Komplexy bis (trimethylsilyl) amidu kovu jsou lipofilní díky ligandu, a proto jsou rozpustné v rozmezí nepolární organická rozpouštědla, díky čemuž jsou často reaktivnější než odpovídající halogenidy kovů, což je obtížné solubilizovat. The sterický většina ligandů způsobuje, že jejich komplexy jsou diskrétní a monomerní; dále zvyšuje jejich reaktivitu. Díky zabudované bázi tyto sloučeniny pohodlně reagují s prekurzory protického ligandu za vzniku dalších komplexů kovů, a proto jsou důležitými prekurzory složitějších sloučenin. koordinační sloučeniny.[6]
Niche používá
LiHMDS je těkavý a jeho použití bylo projednáno ukládání atomové vrstvy sloučenin lithia.[7]
Struktura
Jako mnozí organolithium činidla, bis (trimethylsilyl) amid lithný může v roztoku vytvářet agregáty. Rozsah agregace závisí na rozpouštědle. Při koordinaci rozpouštědel, jako je např ethery[8] a aminy,[9] the monomer a dimer převládají. V monomerním a dimerním stavu se jedna nebo dvě molekuly rozpouštědla váží na lithiová centra. S amoniakem jako donorovou bází tvoří lithium bis (trimethylsilyl) amid trisolvátovaný monomer, který je stabilizován intermolekulárními vodíkovými vazbami.[10][11] V nekoordinujících rozpouštědlech, jako je např aromatické látky nebo pentan, komplex oligomery převládají, včetně ořezávače.[9] V pevné fázi je struktura trimerní.[12]
 | ||||
 LiHMDS adukt s TMEDA |  THF solvatovaný dimer: (LiHMDS)2• THF2 |  Trimer, bez rozpouštědel: (LiHMDS)3 | ||
Viz také
Reference
- ^ Amonoo-Neizer, E. H .; Shaw, R. A .; Skovlin, D.O .; Smith, B. C. (1966). "Lithium Bis (trimethylsilyl) amid a Tris (trimethylsilyl) amin ". Inorg. Synth. Anorganické syntézy. 8: 19–22. doi:10.1002 / 9780470132395.ch6. ISBN 978-0-470-13239-5.
- ^ A b Danheiser, R. L .; Miller, R. F .; Brisbois, R. G. (1990). „Detrifluoracetylativní přenos skupiny diazo: (E) -1-Diazo-4-fenyl-3-buten-2-on ". Organické syntézy. 73: 134.; Kolektivní objem, 9, str. 197
- ^ A b Wu, George; Huang, Mingsheng (červenec 2006). "Organolithná činidla ve farmaceutických asymetrických procesech". Chemické recenze. 106 (7): 2596–2616. doi:10.1021 / cr040694k. PMID 16836294.
- ^ Fraser, Robert R .; Mansour, Tarek S .; Savard, Sylvain (srpen 1985). "Měření kyselosti pyridinů v tetrahydrofuranu za použití lithiovaných silylaminů". The Journal of Organic Chemistry. 50 (17): 3232–3234. doi:10.1021 / jo00217a050.
- ^ Maaninen, A .; Shvari, J .; Laitinen, R. S .; Chivers, T (2002). Coucouvanis, Dimitri (ed.). "Sloučeniny obecného zájmu". Anorganické syntézy. New York: John Wiley & Sons, Inc. 33: 196–199. doi:10.1002 / 0471224502.ch4.
- ^ Michael Lappert, Andrey Protchenko, Philip Power, Alexandra Seeber (2009). Chemie amidů kovů. Weinheim: Wiley-VCH. doi:10.1002/9780470740385. ISBN 0-470-72184-7.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Hämäläinen, Jani; Holopainen, Jani; Munnik, Frans; Hatanpää, Timo; Heikkilä, Mikko; Ritala, Mikko; Leskelä, Markku (2012). "Lithium Phosphate Thin Films Growth by Atomic Layer Deposition". Journal of the Electrochemical Society. 159 (3): A259 – A263. doi:10.1149 / 2.052203jes.
- ^ Lucht, Brett L .; Collum, David B. (1995). „Ethereal Solvation of Lithium Hexamethyldisilazide: Neočekávané relace čísla rozpouštění, energie rozpouštění a stavu agregace“. Journal of the American Chemical Society. 117 (39): 9863–9874. doi:10.1021 / ja00144a012.
- ^ A b Lucht, Brett L .; Collum, David B. (1996). „Lithium Ion Solvation: Amine and Nenaturated Uhlovodíkové solváty hexamethyldisilazidu lithného (LiHMDS)“. Journal of the American Chemical Society. 118 (9): 2217–2225. doi:10.1021 / ja953029p.
- ^ Neufeld, R .; Michel, R .; Herbst-Irmer, R .; Schöne, R .; Stalke, D. (2016). „Představujeme dárce vodíkových vazeb do slabě nukleofilní Brønstedovy báze: Hexamethyldisilazidy alkalických kovů (MHMDS, M = Li, Na, K, Rb a Cs) s amoniakem“. Chem. Eur. J. 22: 12340–12346. doi:10.1002 / chem.201600833. PMID 27457218.
- ^ Neufeld, R .: DOSY Externí kalibrační křivka Stanovení molekulové hmotnosti jako cenná metodika pro charakterizaci reaktivních meziproduktů v roztoku. V: eDiss, Georg-August-Universität Göttingen. 2016.
- ^ Rogers, Robin D .; Atwood, Jerry L .; Grüning, Rainer (1978). "Krystalová struktura N-lithiohexamethyldisilazan, [LiN (SiMe3)2]3". J. Organomet. Chem. 157 (2): 229–237. doi:10.1016 / S0022-328X (00) 92291-5.
