Amid lithný - Lithium amide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Amid lithný | |
| Ostatní jména Lithamid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.062 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| LiNH 2 | |
| Molární hmotnost | 22,96 g / mol |
| Vzhled | bílá pevná látka |
| Hustota | 1,178 g / cm3 |
| Bod tání | 375 ° C (707 ° F; 648 K) |
| Bod varu | 430 ° C (806 ° F; 703 K) se rozkládá |
| reaguje | |
| Rozpustnost | málo rozpustný v ethanol nerozpustný v amoniak |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | -182 kJ / mol |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
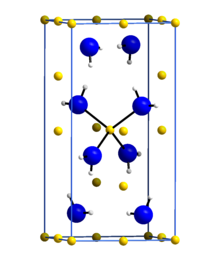
Amid lithný nebo azanid lithný je anorganická sloučenina s chemickým vzorcem LiNH2. Je to bílá pevná látka s tetragonální krystalovou strukturou. Amid lithný lze připravit zpracováním lithium kov s kapalinou amoniak:[1]
- 2Li + 2NH3 → 2LiNH2 + H2
Ostatní amidy lithia
Konjugované báze aminů jsou známé jako amidy. Tak, a amid lithný může také znamenat jakoukoli sloučeninu ve třídě lithné soli an amin. Tyto sloučeniny mají obecnou formu Li
- 2Li + 2R2NH → 2LiNR2 + H2
Amidy lithia jsou velmi reaktivní sloučeniny. Konkrétně jsou silné základny.
Příklady
Tetramethylpiperidid lithný byl krystalizován jako tetramer.[2] Na druhou stranu derivát lithia bis (1-fenylethyl) aminu krystalizuje jako trimer:[3]
 Tetramerický lithium tetramethylpiperidid |  Trimerní bis (1-fenylethyl) amid lithný |
Je také možné vyrobit smíšené oligomery z kovu alkoxidy a amidy.[4] Ty se vztahují k superbáze což jsou směsi alkoxidů kovů a alkylů. Cyklické oligomery se tvoří, když dusík amidu tvoří a sigma vazba na lithium, zatímco dusík osamělý pár váže se na jiný kovový střed.
Jiné organolithné sloučeniny (např BuLi ) se obecně považují za existující a fungující prostřednictvím agregovaných druhů vysokého řádu.
Viz také
Reference
- ^ P. W. Schenk (1963). "Amid lithný". V G. Brauer (ed.). Handbook of Preparative Anorganic Chemistry, 2. vyd. 1. NY, NY: Academic Press. p. 454.
- ^ M.F. Lappert; M. J. Slade; A. Singh; J. L. Atwood; R.D. Rogers; R. Shakir (1983). „Struktura a reaktivita stericky bráněných amidů lithia a jejich diethyletherátů: krystaly a molekulární struktury [Li {N (SiMe3)2} (OEt2)]2 a tetrakis (2,2,6,6-tetramethylpiperidinatolithium) ". Journal of the American Chemical Society. 105 (2): 302–304. doi:10.1021 / ja00340a031.
- ^ D.R. Armstrong; K.W. Henderson; A.R. Kennedy; W. J. Kerr; F.S. Mair; J.H. Moir; P.H. Moran; R. Snaith (1999). „Strukturální studie chirálních amidů lithia [{PhC (H) Me}2NLi] a [PhCH2{PhC (H) Me} NLi · THF] odvozený od a-methylbenzylaminu ". Daltonské transakce: 4063–4068. doi:10.1039 / A904725E.
- ^ K.W. Henderson, D.S.Walther & P.G. Williard (1995). "Identifikace unimetalového komplexu bází pomocí 6Li NMR spektroskopie a analýza monokrystalů ". Journal of the American Chemical Society. 117 (33): 8680–8681. doi:10.1021 / ja00138a030.
- Index společnosti Merck, 11. vydání, 5398.

