Tris (trimethylsilyl) amin - Tris(trimethylsilyl)amine - Wikipedia
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.014.951 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C9H27NSi3 | |
| Molární hmotnost | 233,57 g / mol |
| Vzhled | Voskovitá pevná látka |
| Bod tání | 67–69 ° C |
| Bod varu | 215 ° C (85 ° C při 13 mmHg) |
| Rozpustnost | Nepolární organická rozpouštědla |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
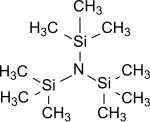
Tris (trimethylsilyl) amin je nejjednodušší tris (trialkylsilyl) amin, který má obecný vzorec (R3Si)3N, ve kterém jsou všechny tři atomy vodíku amoniak jsou nahrazeny trimethylsilylové skupiny (-Si (CH3)3).[1] Tris (trimethylsilyl) amin je již léta v centru vědeckého zájmu jako stabilní meziprodukt v chemii fixace dusíkem (tj. přeměna atmosférické dusík N2 do organických substrátů pod normální podmínky ).[2][3][4]
Výroba
První pokusy o přípravu tris (trimethylsilyl) aminu z amoniaku a trimethylchlorsilan (TMS-Cl) byly neúspěšné ani při teplotách 500 ° C a v přítomnosti báze pyridin.[5][6] Reakce amoniaku a trimethylchlorsilanu se zastaví ve stadiu dvojnásobně silylovaného produktu, bis (dimethylsilyl) aminu (obvykle označovaného jako hexamethyldisilazan, HMDS).

Tris (trimethylsilyl) amin se získá reakcí sodné soli hexamethyldisilazanu - z hexamethyldisilazanu a amid sodný[7] nebo z hexamethyldisilazanu, sodík a styren[1] - s 80% trimethylchlorsilanem výtěžek.[8]
Lithiová sůl hexamethyldisilazanu - z hexamethyldisilazanu a butyllithium[9] nebo z hexamethyldisilazanu a fenyllithium[8] - reaguje s trimethylchlorsilanem pouze ve výtěžcích 50-60% na tris (trimethylsilyl) amin.
Reakce nitridu lithného s trimethylchlorsilanem může být provedena jako reakce v jedné nádobě v THF se 72% výtěžkem.[10]
Vlastnosti
Tris (trimethylsilyl) amin je bezbarvý krystalický produkt[11][12] nebo voskovité[7] pevná látka, která je stabilní vůči vodě a zásadám.[13] Alkoholy nebo kyseliny však štěpí vazbu Si-N za tvorby amoniaku.[7]
Aplikace
Tris (trimethylsilyl) amin jako syntetický stavební blok
Z chlorid antimonitý a tris (trimethylsilyl) amin, nitridoantimon shluk kubánského typu lze vytvořit téměř kvantitativně při –60 ° C.[14]
Ketony mohou být trifluormethylovaný v přítomnosti P4-t-Bu a nonamethyltrisilazan za mírných podmínek ve výtěžku až 84% s inertní látkou fluoroform (HCF3, HFC-23).[15]
The monomer trichlor (trimethylsilyl) -fosforanimin Cl3P = NSiMe3 je tvořen z tris (trimethylsilyl) aminu a chlorid fosforečný v hexan při 0 ° C,

které lze polymerovat na lineární polydichlorfosfazeny s definovanými molekulovými hmotnostmi a polydisperzity.[16]
Cyklický zastřihovač (NPCl2)3 hexachlorcyklotrifosfan je tvořen převážně z tris (trimethylsilyl) aminu a chloridu fosforečného ve vroucím dichlormethanu (asi 40 ° C) mezi jinými oligomery, které při zahřátí na 250 ° C poskytují vysokou molekulovou hmotnost, málo definované polydichlorfosfazeny.
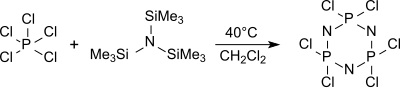
Dusíkatý fluorid NF3 (který se používá mimo jiné pro plazmové leptání křemíkových destiček) lze získat z tris (trimethylsilyl) aminu a fluor při –40 ° C v acetonitril potlačení tvorby dusíku a tetrafluorhydrazinu, které se produkují jako nežádoucí vedlejší produkty při standardní syntéze trifluoridu dusíku z amoniaku nebo fluorid amonný.[17]

Tris (trimethylsilyl) aminový meziprodukt v chemické fixaci dusíku
Technickou fixaci dusíku umožnil proces Haber-Bosch, při kterém se dusík redukcí redukuje na amoniak protonace v přítomnosti železných katalyzátorů pod vysokou tlaky (> 150 bar ) a teploty (> 400 ° C). Při chemické fixaci dusíku (tj. Přeměně atmosférického dusíku za normálních podmínek na reaktivní výchozí materiály pro chemické syntézy, obvykle také amoniak) hraje důležitou roli tris (trimethylsilyl) amin v tzv. silylace, protože se hydrolyzuje vodou na amoniak.
Již v roce 1895 bylo pozorováno, že kovové lithium reaguje s dusíkem na nitrid lithný pokojová teplota.[18] V roce 1972 K. Shiina zjistil, že lithium (jako dárce elektronů ) se tvoří s trimethylsilylchloridem pod ztmavnutím tris (trimethylsilyl) aminu v přítomnosti chlorid chromitý jako katalyzátor při teplotě místnosti s dusíkem použitým pro inertizaci.[2]
Více nedávno, pro redukční silylaci N2místo sodíku byl jako donor elektronů a sodíku použit sodík molybden[19] a sloučeniny železa[3] (jako pentakarbonyl železo nebo feroceny[20]) jako katalyzátory, až 34 ekvivalentů N (Me3Si)3 lze získat na atom železa v katalyzátoru.
S komplexem molybden-ferrocen jako katalyzátorem, a číslo obratu bylo možné dosáhnout až 226.[21]
Dosud vyvinutá katalytická produktivita katalyzátorů pro chemickou fixaci dusíku je navzdory intenzivnímu výzkumu[22] stále o velikost menší než například moderní polymerační katalyzátory metalocenového typu nebo enzymy.
Reference
- ^ A b J. Goubeau, J. Jiminéz-Barberá (1960), „Tris- (trimethylsilyl) -amin“, ZAAC (v němčině), 303 (5–6), s. 217–226, doi:10.1002 / zaac.19603030502
- ^ A b K. Shiina (1972), „Reduktivní silylace molekulárního dusíku fixací na tris (trimethylsilyl) amin“, J. Am. Chem. Soc., 94 (26), s. 9266–9267, doi:10.1021 / ja00781a068
- ^ A b K.C. MacLeod, P.L. Holland (2013), „Nejnovější vývoj v homogenní redukci dinitrogenu molybdenem a železem“, Přírodní chemie, 5, str. 559–565, doi:10,1038 / nchem.1620, PMC 3868624, PMID 23787744
- ^ W.I. Dzik (2016), „Silylace dinitrogenu katalyzovaného hydridodinitrogenem (trifenylfosfinem) kobaltem (I)“, Anorganické látky, 4 (3), s. 21, doi:10,3390 / anorganické látky4030021
- ^ R.O. Sauer (1944), "Deriváty methylchlorsilanů. I. Trimethylsilanol a jeho jednoduché ethery", J. Am. Chem. Soc., 66 (10), s. 1707–1710, doi:10.1021 / ja01238a030
- ^ R.O. Sauer, R.H. Hašek (1946), "Deriváty methylchlorsilanů. IV. Aminy", J. Am. Chem. Soc., 68 (2), s. 241–244, doi:10.1021 / ja01206a028
- ^ A b C C. K. Krüger, H. Niederprüm, M. Schmidt, O. Scherer (1966), H. F. Holtzlow (ed.), Bis (trimethylsilyl) amid sodný a tris (trimethylsilyl) amin, v anorganických syntézách, 8, Hoboken, NJ, USA: John Wiley & Sons, Inc., s. 15–19, doi:10.1002 / 9780470132395.ch5, ISBN 9780470131671CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b U. Wannagat, H. Niederprüm (1961), „Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIII. Silylsubstituierte Alkaliamide“, Chem. Ber. (v němčině), 94 (6), s. 1540–1547, doi:10.1002 / cber.19610940618
- ^ E.H. Amonoo-Neizer, R.A. Shaw, D.O. Skovlin, B.C. Smith, J.W. Rosenthal, W.L. Jolly (1966), H.F.Holtzlow (ed.), Lithium Bis (trimethylsilyl) amid a Tris (trimethylsilyl) amin, v anorganických syntézách, 8, Hoboken, NJ, USA: John Wiley & Sons, Inc., s. 19–22, doi:10.1002 / 9780470132395.ch5, ISBN 9780470131671CS1 maint: více jmen: seznam autorů (odkaz)
- ^ W.L. Lehn (1964), „Příprava tris (trimethylsilyl) - a tris (trimethylstannyl) aminů“, J. Am. Chem. Soc., 86 (2), s. 305, doi:10.1021 / ja01056a057
- ^ Sigma-Aldrich Co., číslo produktu {{{id}}}.
- ^ Nonamethyltrisilazan ve společnosti AlfaAesar, zpřístupněno 28. prosince 2016 (PDF ) (Vyžaduje se JavaScript).
- ^ U. Wannagat, H. Niederprüm (1961), „dreifach silylierte Amine“, ZAAC (v němčině), 308 (1–6), s. 337–351, doi:10.1002 / zaac.19613080135
- ^ M. Rhiel, F. Weller, J. Pebler, K. Dehnicke (1994), "[SbN (SbCl)3(NSbCl2) (NSiMe3)3· SbCl3], ein ungewöhnlicher Nitridoantimonkomplex mit Heterocubanstruktur ", Angew. Chem. (v němčině), 106 (5), s. 599–600, doi:10.1002 / ange.19941060519CS1 maint: více jmen: seznam autorů (odkaz)
- ^ S. Okusu, K. Hirano, E. Tokunaga, N. Shibata (2015), „Organocatalyzed trifluormethylation of ketones and sulfonyl fluorides by fluoroform under a superbase system“, Chemie Otevřít, 4, str. 581–585, doi:10.1002 / otevřeno.201500160, PMC 4608523, PMID 26491635CS1 maint: více jmen: seznam autorů (odkaz)
- ^ USA 5698664 „Syntéza polyfosfazenů s řízenou molekulovou hmotností a polydisperzitou“
- ^ USA 8163262 „Metoda výroby fluoridu dusíku z trimethylsilylaminů“
- ^ H. Deslandres (1895), „Absorpce de l'azote par le lithium à froid“, Comptes rendus, 121, str. 886–887
- ^ Q. Liao, N. Saffon-Merceron, N. Mézailles (2015), „N2 redukce na silylamin v tridentátovém fosfinu / Mo centru: katalýza a mechanistická studie ", ACS Catal., 5 (11), s. 6902–6906, doi:10.1021 / acscatal.5b01626CS1 maint: více jmen: seznam autorů (odkaz)
- ^ M. Yuki, H. Tanaka, K. Sasaki, Y. Miyake, K. Yoshizawa, Y. Nishibayashi (2012), „Železem katalyzovaná transformace molekulárního dinitrogenu na silylamin za podmínek prostředí“, Příroda komunikace, 3, str. 1254, doi:10.1038 / ncomms2264CS1 maint: více jmen: seznam autorů (odkaz)
- ^ H. Tanaka; et al. (2011), „Transformace molekulárního dinitrogenu na silylamin katalyzovaná molybdenem: experimentální a DFT studie o pozoruhodné roli ferrocenyldifosfinových ligandů“, J. Am. Chem. Soc., 133 (10), s. 3498–3506, doi:10.1021 / ja109181n
- ^ Y. Nishibayashi (2015), „Nedávný pokrok v redukci molekulárního dinitrogenu katalyzovanou přechodným kovem za podmínek reakce okolí“, Inorg. Chem., 54 (19), s. 9234–9247, doi:10.1021 / acs.inorgchem.5b00881

![{ displaystyle { begin {matrix} {} { ce {[(CH3) 3Si] 2NH -> [+ { ce {NaNH2}}] [- { ce {NH3}}] NaN [Si ( CH3) 3] 2 -> [+ { ce {ClSi (CH3) 3}}] [- { ce {NaCl}}] N [Si (CH3) 3] 3}} {} end {matice }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78549476135b927dc95d6c81bc50de9b89e0b7ae)

![{ displaystyle { ce {{N2} + {6e ^ {-}} -> [{ ce {Catalyst:}} { ce {Mo}}, { ce {Fe}}, { ce {Co}}]}} { begin {cases} { ce {-> [{ ce {H +}}]}}} {{ce {2NH3}} {} { ce {- > [{ ce {R3Si-X}}] [- , { ce {X -}}]}} & { ce {2N (SiR3) 3}} end {cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aa5ae0b13d71a31c97f22297303dee5ed50221a)
![{ displaystyle { ce {N2 + 6Me3SiCl + 6}} , { color {NavyBlue} { ce {Li}}} { ce {-> [{ ce {CrCl3}}] 2N (SiMe3) 3 + 6}} , { color {NavyBlue} { ce {Li}}} { ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7e5556a07b9c108214c4261b7694524d5af5665)
![{ displaystyle { ce {N2 + 6Me3SiCl + 6}} , { color {Red} { ce {Na}}} { ce {-> [{ ce {Fe-katalyzátor}}] 2N ( SiMe3) 3 + 6}} , { color {Red} { ce {Na}}} { ce {Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecf55c39b3edb4a67900c2fb80e508b6a1b31d91)
![{ displaystyle { color {Red} { ce {N2}}} + { color {NavyBlue} { ce {Me3Si}}} { ce {{Cl} + Na -> [{ ce {Mo / Fe-katalyzátor}}.] [{ Ce {RT}} na vrcholu (1 { ce {atm}})]}} { color {Red} { ce {N}}} { color { NavyBlue} { ce {(Me3Si) 3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e5a412bc2fab4fa67528a1779b7c318068be6f7)