Lithium iridate - Lithium iridate - Wikipedia
| |||
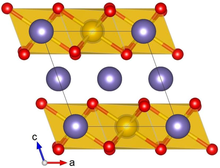 | |||
 Krystalová struktura α-Li2IrO3 s Ir zobrazeným žlutě, Li fialově a O červeně | |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Lithium iridate | |||
| Identifikátory | |||
| Vlastnosti | |||
| Li2IrO3 | |||
| Vzhled | Černé krystaly | ||
| Struktura | |||
| Monoklinický, C2 / m[2] | |||
A = 5,1633 (2) Å, b = 8,9294 (3) Å, C = 5,1219 (2) Å a = 90 °, β = 109,759 (3) °, γ = 90 ° | |||
Jednotky vzorce (Z) | 4 | ||
| Související sloučeniny | |||
jiný anionty | Lithium ruthenate, lithium platinate | ||
jiný kationty | Iridát sodný | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Lithium iridate, Li2IrO3, je chemická sloučenina z lithium, iridium a kyslík. Tvoří černé krystaly se třemi mírně odlišnými vrstvenými atomovými strukturami, α, β a někdy γ. Lithium iridate vykazuje kovové vlastnosti, nezávislé na teplotě elektrická vodivost a mění své magnetické uspořádání z paramagnetické na antiferomagnetický po ochlazení na 15 K.
Struktura
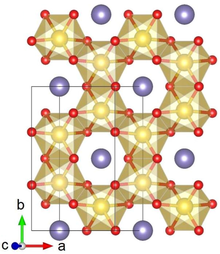
Li2IrO3 typicky krystalizuje ve fázi α nebo β a byla popsána vzácná γ fáze. Krystalová struktura α-Li2IrO3 Skládá se z alternativního stohování hexagonálních vrstev Li a voštin IrO pro sdílení hran6 octahedra s Li uprostřed. Posun v sousedních vrstvách vede k relativně nízké (monoklinické) krystalové symetrii. Li2IrO3 krystaly mají bohaté vady dvojčat, kde ab krystalické roviny jsou otočeny o 120 ° kolem C osa.[1]
Syntéza


Li2IrO3 krystaly lze pěstovat přímo slinování kovů Ir a Li, které oba oxidují během ohřevu v okolní atmosféře. Fáze α se tvoří při 750–1050 ° C, zatímco zahřátí na vyšší teploty vede k β fázi. Použití kovového Li místo tradičnějšího uhličitan lithný, se kterým se snáze manipuluje a skladuje, jsou výsledkem větší krystaly. Γ fázi lze získat kalcinací uhličitanu lithného a iridium (IV) oxid, následované žíháním v roztaveném stavu hydroxid lithný při 700–800 ° C.[1]
Vlastnosti
Iridát lithný je černé barvy a má relativně vysokou, na teplotě nezávislou elektrickou vodivost charakteristickou pro kovy.[2] Jeho obě α a β fáze vykazují Kitaevovu výměnnou vazbu mezi magnetickými spiny pocházejícími z Ir4+ ionty. Tyto otáčky vytvářejí antiferomagnetickou mřížku při teplotách pod 15 K (Teplota Néel, TN), zatímco materiál je výše paramagnetický TN.[1]
Potenciální aplikace
Lithium iridate je materiál potenciální elektrody pro lithium-iontová baterie.[2] Této aplikaci brání vysoké náklady na Ir ve srovnání s levnějším Li2MnO3 alternativní.[3]
Reference
- ^ A b C d E F G Freund, F .; Williams, S. C .; Johnson, R. D .; Coldea, R .; Gegenwart, P .; Jesche, A. (2016). „Růst monokrystalů z oddělených eduktů a jejich aplikace na oxidy lithia přechodných kovů“. Vědecké zprávy. 6: 35362. arXiv:1604.04551. Bibcode:2016NatSR ... 635362F. doi:10.1038 / srep35362. PMC 5066249. PMID 27748402.
- ^ A b C O'Malley, Matthew J .; Verweij, Henk; Woodward, Patrick M. (2008). "Struktura a vlastnosti objednané Li2IrO3 a Li2PtO3". Journal of Solid State Chemistry. 181 (8): 1803. Bibcode:2008JSSCh.181.1803O. doi:10.1016 / j.jssc.2008.04.005.
- ^ Yoshio, Masaki; Brodd, Ralph J .; Kozawa, Akiya (17. července 2010). Lithium-iontové baterie: věda a technologie. Springer Science & Business Media. p. 10. ISBN 978-0-387-34445-4.


