Terc-butyllithium - Tert-Butyllithium
 | |
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC tert-Butyllithium[Citace je zapotřebí ] | |
| Identifikátory | |
3D model (JSmol ) | |
| 3587204 | |
| ChemSpider | |
| Informační karta ECHA | 100.008.939 |
| Číslo ES |
|
PubChem CID | |
| UN číslo | 3394 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| LiC 4H 9 | |
| Molární hmotnost | 64,055 g mol−1 |
| Vzhled | Bezbarvá pevná látka |
| Hustota | 660 mg cm−3 |
| Bod varu | 36 až 40 ° C (97 až 104 ° F; 309 až 313 K) |
| Reaguje | |
| Kyselost (strK.A) | 45–53 |
| Nebezpečí | |
| Piktogramy GHS |      |
| Signální slovo GHS | Nebezpečí |
| H225, H250, H260, H300, H304, H310, H314, H330, H336, H411 | |
| P210, P222, P223, P231 + 232, P370 + 378, P422 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | -6,6 ° C (20,1 ° F; 266,5 K) |
| Související sloučeniny | |
Související sloučeniny | n-Butyllithium |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
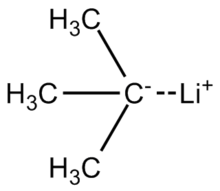
tert-Butyllithium je chemická sloučenina s vzorec (CH3)3CLi. Jako organolithná sloučenina, má aplikace v organická syntéza protože je silný základna, schopné deprotonovat mnoho uhlíkových kyselin, včetně benzen. tert-Butyllithium je komerčně dostupné jako uhlovodíkové roztoky; není obvykle připraven v laboratoři. Jeho syntézu poprvé ohlásil R. B. Woodward v roce 1941.[1]
Struktura a lepení
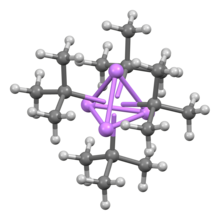
Stejně jako ostatní organolithné sloučeniny, tert-butyllithium je shluk. Zatímco n-butyllithium existuje jak jako hexamer, tak jako tetramer, tert-Butyllithium existuje jako tetramer s a kubánská struktura. Vazba v klastrech organolithia zahrnuje delokalizaci sigma a významnou vazbu Li-Li.[2]
Vazba lithium-uhlík v tert-butyllithium je vysoce polarizované, má asi 40 procent iontový charakter. Molekula reaguje jako a karbanion, jak je reprezentováno těmito dvěma rezonanční struktury.[3] (Vzhledem k výpočtům polarity na vazbě C – Li je „skutečná“ struktura jedné molekuly t-butyllithium je pravděpodobně blízký průměr dvou uvedených rezonančních přispěvatelů, ve kterých má centrální atom uhlíku ~ 50% částečný záporný náboj, zatímco atom lithia má ~ 50% částečný kladný náboj.)
Chemické vlastnosti
Podobný n-butyllithium, tert-butyllithium lze použít pro výměnu lithia s halogeny a pro deprotonaci aminů a aktivovaných sloučenin C-H.
Je známo, že tato sloučenina a další alkyllithné sloučeniny reagují s etherovými rozpouštědly; the poločas rozpadu z tert-butyllithium je 60 minut při 0 ° C v diethylether, 40 minut při -20 ° C v tetrahydrofuran (THF),[4] a asi 11 minut při -70 ° C v dimethoxyethan.[5]V tomto příkladu reakce tert-butyllithium s (THF) je zobrazeno:
Aby se minimalizovala degradace těmito rozpouštědly, zahrnují reakce tert-butyllithium se často provádí při velmi nízkých teplotách ve speciálních rozpouštědlech, jako je Trapp rozpouštědlo směs.
Bezpečnost
tert-butyllithium je samozápalný látka, což znamená, že se snadno vznítí při vystavení vzduchu. (Přesná definice samozápalného materiálu je taková, která „se samovolně vznítí ve vzduchu při 54,55 ° C nebo nižší (130,19 ° F)“.[6]) Rozpouštědla používaná v běžných komerčních přípravcích jsou samy o sobě hořlavá. I když je možné s touto sloučeninou pracovat pomocí přenos kanyly, stopy tert-butyllithium na špičce jehly nebo kanyly se může vznítit a kanylu ucpat lithnými solemi. Zatímco někteří vědci berou tento efekt „pilotního světla“ jako známku toho, že je produkt „čerstvý“ a že se nezhoršil v důsledku času nebo nesprávného skladování / manipulace, jiní dávají přednost uzavření hrotu jehly nebo kanyly do krátké skleněné trubice, která je propláchne se inertním plynem a na každém konci se uzavře septem.[7] Vážné laboratorní nehody tertdošlo k butyllithiu. Například v roce 2008 asistent výzkumu zaměstnanců, Sheharbano Sangji v laboratoři Patrick Harran[8] na University of California, Los Angeles, zemřel poté, co byl těžce spálen požárem zapáleným tert-butyllithium.[9][10][11]
Rozsáhlé reakce mohou vést k reakcím na útěk, požárům a výbuchům tert-butyllithium se smísí s ethery, jako je diethylether a tetrahydrofuran. Může být výhodné použití uhlovodíkových rozpouštědel.
Bezvzduchové techniky jsou důležité, aby se zabránilo prudké reakci této sloučeniny s kyslíkem a vlhkostí ve vzduchu:
- t-BuLi + O2 → t-BuOOLi
- t-BuLi + H2O → t-BuH + LiOH
Reference
- ^ Bartlett, Paul D .; C. Gardner Swain; Robert B.Woodward (1941). „t-butyllithium“. J. Am. Chem. Soc. 63 (11): 3229–3230. doi:10.1021 / ja01856a501.
- ^ Elschenbroich, C. „Organometallics“ (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Organokovová činidla: zdroje nukleofilního uhlíku pro syntézu alkoholu. K. P. C. Vollhardt, N. E. Schore: Organická chemie: struktura a funkce. 3. vydání, 1999, §8.7.
- ^ Stanetty, P; Koller, H .; Mihovilovic, M. (1992). „Řízená orto lithiace 1,1-dimethylethylesteru kyseliny fenylkarbamové (N-BOC-anilin). Revize a vylepšení“. Journal of Organic Chemistry. 57 (25): 6833–6837. doi:10.1021 / jo00051a030.
- ^ Fitt, J. J .; Gschwend, H. E. (1984). „Reakce n-, sek- a terc-butyllithia s dimethoxyethanem (DME): oprava“. Journal of Organic Chemistry. 49: 209–210. doi:10.1021 / jo00175a056.
- ^ SEMI, standardní F6-92, Příručka pro sekundární zadržování systémů potrubní nebezpečného plynu, jak uvádí ChemiCool.com
- ^ Errington, R. M. (1997). Pokročilá praktická anorganická a metalorganická chemie (Knihy Google výňatek). London: Blackie Academic & Professional. 47–48. ISBN 978-0-7514-0225-4.
- ^ „Harran Lab: UCLA“.
- ^ Jyllian Kemsley (22.01.2009). „Výzkumník umírá po požáru v laboratoři“. Chemické a technické novinky.
- ^ Jyllian Kemsley (03.04.2009). „Poučení z UCLA: Podrobnosti experimentu, který vedl k rychlému vyhodnocení vědeckých bezpečnostních postupů výzkumným pracovníkem“. Chemické a technické novinky.
- ^ Los Angeles Times, 2009-03-01




