Lithium diisopropylamid - Lithium diisopropylamide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Lithium diisopropylamid | |
| Ostatní jména LDA | |
| Identifikátory | |
3D model (JSmol ) |
|
| ChemSpider | |
| Informační karta ECHA | 100.021.721 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H14LiN nebo LiN (C.3H7)2 | |
| Molární hmotnost | 107,1233 g / mol |
| Vzhled | bezbarvá pevná látka |
| Hustota | 0,79 g / cm3 |
| Reaguje s vodou | |
| Kyselost (strK.A) | 36 (THF) [1] |
| Nebezpečí | |
| Hlavní nebezpečí | korozívní |
| Související sloučeniny | |
Související sloučeniny | Superbázy |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
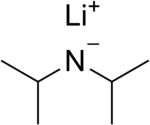
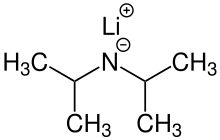
Lithium diisopropylamid (běžně zkráceno LDA) je chemická sloučenina s molekulární vzorec [(CH3)2CH]2NLi. Používá se jako silný základna a byl široce přijímán kvůli svému dobru rozpustnost v nepolárních organických rozpouštědlech a nenukleofilní Příroda. Je to bezbarvá pevná látka, ale obvykle se vytváří a pozoruje pouze v roztoku. Poprvé byl připraven Hamellem a Levinem v roce 1950 spolu s několika dalšími bráněnými lithium-diorganylamidy k provedení deprotonace esterů v poloze α bez napadení karbonylové skupiny.[2]
Příprava a struktura

LDA se běžně tvoří zpracováním ochlazené směsi (0 až -78 ° C) tetrahydrofuran a diisopropylamin s n-butyllithium.[3]
Při disociaci se může stát diisopropylamidový anion protonoval za vzniku diisopropylaminu. Diisopropylamin má a pKa hodnota 36. Proto je jeho konjugovaná báze je vhodný pro deprotonaci sloučenin s vyšší kyselostí, což je důležité, takové slabě kyselé sloučeniny (uhlíkové kyseliny) typu R2CHZ, kde Z = C (O) R ', CO2R 'nebo CN. Běžné protické funkční skupiny, jako jsou alkoholy a karboxylové kyseliny, jsou samozřejmě snadno deprotonovány.
Jako většina organolithná činidla „LDA není sůl, ale je vysoce polární. Vytváří agregáty v roztoku, přičemž rozsah agregace závisí na povaze rozpouštědla. V THF je jeho struktura primárně strukturou solvatované dimer.[4][5] V nepolárních rozpouštědlech, jako je toluen, tvoří teplotně závislou oligomerní rovnováhu. Při pokojové teplotě jsou nejpravděpodobnějšími strukturami trimery a tetramery. Se snižující se teplotou se agregace rozšiřuje na pentamerní a vyšší oligomerní struktury.[6]
Solidní LDA je samozápalný,[7] ale jeho řešení obecně nejsou. Jako takový je komerčně dostupný jako roztok v polárních aprotických rozpouštědlech, jako je THF a ether; pro malé použití (méně než 50 mmol) je však příprava LDA běžná a nákladově efektivnější in situ.

Kinetické vs termodynamické báze
Deprotonace uhlíkových kyselin může probíhat buď řízení kinetické nebo termodynamické reakce. Kinetická řízená deprotonace vyžaduje bázi, která je stéricky bráněna a dostatečně silná, aby nevratně odstranila proton. Například v případě fenylaceton, deprotonace může produkovat dva různé enoláty. Ukázalo se, že LDA deprotonuje methylovou skupinu, což je kinetický průběh deprotonace. Aby se zajistila produkce kinetického produktu, použije se mírný přebytek (1,1 ekv.) Lithiumdiisopropylamidu a keton se přidá k bázi při teplotě –78 ° C. Protože se keton rychle a kvantitativně převádí na enolát a báze je neustále přítomna v přebytku, není keton schopen působit jako protonový člun, aby katalyzoval postupnou tvorbu termodynamického produktu. Slabší základna, jako je alkoxid, který reverzibilně deprotonuje substrát, poskytuje termodynamicky stabilnější benzylový enolát. Alternativou k slabší bázi je použití silné báze, která je přítomna v nižší koncentraci než keton. Například s a kejda z hydrid sodný v THF nebo dimethylformamid (DMF), báze reaguje pouze na rozhraní roztok-pevná látka. Ketonová molekula může být deprotonována na kinetický stránky. Tento izolovat pak se mohou setkat s jinými ketony a termodynamický enolát se vytvoří výměnou protonů, dokonce i v aprotické rozpouštědlo který neobsahuje hydroniové ionty.
LDA však může za určitých podmínek působit jako nukleofil.
Viz také
Reference
- ^ Tabulka Evans pKa
- ^ Hamell, Matthew; Levine, Robert (1950). „Kondenzace způsobené amidy alkalických kovů. Iv. Reakce esterů s amidem lithným a některými substituovanými amidy lithia1“. The Journal of Organic Chemistry. 15: 162–168. doi:10.1021 / jo01147a026.
- ^ Smith, A. P .; Lamba, J. J. S .; Fraser, C. L. (2004). "Efektivní syntéza halogenmethyl-2,2'-bipyridinů: 4,4'-bis (chlormethyl) -2,2'-bipyridin". Organické syntézy.; Kolektivní objem, 10, str. 107
- ^ Williard, P. G .; Salvino, J. M. (1993). "Syntéza, izolace a struktura komplexu LDA-THF". Journal of Organic Chemistry. 58 (1): 1–3. doi:10.1021 / jo00053a001.
- ^ N.D.R. Barnett; RE. Mulvey; W. Clegg; P.A. O'Neil (1991). „Krystalová struktura lithiumdiisopropylamidu (LDA): nekonečné šroubovité uspořádání složené z téměř lineárních jednotek dusík-lithium-dusík se čtyřmi jednotkami na otáčku šroubovice“. Journal of the American Chemical Society. 113 (21): 8187. doi:10.1021 / ja00021a066.
- ^ Neufeld, R .; John, M. & Stalke, D. (2015). „Agregace lithium-diisopropylamidu v uhlovodících bez dárců odhalena metodou DOSY“. Angewandte Chemie International Edition. 54 (24): 6994–6998. doi:10,1002 / anie.201502576. PMID 26014367.
- ^ BL na Sigma-Aldrich
- ^ Jianshe Kong; Tao Meng; Pauline Ting a Jesse Wong (2010). "Příprava ethyl-1-benzyl-4-fluorpiperidin-4-karboxylátu". Organické syntézy. 87: 137. doi:10.15227 / orgsyn.087.0137.
