Samoionizace vody - Self-ionization of water

The samoionizace vody (taky autoionizace vody, a autodisociace vody) je ionizace reakce v čistá voda nebo v vodný roztok, ve kterém molekula vody, H2Ó, deprotonuje (ztrácí jádro jednoho ze svých atomů vodíku), aby se stal a hydroxid ion, OH−. The vodíkové jádro, H+, okamžitě protonuje další molekula vody, která se vytvoří hydronium, H3Ó+. Je to příklad autoprotolýza a je příkladem amfoterní povaha vody.
Rovnovážná konstanta

Chemicky čistá voda má elektrický vodivost 0,055 μS /cm. Podle teorií Svante Arrhenius, to musí být kvůli přítomnosti iontů. Ionty jsou produkovány vodní ionizační reakcí, která platí pro čistou vodu a jakýkoli vodný roztok:
- H2O + H2⇌ H3Ó+ + OH−
Vyjádřeno chemické činnosti A, místo koncentrací termodynamické rovnovážná konstanta pro ionizační reakci vody je:
která se číselně rovná tradičnější termodynamické rovnovážné konstantě psané jako:
za předpokladu, že součet chemických potenciálů H+ a H3Ó+ se formálně rovná dvojnásobku chemického potenciálu H2O při stejné teplotě a tlaku.[1]
Protože většina acidobazických roztoků je obvykle velmi zředěná, aktivita vody se obecně přibližuje k jednotě, což umožňuje vyjádření iontového produktu vody jako:[2]
Ve zředěných vodných roztocích jsou aktivity částic rozpuštěné látky přibližně stejné jako jejich koncentrace. To znamená, že ionizační konstanta, disociační konstanta, samoionizační konstanta, konstanta vodního iontového produktu nebo iontový produkt vody, symbolizované K.w, může být dán:
kde [H3Ó+] je molarita (≈molární koncentrace )[3] vodíku nebo hydroniový ion a [OH−] je koncentrace hydroxid ion. Když je rovnovážná konstanta zapsána jako součin koncentrací (na rozdíl od činností), je nutné provést korekci hodnoty záleží na iontová síla a další faktory (viz níže).[4]
Při 25 ° C a nulové iontové síle K.w je rovný 1.0×10−14. Všimněte si, že stejně jako u všech rovnovážných konstant je výsledek bezrozměrný, protože koncentrace je ve skutečnosti koncentrací relativní k standardní stav, který pro H+ a OH− obě jsou definovány jako 1 molal (nebo molární). Pro většinu praktických účelů jsou molal a molární koncentrace stejné blízko teploty a tlaku okolí. Výsledkem stupnice molární koncentrace jsou hodnoty koncentrace, které zohledňují změny hustoty se změnami teploty nebo tlaku; proto se jedná o měřítko používané v přesných nebo jiných aplikacích, např. pro mořská voda,[3] nebo při zvýšených teplotách, například v tepelných elektrárnách.
Můžeme také definovat pK.w −log10 K.w (což je přibližně 14 při 25 ° C). To je analogické se značkami pH a pK.A pro kyselá disociační konstanta, kde symbol p označuje a logaritmus. Logaritmická forma rovnice rovnovážné konstanty je pK.w = pH + pOH.
Závislost na teplotě, tlaku a iontové síle
 Teplotní závislost ionizační konstanty vody při 25 MPa | 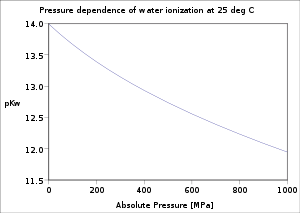 Závislost tlakové ionizační konstanty vody na 25 ° C |  Varianta strK.w s iontovou silou roztoků NaCl při 25 ° C |
Závislost ionizace vody na teplotě a tlaku byla důkladně zkoumána.[5] Hodnota pK.w klesá s rostoucí teplotou z bodu tání ledu na minimum při c. 250 ° C, poté se zvýší až na kritický bod vody c. 374 ° C. S rostoucím tlakem klesá.
| Teplota | Tlak[7] | pK.w |
|---|---|---|
| 0 ° C | 0,10 MPa | 14.95 |
| 25 ° C | 0,10 MPa | 13.99 |
| 50 ° C | 0,10 MPa | 13.26 |
| 75 ° C | 0,10 MPa | 12.70 |
| 100 ° C | 0,10 MPa | 12.25 |
| 150 ° C | 0,47 MPa | 11.64 |
| 200 ° C | 1,5 MPa | 11.31 |
| 250 ° C | 4,0 MPa | 11.20 |
| 300 ° C | 8,7 MPa | 11.34 |
| 350 ° C | 17 MPa | 11.92 |
S elektrolyt řešení, hodnota pK.w je závislá na iontová síla elektrolytu. Hodnoty pro chlorid sodný jsou typické pro elektrolyt 1: 1. S elektrolyty 1: 2, MX2, strK.w klesá se zvyšující se iontovou silou.[8]
Hodnota K.w je obvykle zajímavé v kapalná fáze. Ukázkové hodnoty pro přehřátá pára (plyn) a superkritická voda kapalina jsou uvedeny v tabulce.
Srovnání strK.w hodnoty pro kapalnou vodu, přehřátou páru a nadkritickou vodu.[1] TeplotaTlak350 ° C 400 ° C 450 ° C 500 ° C 600 ° C 800 ° C 0,1 MPa 47.961b 47.873b 47.638b 46.384b 40.785b 17 MPa 11 920 (kapalina)A 25 MPa 11,551 (kapalina)C 16.566 18.135 18.758 19.425 20.113 100 MPa 10 600 (kapalina)C 10.744 11.005 11.381 12.296 13.544 1000 MPa 8,311 (kapalina)C 8.178 8.084 8.019 7.952 7.957
- Poznámky k tabulce. Hodnoty jsou pro superkritickou tekutinu kromě těch, které jsou označeny: A při tlaku nasycení odpovídajícím 350 ° C. b přehřátá pára. C stlačená nebo podchlazená kapalina.
Izotopové účinky
Těžká voda, D2O, ionizuje se méně než normální voda, H2Ó;
- D2O + D2O ⇌ D3Ó+ + OD−
To je způsobeno rovnovážný izotopový efekt, kvantově mechanický účinek připisovaný kyslíku, který tvoří mírně silnější vazbu deuterium protože větší množství deuteria má za následek nižší energie nulového bodu.
Vyjádřeno aktivitami A, namísto koncentrací je termodynamická rovnovážná konstanta pro ionizační reakci těžké vody:
Za předpokladu činnosti D.2O být 1, a za předpokladu, že činnosti D.3Ó+ a OD− jsou blízko aproximovány jejich koncentracemi
Následující tabulka porovnává hodnoty pK.w pro H2O a D2Ó.[9]
pK.w hodnoty pro čistou vodu T / ° C 10 20 25 30 40 50 H2Ó 14.535 14.167 13.997 13.830 13.535 13.262 D2Ó 15.439 15.049 14.869 14.699 14.385 14.103
Ionizační rovnováhy ve směsi vody a těžké vody
V rovnovážných směsích vody a těžké vody se vyskytuje několik druhů: H2O, HDO, D2ACH3Ó+, D3Ó+, H2DĚLAT+, HD2Ó+, HO−, DO−.
Mechanismus
The rychlost reakce pro ionizační reakci
- 2 H2O → H3Ó+ + OH−
závisí na tom aktivační energie, ΔE‡. Podle Boltzmannova distribuce podíl molekul vody, které mají dostatek energie v důsledku tepelné populace, je dán vztahem
kde k je Boltzmannova konstanta. Může tedy dojít k určité disociaci, protože je k dispozici dostatečná tepelná energie. Následující sled událostí byl navržen na základě elektrické pole kolísání kapalné vody.[10] Náhodné kolísání molekulárních pohybů příležitostně (přibližně jednou za 10 hodin na molekulu vody[11]) produkují dostatečně silné elektrické pole, aby rozbilo kyslík – vodík pouto za vzniku hydroxidu (OH−) a hydroniový ion (H3Ó+); vodíkové jádro hydroniového iontu se pohybuje podél molekul vody pomocí Grotthussův mechanismus a změna v vodíková vazba síť v rozpouštědle izoluje dva ionty, které jsou stabilizovány solvatací. Do 1pikosekunda Avšak druhá reorganizace sítě vodíkových vazeb umožňuje rychlý přenos protonů po rozdílu elektrického potenciálu a následnou rekombinaci iontů. Tato časová osa odpovídá době, po které se vodíkové vazby přeorientují ve vodě.[12][13][14]
Inverzní rekombinační reakce
- H3Ó+ + OH− → 2 H2Ó
patří mezi nejrychlejší známé chemické reakce s a konstanta reakční rychlosti z 1.3×1011 M−1 s−1 pokojová teplota. Taková rychlá rychlost je charakteristická pro a reakce řízená difúzí, ve kterém je rychlost omezena rychlostí molekulární difúze.[15]
Vztah k neutrálnímu bodu vody
Molekuly vody se disociují na stejné množství H3Ó+ a OH−, takže jejich koncentrace jsou rovny 1.00×10−7 mol dm−3 při 25 ° C. Řešení, ve kterém H3Ó+ a OH− koncentrace se navzájem rovnají a neutrální řešení. Obecně se pH neutrálního bodu číselně rovná 1/2pK.w.
Čistá voda je neutrální, ale většina vzorků vody obsahuje nečistoty. Pokud je nečistota kyselina nebo základna, ovlivní to koncentrace hydroniového iontu a hydroxidového iontu. Vzorky vody, které jsou vystaveny vzduchu, některé absorbují oxid uhličitý za vzniku kyseliny uhličité (H2CO3) a koncentrace H3Ó+ se zvýší v důsledku reakce H2CO3 + H2O = HCO3− + H3Ó+. Koncentrace OH− se zmenší takovým způsobem, že produkt [H3Ó+][ACH−] zůstává konstantní pro pevnou teplotu a tlak. Tyto vzorky vody tak budou mírně kyselé. Pokud je požadováno pH přesně 7,0, musí být udržováno vhodným způsobem pufrovací roztok.
Viz také
- Acidobazická reakce
- Chemická rovnováha
- Molekulární autoionizace (různých rozpouštědel)
- Standardní vodíková elektroda
Reference
- ^ A b "Uvolnění na ionizační konstantě H."2Ó" (PDF). Vojtěška: Mezinárodní asociace pro vlastnosti vody a páry. Srpna 2007.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “konstanta autoprotolýzy ". doi:10.1351 / goldbook.A00532
- ^ A b Stumm, Werner; Morgan, James (1996). Vodní chemie. Chemické rovnováhy a sazby v přírodních vodách (3. vyd.). John Wiley & Sons, Inc. ISBN 9780471511847.
- ^ Harned, H. S .; Owen, B. B. (1958). Fyzikální chemie elektrolytických roztoků (3. vyd.). New York: Reinhold. str.635.
- ^ Mezinárodní asociace pro vlastnosti vody a páry (IAPWS)
- ^ Bandura, Andrei V .; Lvov, Serguei N. (2006). „Ionizační konstanta vody při širokém rozmezí teplot a hustoty“ (PDF). Žurnál fyzikálních a chemických referenčních údajů. 35 (1): 15–30. Bibcode:2006JPCRD..35 ... 15B. doi:10.1063/1.1928231.
- ^ 0,1 MPa pro T <100 ° C. Tlak nasycení pro T > 100 ° C.
- ^ Harned, H. S .; Owen, B. B. (1958). Fyzikální chemie elektrolytických roztoků (3. vyd.). New York: Reinhold. str.634 –649, 752–754.
- ^ Lide, D. R., ed. (1990). CRC Handbook of Chemistry and Physics (70. vydání). Boca Raton (FL): CRC Press.
- ^ Geissler, P.L .; Dellago, C .; Chandler, D .; Hutter, J .; Parrinello, M. (2001). "Autoionizace v kapalné vodě". Věda. 291 (5511): 2121–2124. Bibcode:2001Sci ... 291.2121G. CiteSeerX 10.1.1.6.4964. doi:10.1126 / science.1056991. PMID 11251111.
- ^ Eigen, M .; De Maeyer, L. (1955). „Untersuchungen über die Kinetik der Neutralization I“ [Vyšetřování kinetiky neutralizace I]. Z. Elektrochem. 59: 986.
- ^ Stillinger, F. H. (1975). Teorie a molekulární modely pro vodu. Adv. Chem. Phys. Pokroky v chemické fyzice. 31. s. 1–101. doi:10.1002 / 9780470143834.ch1. ISBN 9780470143834.
- ^ Rapaport, D. C. (1983). "Vodíkové vazby ve vodě". Mol. Phys. 50 (5): 1151–1162. Bibcode:1983MolPh..50.1151R. doi:10.1080/00268978300102931.
- ^ Chen, S.-H .; Teixeira, J. (1986). Struktura a dynamika nízkoteplotní vody studovaná technikami rozptylu. Adv. Chem. Phys. Pokroky v chemické fyzice. 64. s. 1–45. doi:10.1002 / 9780470142882.ch1. ISBN 9780470142882.
- ^ Tinoco, I .; Sauer, K .; Wang, J. C. (1995). Fyzikální chemie: Principy a aplikace v biologických vědách (3. vyd.). Prentice-Hall. str. 386.
externí odkazy
- Obecná chemie - Autoionizace vody





![K _ {{{ rm {w}}}} = [{{ rm {{H_ {3} O ^ {+}}}}}]] [{{ rm {{OH ^ {-}}}}} ]](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)



![K _ {{{ rm {w}}}} = [{{ rm {{D_ {3} O ^ {+}}}}}]] [{{ rm {{OD ^ {-}}}}} ]](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d7bac103d47e7740413a796f0347b2bf98fda2c)
