Malát dehydrogenáza (dekarboxylační oxaloacetát) (NADP+) - Malate dehydrogenase (oxaloacetate-decarboxylating) (NADP+) - Wikipedia
| NADP-jablečný enzym | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 1.1.1.40 | ||||||||
| Číslo CAS | 9028-47-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Malát dehydrogenáza (dekarboxylační oxaloacetát) (NADP+) (ES 1.1.1.40 ) nebo NADP-jablečný enzym (NADP-ME) je enzym že katalyzuje the chemická reakce v přítomnosti iontu bivalentního kovu:[1]
- (S) -malát + NADP+ pyruvát + CO2 + NADPH
Tedy dva substráty tohoto enzymu jsou (S) -malát a NADP+, zatímco jeho 3 produkty jsou pyruvát, CO2, a NADPH. Malát je oxidovaný na pyruvát a CO2a NADP+ je snížena na NADPH.
Tento enzym patří do rodiny oxidoreduktázy konkrétně těch, kteří působí na CH-OH skupinu dárce s NAD+ nebo NADP+ jako akceptor. The systematické jméno této třídy enzymů je (S) -malát: NADP+ oxidoreduktáza (oxaloacetát-dekarboxylační). Tento enzym se účastní metabolismus pyruvátu a uhlíková fixace. NADP-jablečný enzym je jedním ze tří dekarboxylačních enzymů používaných v mechanismech koncentrace anorganického uhlíku C4 a VAČKA rostliny. Ostatní jsou NAD-jablečný enzym a PEP karboxykináza.[2][3] Ačkoli často převládá jedna ze tří fotosyntetických dekarboxyláz, je prokázáno, že existuje i současná operace všech tří.[4]

Struktura enzymu
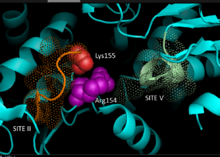
Na základě krystalografie údaje o homologní NADP závislé jablečné enzymy savčího původu, 3D model pro C.4 byla vyvinuta cesta NADP-ME v rostlinách, která identifikuje klíčové zbytky zapojené do vazby na substrát nebo katalýzy. Dinukleotid vazba zahrnuje dva glycin - bohaté motivy GXGXXG, a hydrofobní drážka zahrnující alespoň šest aminokyselinových zbytků a záporně nabitý zbytek na konci βB řetězce.[5][6] The primární sekvence prvního motivu, 240GLGDLG245, je konsensuální marker pro vazbu fosfátů, dokazující zapojení s vazbou NADP, zatímco druhý motiv bohatý na glycin přijímá klasický Rossmann fold —Také typický ukazatel pro NADP kofaktor vazba.[7] Mutageneze experimenty na kukuřici NADP-ME podporovaly současný model.[1] Valine substituce glycinu v kterékoli oblasti motivu způsobila, že enzym byl zcela neaktivní, zatímco spektrální analýza neukázala žádné zásadní změny oproti formě divokého typu. Data spíše naznačují přímé poškození klíčového zbytku zapojeného do vazby nebo katalýzy než mezidoménového zbytku ovlivňujícího konformační stabilitu. Navíc klíč arginin Bylo prokázáno, že zbytek v místě 237 interaguje s malát a NADP+ substráty, které tvoří klíčové příznivé elektrostatický interakce se záporně nabitou karboxylovou kyselinou a fosfátovou skupinou. Objasnění, zda zbytek hraje roli při vázání substrátu nebo umístění substrátu pro katalýzu, je třeba ještě určit.[8] Lysin zbytek 255 byl implikován jako katalytický základna pro reaktivitu enzymů; k prokázání jeho biochemické role jsou však stále zapotřebí další studie.[1]
Strukturální studie
Od roku 2007[Aktualizace], 3 struktur byly pro tuto třídu enzymů vyřešeny pomocí PDB přístupové kódy 1GQ2, 1GZ4, a 2AW5.[Citace je zapotřebí ]
Biologická funkce
V širším kontextu se jablečné enzymy nacházejí v širokém rozmezí eukaryotický je prokázáno, že organismy, od hub až po savce, se lokalizují v řadě subcelulárních poloh, včetně cytosol, mitochondrie, a chloroplast. C4 NADP-ME je konkrétně v rostlinách lokalizovaných v plášť svazku chloroplasty.[1]
Během C.4 fotosyntéza, vyvinutá cesta ke zvýšení lokalizovaného CO2 koncentrace pod hrozbou zvýšené fotorespirace, CO2 je zachycen uvnitř mezofyl buňky, opraveno jako oxaloacetát, převedeny na malát a uvolněny interně v buňkách pláště svazku k přímému krmení RuBisCO aktivita.[9] Toto vydání fixního CO2, vyvolané příznivou dekarboxylací malátu na pyruvát, je zprostředkován jablečným enzymem závislým na NADP. Ve skutečnosti význam aktivity NADP-ME v CO2 zachování je doloženo studií provedenou na transgenních rostlinách vykazujících ztrátu funkční mutace NADP-ME. Rostliny s mutace zaznamenali 40% aktivitu divokého typu NADP-ME a dosáhli významně sníženého CO2 absorpce i při vysokých mezibuněčných hladinách CO2, což dokazuje biologický význam NADP-ME při regulaci uhlíku tok směrem k Calvinův cyklus.[10][11]
Regulace enzymů
NADP-ME výraz bylo prokázáno, že je regulováno abiotický stresové faktory. Pro CAM rostliny způsobují podmínky sucha stomie do značné míry zůstat zavřený, aby nedošlo ke ztrátě vody evapotranspirace, což bohužel vede k CO2 hladovění. Jako kompenzace aktivuje uzavřený stomie translaci NADP-ME k posílení vysoké účinnosti CO2 asimilace během krátkých intervalů CO2 příjem, umožňující uhlíková fixace pokračovat.
Kromě regulace v delším časovém měřítku prostřednictvím řízení exprese může dojít i k regulaci v krátkodobém měřítku alosterický mechanismy. C4 Ukázalo se, že NADP-ME je částečně inhibován Podklad, malát, navrhuje dvě nezávislá vazebná místa: jedno na aktivním místě a jedno na alosterickém místě. Inhibiční účinek se však projevuje pH -závislost - existuje při pH 7, ale ne při pH 8. Ovládání enzym aktivita způsobená změnami pH odpovídá hypotéze, že NADP-ME je nejaktivnější fotosyntéza probíhá: Aktivní světelné reakce vedou ke zvýšení zásaditosti uvnitř chloroplast stroma, umístění NADP-ME, což vedlo ke snížení inhibiční účinek malátu na NADP-ME a tím podporuje aktivnější stav. Naopak zpomalené světelné reakce vedou k nárůstu kyselost ve stromatu, podporující inhibici NADP-ME malátem. Protože vysokoenergetické produkty světelné reakce, NADPH a ATP, jsou vyžadovány pro Calvinův cyklus pokračovat, hromadění CO2 bez nich není užitečné, což vysvětluje potřebu regulačního mechanismu.[12]
Tento protein může používat morpheein model alosterická regulace.[13]
Vývoj
NADP-jablečný enzym, stejně jako všechny ostatní C.4 dekarboxylázy, nevyvíjely se de novo pro CO2 sdružování na pomoc RuBisCO.[14] Spíše byl NADP-ME přímo transformován z C.3 druh v fotosyntéza, a ještě dřívější původ ze starověkého cystolika předek. V cytosol, enzym existoval jako řada úklidů izoformy zaměřené na různé funkce včetně údržby úrovně malátu během hypoxie, mikrospora oddělení a patogen obrana. Pokud jde o mechanismus evoluce, C.4 Předpokládá se, že funkčnost pochází z chyby duplikace genů uvnitř promotér regiony, spouštění nadměrná exprese v buňkách pláště svazku a v kódující oblasti generování neofunkcionalizace.[15] Výběr pro CO2 konzervační funkce a také zvýšené využití vody a dusíku ve stresových podmínkách pak byly formovány přirozenými tlaky.[16]
Viz také
- ME1 (lidský gen)
Reference
- ^ A b C d Detarsio E, Wheeler MC, Campos Bermúdez VA, Andreo CS, Drincovich MF (duben 2003). "Kukuřičný C4 NADP-jablečný enzym. Exprese v Escherichia coli a charakterizace místně řízených mutantů na domnělých místech vázajících nukleosidy". The Journal of Biological Chemistry. 278 (16): 13757–64. doi:10,1074 / jbc.M212530200. PMID 12562758.
- ^ Kanai, Ryuzi; Edwards, Gerald E. (1999). „Biochemie C.4 Fotosyntéza". In Sage, Rowan F .; Monson, Russell K. (eds.). C4 Biologie rostlin. Akademický tisk. str. 49–87. ISBN 978-0-08-052839-7.
- ^ Christopher JT, Holtum J (září 1996). "Vzory rozdělování uhlíku v listech druhů metabolismu kyselin Crassulacean během odkyselení". Fyziologie rostlin. 112 (1): 393–399. doi:10.1104 / pp.112.1.393. PMC 157961. PMID 12226397.
- ^ Furumoto T, Hata S, Izui K (říjen 1999). „cDNA klonování a charakterizace kukuřičné fosfoenolpyruvátkarboxykinázy, buněčného buněčného specifického enzymu“. Molekulární biologie rostlin. 41 (3): 301–11. doi:10.1023 / A: 1006317120460. PMID 10598098. S2CID 8302572.
- ^ Rossman, Michael G .; Liljas, Anders; Brändén, Carl-Ivar; Banaszak, Leonard J. (1975). "Evoluční a strukturní vztahy mezi dehydrogenázami". V Boyer, Paul D. (ed.). Enzymy. 11. 61–102. doi:10.1016 / S1874-6047 (08) 60210-3. ISBN 978-0-12-122711-1.
- ^ Bellamacina CR (září 1996). „Nikotinamidový dinukleotidový vazebný motiv: srovnání proteinů vázajících nukleotidy“. FASEB Journal. 10 (11): 1257–69. doi:10.1096 / fasebj.10.11.8836039. PMID 8836039.
- ^ Rothermel BA, Nelson T (listopad 1989). "Primární struktura kukuřičného jablečného enzymu závislého na NADP". The Journal of Biological Chemistry. 264 (33): 19587–92. PMID 2584183.
- ^ Coleman, David E .; Rao, G. S. Jagannatha; Goldsmith, E. J .; Cook, Paul F .; Harris, Ben G. (červen 2002). "Krystalová struktura jablečného enzymu z Ascaris suum V komplexu s nikotinamidadeninindinukleotidem v rozlišení 2,3 Å “. Biochemie. 41 (22): 6928–38. doi:10.1021 / bi0255120. PMID 12033925.
- ^ Edwards GE, Franceschi VR, Voznesenskaya EV (2004). „Jednobuněčná fotosyntéza C (4) versus paradigma dvou buněk (Kranz)“. Roční přehled biologie rostlin. 55: 173–96. doi:10.1146 / annurev.arplant.55.031903.141725. PMID 15377218.
- ^ Pengelly JJ, Tan J, Furbank RT, von Caemmerer S (říjen 2012). „Antisense redukce NADP-jablečného enzymu u Flaveria bidentis snižuje tok CO2 cyklem C4“. Fyziologie rostlin. 160 (2): 1070–80. doi:10.1104 / pp.112.203240. PMC 3461530. PMID 22846191.
- ^ Rathnam CK (leden 1979). "Metabolická regulace toku uhlíku během fotosyntézy C4: II. Důkaz in situ pro reffixaci fotorespiračního CO2 pomocí C4 fosfoenolpyruvátkarboxylázy". Planta. 145 (1): 13–23. doi:10.1007 / BF00379923. PMID 24317560. S2CID 22462853.
- ^ Saigo M, Tronconi MA, Gerrard Wheeler MC, Alvarez CE, Drincovich MF, Andreo CS (listopad 2013). „Biochemické přístupy ke studiu evoluce fotosyntézy C4: případ dekarboxyláz z jablečných enzymů“. Fotosyntetický výzkum. 117 (1–3): 177–87. doi:10.1007 / s11120-013-9879-1. PMID 23832612. S2CID 17803651.
- ^ Selwood T, Jaffe EK (březen 2012). „Dynamické disociační homo-oligomery a kontrola funkce proteinu“. Archivy biochemie a biofyziky. 519 (2): 131–43. doi:10.1016 / j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ Maier A, Zell MB, Maurino VG (květen 2011). „Malát dekarboxylázy: vývoj a role izoforem NAD (P) -ME u druhů provádějících fotosyntézu C (4) a C (3)“. Journal of Experimental Botany. 62 (9): 3061–9. doi:10.1093 / jxb / err024. PMID 21459769.
- ^ Monson, Russell K. (květen 2003). „Duplikace genů, nefunkčnost a vývoj fotosyntézy C4“. International Journal of Plant Sciences. 164 (S3): S43 – S54. doi:10.1086/368400. S2CID 84685191. INIST:14976375.
- ^ Drincovich MF, Casati P, Andreo CS (únor 2001). „NADP-jablečný enzym z rostlin: všudypřítomný enzym podílející se na různých metabolických drahách“. FEBS Dopisy. 490 (1–2): 1–6. doi:10.1016 / S0014-5793 (00) 02331-0. PMID 11172800. S2CID 31317255.
Další čtení
- Harary, Isaac; Korey, Saul R .; Ochoa, Severo (srpen 1953). „Biosyntéza dikarboxylových kyselin fixací oxidu uhličitého. VII. Rovnováha reakce jablečného enzymu“. The Journal of Biological Chemistry. 203 (2): 595–604. PMID 13084629.
- Ochoa S, Mehler AH, Kornberg A (červenec 1948). "Biosyntéza dikarboxylových kyselin fixací oxidu uhličitého; izolace a vlastnosti enzymu z holubích jater katalyzující reverzibilní oxidační dekarboxylaci kyseliny 1-jablečné". The Journal of Biological Chemistry. 174 (3): 979–1000. PMID 18871257.
- Rutter WJ, Lardy HA (srpen 1958). "Čištění a vlastnosti jablečného enzymu z holubích jater". The Journal of Biological Chemistry. 233 (2): 374–82. PMID 13563505.
- Stickland RG (prosinec 1959). „Některé vlastnosti jablečného enzymu holubích jater. 1. Přeměna malátu na pyruvát“. The Biochemical Journal. 73 (4): 646–54. doi:10.1042 / bj0730646. PMC 1197115. PMID 13834656.
- Stickland RG (prosinec 1959). „Některé vlastnosti jablečného enzymu holubích jater. 2. Syntéza malátu z pyruvátu“. The Biochemical Journal. 73 (4): 654–9. doi:10.1042 / bj0730654. PMC 1197116. PMID 13834657.
- Walker DA (únor 1960). "Fyziologické studie metabolismu kyselin. 7. Jablečný enzym z Kalanchoe crenata: účinky koncentrace oxidu uhličitého". The Biochemical Journal. 74 (2): 216–23. doi:10.1042 / bj0740216. PMC 1204145. PMID 13842495.

