Tryptofanáza - Tryptophanase - Wikipedia
| tryptofanáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Tryptofanázový tetramer, E.Coli | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.1.99.1 | ||||||||
| Číslo CAS | 9024-00-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a tryptofanáza (ES 4.1.99.1 ) je enzym že katalyzuje the chemická reakce
- L-tryptofan + H2Ó indol + pyruvát + NH3
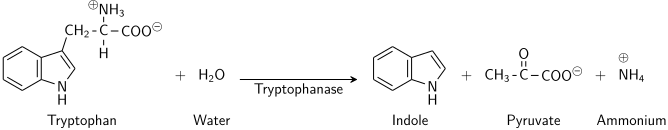
Tedy dva substráty tohoto enzymu jsou L-tryptofan a H2Ó, zatímco jeho 3 produkty jsou indol, pyruvát, a NH3.
Tento enzym patří do rodiny lyázy, konkrétně ve třídě „catch-all“ lyáz uhlík-uhlík. The systematické jméno této třídy enzymů je L-tryptofan indol-lyáza (deaminující; tvořící pyruvát). Mezi další běžně používaná jména patří L-tryptofanáza, a L-tryptofan indol-lyáza (deaminující). Tento enzym se účastní metabolismus tryptofanu a metabolismus dusíku. Má 2 kofaktory: pyridoxal fosfát, a Draslík.
Strukturální studie
Ke konci roku 2007, 3 struktur byly pro tuto třídu enzymů vyřešeny pomocí PDB přístupové kódy 1AX4, 2C44, a 2OQX.
Reference
- BURNS RO, DEMOSS RD (1962). "Vlastnosti tryptofanázy z Escherichia coli". Biochim. Biophys. Acta. 65 (2): 233–44. doi:10.1016/0006-3002(62)91042-9. PMID 14017164.
- Cowell JL, Maser K, DeMoss, RD (1973). "Tryptofanáza z Aeromonas liquifaciens. Čištění, molekulová hmotnost a některé chemické, katalytické a imunologické vlastnosti". Biochim. Biophys. Acta. 315: 449–463. doi:10.1016/0005-2744(73)90276-3.
- NEWTON WA, MORINO Y, SNELL EE (1965). "Vlastnosti krystalické tryptofanázy". J. Biol. Chem. 240: 1211–8. PMID 14284727.
externí odkazy
 Média související s Tryptofanáza na Wikimedia Commons
Média související s Tryptofanáza na Wikimedia Commons
| Tento EC 4.1 enzym související článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

