Neuromuskulární spojení - Neuromuscular junction
| Neuromuskulární spojení | |
|---|---|
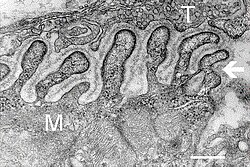 Elektronový mikrofotografie ukazující průřez neuromuskulárním spojem. T je axonální terminál, M je svalové vlákno. Šipka ukazuje spojovací záhyby s bazální lamina. Aktivní zóny jsou viditelné na špičkách mezi záhyby. Měřítko je 0,3 μm. Zdroj: NIMH | |
 Podrobný pohled na neuromuskulární spojení: | |
| Detaily | |
| Identifikátory | |
| latinský | synapssis neuromuscularis; junctio neuromuscularis |
| Pletivo | D009469 |
| TH | H2.00.06.1.02001 |
| FMA | 61803 |
| Anatomická terminologie | |


A neuromuskulární spojení (nebo myoneurální spojení) je chemická synapse mezi a motorický neuron a a svalové vlákno.[1] Umožňuje motorickému neuronu přenášet signál do svalového vlákna, což způsobuje svalová kontrakce.
Svaly vyžadují inervaci, aby fungovaly - a dokonce jen k udržení svalový tonus, vyhýbat se atrofie. V neuromuskulární systém nervy z centrální nervový systém a periferní nervový systém jsou propojeny a spolupracují se svaly.[2] Synaptický přenos na neuromuskulárním spojení začíná, když akční potenciál dosáhne presynaptického terminálu motorického neuronu, který se aktivuje napěťově řízené vápníkové kanály umožnit iontům vápníku vstoupit do neuronu. Vápenaté ionty se vážou na senzorové proteiny (synaptotagmin ) na synaptické vezikuly, spouštějící fúzi vezikul s buněčnou membránou a následně neurotransmiter uvolňování z motorického neuronu do synaptická štěrbina. v obratlovců se uvolňují motorické neurony acetylcholin (ACh), neurotransmiter s malou molekulou, který difunduje přes synaptickou štěrbinu a váže se na nikotinové acetylcholinové receptory (nAChRs) na buněčné membráně svalového vlákna, také známý jako sarcolemma. nAChR jsou ionotropní receptory, což znamená, že slouží jako ligand - bránou iontové kanály. Vazba ACh na receptor může depolarizovat svalové vlákno a způsobit kaskádu, která nakonec vyústí ve svalovou kontrakci.
Onemocnění nervosvalového spojení může být genetický a autoimunitní původ. Genetické poruchy, jako např Duchennova svalová dystrofie, mohou vzniknout z mutovaných strukturních proteinů, které tvoří neuromuskulární spojení, zatímco autoimunitní onemocnění, jako je myasthenia gravis se vyskytují, když se produkují protilátky proti nikotinovým acetylcholinovým receptorům na sarkolemu.
Struktura a funkce

Kvantový přenos
Na neuromuskulární spojení presynaptické motorické axony končí 30 nanometrů od buněčné membrány nebo sarcolemma svalového vlákna. Sarcolemma na křižovatce ano invaginace nazývané postjunkční záhyby, které zvyšují jeho povrchovou plochu obrácenou k synaptické štěrbině.[3] Tyto postjunkční záhyby tvoří koncovou desku motoru, která je posetá nikotinové acetylcholinové receptory (nAChRs) při hustotě 10 000 receptorů / mikrometr2.[4] Presynaptické axony končí v boulích nazývaných terminální boutony (nebo presynaptické terminály), které vyčnívají směrem k postjunkčním záhybům sarkolemmy. V žábě obsahuje každý motorický nervový terminál asi 300 000 vezikuly, s průměrným průměrem 0,05 mikrometrů. Vezikuly obsahují acetylcholin. Některé z těchto vezikul jsou shromážděny do skupin po padesáti, umístěných v aktivních zónách blízko nervové membrány. Aktivní zóny jsou od sebe vzdáleny přibližně 1 mikrometr. Rozštěp 30 nanometrů mezi nervovým zakončením a koncovou deskou obsahuje síť acetylcholinesterázy (AChE) v hustotě 2 600 molekul enzymu / mikrometr2, udržované na místě strukturálními proteiny dystrofin a rapsyn. Přítomen je také receptor tyrosinkinázy protein Pižmo, signální protein podílející se na vývoji neuromuskulárního spojení, který také udržuje na místě rapsyn.[3]
Asi jednou za sekundu v klidové křižovatce se náhodně spojí jeden ze synaptických vezikul s presynaptickým neuronem buněčná membrána v procesu zprostředkovaném SNARE bílkoviny. Fúze vede k vyprázdnění obsahu vezikul 7 000–10 000 molekul acetylcholinu do synaptická štěrbina, proces známý jako exocytóza.[5] V důsledku toho exocytóza uvolňuje acetylcholin v paketech, které se nazývají kvanta. Acetylcholinové kvantum difunduje sítí acetylcholinesterázy, kde vysoká lokální koncentrace vysílače zabírá všechna vazebná místa na enzymu v jeho cestě. Acetylcholin, který se dostává na koncovou desku, aktivuje ~ 2 000 acetylcholinových receptorů a otevírá jejich iontové kanály, což umožňuje iontům sodíku pohybovat se na koncovou desku a vytváří depolarizaci ~ 0,5 mV známou jako potenciál miniaturní endplate (MEPP). V době, kdy je acetylcholin uvolňován z receptorů, acetylcholinesteráza zničila svůj vázaný ACh, což trvá přibližně 0,16 ms, a proto je k dispozici ke zničení ACh uvolněného z receptorů.
Když je motorický nerv stimulován, mezi příchodem nervového impulsu do terminálů motorického nervu a první reakcí koncové desky je zpoždění pouze 0,5 až 0,8 ms. [6] Příchod motorického nervu akční potenciál na presynaptickém neuronovém terminálu se otevře napěťově závislé vápníkové kanály a Ca2+ ionty tok z extracelulární tekutiny do presynaptických neuronů cytosol. Tento příliv Ca2+ způsobuje několik stovek neurotransmiter -obsahující vezikuly splynout s buněčnou membránou presynaptického neuronu SNARE proteiny, aby uvolnily své acetylcholinové kvantum exocytózou. Depolarizace endplate uvolněným acetylcholinem se nazývá potenciál endplate (EPP). EPP je dosaženo, když ACh váže nikotinové acetylcholinové receptory (nAChR) na koncové desce motoru a způsobuje příliv sodíkových iontů. Tento příliv sodíkových iontů generuje EPP (depolarizaci) a spouští akční potenciál, který prochází podél sarkolemmy a do svalového vlákna přes T-tubuly (příčné tubuly) pomocí napěťově řízených sodíkových kanálů.[7] Vedení akčních potenciálů podél T-tubulů stimuluje otevírání napěťově řízeného Ca2+ kanály, které jsou mechanicky spojeny s Ca2+ uvolňovací kanály v sarkoplazmatickém retikulu.[8] Ca2+ pak difunduje ze sarkoplazmatického retikula do myofibril, takže může stimulovat kontrakci. Potenciál endplate je tedy odpovědný za nastavení akčního potenciálu ve svalovém vlákně, který spouští svalovou kontrakci. Přenos z nervu do svalu je tak rychlý, protože každé kvantum acetylcholinu dosáhne na koncovou desku v milimolárních koncentracích, dostatečně vysokých na to, aby se kombinovalo s receptorem s nízkou afinitou, který pak rychle uvolní vázaný vysílač.[Citace je zapotřebí ]
Acetylcholinové receptory

- Receptor spojený s iontovým kanálem
- Ionty
- Ligand (jako acetylcholin )
Acetylcholin je neurotransmiter syntetizováno z potravy cholin a acetyl-CoA (ACoA) a podílí se na stimulaci svalové tkáně v obratlovců stejně jako v některých bezobratlý zvířata. U obratlovců je subtyp receptoru acetylcholinu, který se nachází na neuromuskulárním spojení kosterních svalů, nikotinový acetylcholinový receptor (nAChR), což je a iontový kanál řízený ligandem. Každá podjednotka tohoto receptoru má charakteristickou „cys-smyčku“, která se skládá z a cystein zbytek následovaný 13 aminokyselina zbytky a další cysteinový zbytek. Dva cysteinové zbytky tvoří a disulfidová vazba což má za následek receptor „cys-loop“, který je schopen vázat acetylcholin a další ligandy. Tyto receptory cys-loop se nacházejí pouze v eukaryoty, ale prokaryoty mají ACh receptory s podobnými vlastnostmi.[4] Ne všechny druhy používají a cholinergní neuromuskulární spojení; např. rak a ovocné mušky mají glutamátergní neuromuskulární spojení.[3]
AChR na kosterním neuromuskulárním spojení tvoří heteropentamery složené ze dvou α, jedné β, jedné ɛ a jedné δ podjednotky.[9] Když se jediný ligand ACh váže na jednu z podjednotek α receptoru ACh, indukuje a konformační změna na rozhraní s druhou podjednotkou AChR α. Tato konformační změna má za následek zvýšení afinita druhé podjednotky α pro druhý ligand ACh. AChR proto kvůli tomu vykazují sigmoidální disociační křivku kooperativní vazba.[4] Přítomnost neaktivní, intermediární struktury receptoru s jednoduchým vázaným ligandem udržuje ACh v synapse, která by jinak mohla být ztracena cholinesteráza hydrolýza nebo difúze. Perzistence těchto ACh ligandů v synapse může způsobit prodlouženou postsynaptickou reakci.[10]
Rozvoj
Vývoj neuromuskulárního spojení vyžaduje signalizaci jak z terminálu motorického neuronu, tak z centrální oblasti svalové buňky. Během vývoje svalové buňky produkují acetylcholinové receptory (AChR) a exprimují je v centrálních oblastech v procesu zvaném prepatterning. Úšklebek, heparin proteoglykan Předpokládá se, že kináza MuSK pomáhá stabilizovat akumulaci AChR v centrálních oblastech myocytů. MuSK je receptor tyrosinkináza — Znamenat, že indukuje buněčnou signalizaci vazbou fosfát molekuly do vlastních regionů tyrosiny a na další cíle v EU cytoplazma.[11] Po aktivaci ligandem agrinem MuSK signalizuje prostřednictvím dvou proteinů nazývaných „Dok-7 " a "rapsyn ", k vyvolání" shlukování "acetylcholinových receptorů.[12] Uvolňování ACh vývojem motorických neuronů produkuje ve svalové buňce postsynaptické potenciály, které pozitivně posilují lokalizaci a stabilizaci vyvíjejícího se neuromuskulárního spojení.[13]
Tato zjištění byla částečně prokázána myší "knokaut "studie. U myší, které mají nedostatek buď agrinu nebo MuSK, se neuromuskulární spojení netvoří. Dále, myši s nedostatkem Dok-7 netvořily ani shluky acetylcholinových receptorů, ani neuromuskulární synapse.[14]
Vývoj neuromuskulárních spojení je většinou studován u modelových organismů, jako jsou hlodavci. Kromě toho byl v roce 2015 vytvořen zcela lidský nervosvalový spoj in vitro s použitím člověka embryonální kmenové buňky a somatické svalové kmenové buňky.[15] V tomto modelu presynaptický motorické neurony jsou aktivovány pomocí optogenetika a v reakci synapticky spojená svalová vlákna škubají při světelné stimulaci.
Metody výzkumu
José del Castillo a Bernard Katz použili ionoforézu ke stanovení polohy a hustoty nikotinové acetylcholinové receptory (nAChRs) na neuromuskulárním spojení. Pomocí této techniky byla mikroelektroda umístěna uvnitř motorické koncové desky svalového vlákna a mikropipeta naplněná acetylcholinem (ACh) je umístěna přímo před koncovou desku v synaptické štěrbině. Na špičku mikropipety bylo přivedeno kladné napětí, které způsobilo uvolnění pozitivně nabitých molekul ACh z pipety. Tyto ligandy proudily do prostoru představujícího synaptickou rozštěp a vázané na AChR. Intracelulární mikroelektroda monitorovala amplituda z depolarizace motorické koncové desky v reakci na vazbu ACh na nikotinové (ionotropní) receptory. Katz a del Castillo ukázali, že amplituda depolarizace (excitační postsynaptický potenciál ) záviselo na blízkosti mikropipety uvolňující ionty ACh k čelní desce. Čím dále byla mikropipeta od koncové desky motoru, tím menší byla depolarizace ve svalovém vlákně. To vědcům umožnilo určit, že nikotinové receptory byly lokalizovány na koncové desce motoru ve vysoké hustotě.[3][4]
Toxiny se také používají ke stanovení umístění acetylcholinových receptorů na neuromuskulárním spojení. α-bungarotoxin je toxin nalezený v hadím druhu Bungarus multicinctus který působí jako antagonista ACh a nevratně se váže na AChR. Spojením testovatelných enzymů, jako je křenová peroxidáza (HRP) nebo fluorescenční proteiny, jako je zelený fluorescenční protein (GFP) na α-bungarotoxin, lze AChR vizualizovat a kvantifikovat.[3]
Toxiny, které ovlivňují neuromuskulární spojení
Nervové plyny
Nervové plyny a alkohol poškozují tuto oblast.

Botulotoxin
Botulotoxin (aka botulinový neurotoxin, BoNT a prodávaný pod obchodním názvem Botox) inhibuje uvolňování acetylcholinu na neuromuskulárním spojení interferencí s proteiny SNARE.[3] Tento toxin prochází do nervového zakončení procesem endocytóza a následně interferuje s proteiny SNARE, které jsou nezbytné pro uvolňování ACh. Tímto způsobem indukuje přechodný jev ochablá paralýza a chemická denervace lokalizovaná na pruhovaný sval, který ovlivnil. Inhibice uvolňování ACh se projeví až přibližně dva týdny po aplikaci injekce. Tři měsíce poté, co dojde k inhibici, začne neuronální aktivita znovu získávat částečnou funkci a šest měsíců je obnovena úplná neuronální funkce.[16]
Tetanový toxin
Tetanový toxin, také známý jako tetanospasmin je silný neurotoxin produkovaný Clostridium tetani a způsobuje chorobný stav, tetanus. LD50 Bylo naměřeno přibližně 1 ng tohoto toxinu na přibližně 1 ng / kg, což je na druhém místě za botulotoxinem D jako nejsmrtelnějším toxinem na světě. Funguje velmi podobně jako neurotoxin botunlinum (BoNT) připojením a endocytózou do terminálu presynaptického nervu a interferencí s proteinovými komplexy SNARE. Od BoNT se liší několika způsoby, nejzřejměji v koncovém stavu, kde tetanospasmin prokazuje rigidní / spastická paralýza na rozdíl od ochablé paralýzy prokázané u BoNT.
Latrotoxin
Latrotoxin (α-Latrotoxin) nalezený v jedu vdovských pavouků také ovlivňuje neuromuskulární spojení tím, že způsobuje uvolňování acetylcholinu z presynaptické buňky. Mechanismy účinku zahrnují vazbu na receptory presynaptické buňky aktivující IP3 / DAG cesta a uvolňování vápníku z intracelulárních zásob a tvorba pórů vedoucí k přímému přílivu iontů vápníku. Každý z těchto mechanismů způsobuje zvýšené množství vápníku v presynaptické buňce, což pak vede k uvolňování synaptických vezikul acetylcholinu. Latrotoxin způsobuje bolest, svalové kontrakce a při neléčení potenciálně paralýzu a smrt.
Hadí jed
Hadové jedy působí jako toxiny na neuromuskulárním spojení a mohou vyvolat slabost a ochrnutí. Jedy mohou působit jako presynaptické i postsynaptické neurotoxiny.[17]
Presynaptické neurotoxiny, běžně známé jako β-neurotoxiny, ovlivňují presynaptické oblasti neuromuskulárního spojení. Většina těchto neurotoxinů působí inhibicí uvolňování neurotransmiterů, jako je acetylcholin, do synapse mezi neurony. O některých z těchto toxinů je však také známo, že zvyšují uvolňování neurotransmiterů. Ty, které inhibují uvolňování neurotransmiterů, vytvářejí a neuromuskulární blokáda který brání signálním molekulám v dosažení jejich postsynaptických cílových receptorů. Přitom oběť tohoto hadího kousnutí trpí hlubokou slabostí. Takové neurotoxiny nereagují dobře na anti-jedy. Po hodině naočkování těchto toxinů, včetně notexinu a taipoxin, mnoho z postižených nervových zakončení vykazuje známky nevratného fyzického poškození, takže je postrádají synaptické vezikuly.[17]
Postsynaptické neurotoxiny, jinak známé jako a-neurotoxiny, působí opačně než presynaptické neurotoxiny vazbou na postsynaptické acetylcholinové receptory. Tím se zabrání interakci mezi acetylcholinem uvolňovaným presynaptickým terminálem a receptory postsynaptické buňky. Ve skutečnosti je otevření sodíkových kanálů spojených s těmito receptory acetylcholinu zakázáno, což vede k neuromuskulární blokádě podobné účinkům pozorovaným v důsledku presynaptických neurotoxinů. To způsobí ochrnutí svalů zapojených do postižených křižovatek. Na rozdíl od presynaptických neurotoxinů jsou postsynaptické toxiny snadněji ovlivňovány anti-jedy, které urychlují disociaci toxinu z receptorů, což v konečném důsledku způsobuje zvrácení paralýzy. Tyto neurotoxiny experimentálně a kvalitativně pomáhají při studiu acetylcholinového receptoru hustota a obrat, jakož i ve studiích sledujících směr protilátky směrem k postiženým acetylcholinovým receptorům u pacientů s diagnostikovanou myasthenia gravis.[17]
Nemoci
Žádný porucha který ohrožuje synaptický přenos mezi motorickým neuronem a svalovou buňkou, je kategorizován pod zastřešujícím termínem neuromuskulární onemocnění. Tyto poruchy mohou být zdědil nebo získané a mohou se lišit v závažnosti a úmrtnosti. Obecně platí, že většina z těchto poruch bývá způsobena mutacemi nebo autoimunitními poruchami. Autoimunitní poruchy v případě neuromuskulárních onemocnění bývají Humorný zprostředkovaný, B buňka zprostředkována a výsledkem bude protilátka nesprávně vytvořený proti motorickému neuronu nebo proteinu svalových vláken, který interferuje se synaptickým přenosem nebo signalizací.
Autoimunitní
Myasthenia gravis
Myasthenia gravis je autoimunitní porucha, při které si tělo vytváří protilátky buď proti acetylcholinovému receptoru (AchR) (v 80% případů), nebo proti postsynaptické svalové specifické kináze (MuSK) (0–10% případů). U seronegativní myasthenia gravis lipoprotein s nízkou hustotou je zaměřen na protein 4 související s receptorem IgG1, který působí jako kompetitivní inhibitor svého ligandu a brání ligandu ve vazbě na jeho receptor. Není známo, zda seronegativní myasthenia gravis bude reagovat na standardní terapie.[18]
Novorozenecký MG
Neonatální MG je autoimunitní porucha, která postihuje 1 z 8 dětí narozených matkám, u kterých byla diagnostikována myasthenia gravis (MG). MG může být přenesen z matky na plod pohybem protilátek AChR přes placenta. Známky tohoto onemocnění při narození zahrnují slabost, která reaguje na anticholinesterázové léky, stejně jako fetální akineze nebo nedostatek pohybu plodu. Tato forma onemocnění je přechodná a trvá přibližně tři měsíce. V některých případech však může neonatální MG vést k dalším zdravotním účinkům, jako je artrogrypóza nebo dokonce smrt plodu. Tyto stavy se považují za zahájené, když jsou mateřské protilátky AChR nasměrovány na fetální AChR a může trvat až do 33. týdne roku těhotenství, když je γ podjednotka AChR nahrazena ε podjednotkou.[19] [20]
Lambert-Eatonův myastenický syndrom
Lambert-Eatonův myastenický syndrom (LEMS) je autoimunitní porucha, která postihuje presynaptickou část neuromuskulárního spojení. Toto vzácné onemocnění může být poznamenáno jedinečnou trojicí příznaků: slabost proximálního svalu, autonomní dysfunkce a areflexie.[21] Proximální svalová slabost je produktem patogenní autoprotilátky namířené proti napěťově řízeným vápníkovým kanálům typu P / Q, což zase vede ke snížení uvolňování acetylcholinu z terminálů motorických nervů presynaptické buňky. Mezi příklady autonomní dysfunkce způsobené LEMS patří erektilní dysfunkce u mužů, zácpa a nejčastěji suchá ústa. Mezi méně časté dysfunkce patří suché oči a změněno pocení. Areflexie je stav, při kterém jsou šlachové reflexy sníženy a po určité době cvičení může dočasně ustoupit.[22]
50–60% pacientů, u nichž je diagnostikována LEMS, má také přidruženou složku nádor, což je obvykle malobuněčný karcinom plic (SCLC). Tento typ nádoru také exprimuje napěťově řízené vápníkové kanály.[22] LEMS se často vyskytuje také vedle myasthenia gravis.[21]
Léčba LEMS spočívá v použití 3,4-diaminopyridinu jako prvního opatření, které slouží ke zvýšení akčního potenciálu složené svaloviny a svalové síly prodloužením doby, po které zůstanou napěťově řízené vápníkové kanály otevřené po blokování napěťově řízených draslíkových kanálů. V USA je léčba 3,4-diaminopyridinem pro vhodné pacienty s LEMS dostupná bezplatně v rámci rozšířeného přístupového programu.[23][24] Další léčba zahrnuje použití prednison a azathioprin v případě, že 3,4-diaminopyridin nepomáhá při léčbě.[22]
Neuromyotonie
Neuromyotonie (NMT), jinak známý jako Isaacův syndrom, je na rozdíl od mnoha jiných onemocnění přítomných v neuromuskulárním spojení. Spíše než způsobení svalové slabosti vede NMT k hyperexcitaci motorických nervů. NMT způsobuje tuto hyperexcitaci produkcí delších depolarizací down-regulací napěťově řízené draslíkové kanály, což způsobuje větší uvolňování neurotransmiterů a opakované spouštění. Toto zvýšení rychlosti střelby vede k aktivnějšímu přenosu a v důsledku toho k větší svalové aktivitě postiženého jedince. Předpokládá se také, že NMT je autoimunitní původu kvůli jeho asociacím s autoimunitními příznaky u postiženého jedince.[19]
Genetický
Vrozené myastenické syndromy
Vrozené myastenické syndromy (CMS) jsou ve svých funkcích velmi podobné MG i LEMS, ale hlavní rozdíl mezi CMS a těmito chorobami spočívá v tom, že CMS má genetický původ. Specificky jsou tyto syndromy typicky onemocnění vznikající v důsledku mutací recesivní v 1 z alespoň 10 genů, které ovlivňují presynaptické, synaptické a postsynaptické proteiny v neuromuskulárním spojení. Takové mutace obvykle vznikají v ε-podjednotce AChR,[19] čímž ovlivňuje kinetiku a expresi samotného receptoru. Substituce nebo delece jednoho nukleotidu mohou způsobit ztrátu funkce v podjednotce. jiný mutace, jako jsou ty, které ovlivňují acetylcholinesteráza a acetyltransferáza, může také způsobit expresi CMS, přičemž druhý je spojen konkrétně s epizodickým apnoe.[25] Tyto syndromy se mohou projevovat v různých dobách života jednotlivce. Mohou vzniknout během fetální fáze a způsobit plod akineze, nebo perinatální období, během něhož se vyskytují určité podmínky, jako např arthrogryposis, ptóza, hypotonie, oftalmoplegie a mohou být pozorovány potíže s krmením nebo dýcháním. Mohly by se také aktivovat během dospívání nebo dospělých let, což by způsobilo, že se u jednotlivce vyvinul syndrom pomalého kanálu.[19]
Léčba konkrétních podtypů CMS (postsynaptický rychlý kanál CMS)[26][27] je obdobou léčby jiných neuromuskulárních poruch. 3,4-diaminopyridin, léčba první linie pro LEMS, je vyvíjena jako lék na vzácná onemocnění pro CMS[28] v USA a jsou k dispozici oprávněným pacientům v rámci rozšířeného programu přístupu bez nákladů.[23][24]
Bulbospinální svalová atrofie
Bulbospinální svalová atrofie, známá také jako Kennedyho choroba, je vzácná recesivní trinukleotid, polyglutaminová porucha spojená s X chromozom. Vzhledem ke své vazbě na chromozom X se obvykle přenáší přes ženy. Kennedyho choroba se však vyskytuje pouze u dospělých mužů a nástup onemocnění je typicky později v životě. Toto onemocnění je konkrétně způsobeno expanzí CAG-tandemové repetice v exonu 1, která se nachází na genu androgen-receptor (AR) na chromozom Xq 11-12. Poly-Q-expandovaný AR se hromadí v jádrech buněk, kde začíná fragmentovat. Po fragmentaci začíná degradace buňky, což vede ke ztrátě motorických neuronů i hřbetní kořenová ganglia.[29]
Mezi příznaky Kennedyho choroby patří slabost a plýtvání obličeje bulbární a svaly končetin, stejně jako smyslové a endokrinologické poruchy, jako je gynekomastie a snížena plodnost. Mezi další příznaky patří zvýšené testosteron a další hladiny pohlavních hormonů, vývoj hyper-CK-emie, abnormální vedení motorickými a smyslovými nervy a neuropatický nebo ve vzácných případech myopatický změny na biopsiích svalových buněk.[29]
Duchennova svalová dystrofie
Duchennova svalová dystrofie je genetická porucha vázaná na X, která vede k nepřítomnosti strukturního proteinu dystrofin na neuromuskulárním spojení. Postihuje 1 z 3 600–6 000 mužů a často způsobuje smrt ve věku 30 let. Absence dystrofinu způsobuje svalovou degenerace a pacienti mají následující příznaky: abnormální chůze, hypertrofie v lýtkových svalech a zvýšené kreatinkináza. Pokud nebudou pacienti léčeni, mohou trpět dýchací obtíže, což může vést k smrti.[30]
Viz také
externí odkazy
- Histologický obrázek: 21501lca - Histology Learning System na Bostonské univerzitě
Další čtení
- Kandel, ER; Schwartz JH; Jessell TM. (2000). Principy neurální vědy (4. vydání). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Nicholls, J.G .; A.R. Martin; B.G. Wallace; P.A. Fuchs (2001). Z Neuronu do mozku (4. vydání). Sunderland, MA .: Sinauer Associates. ISBN 0-87893-439-1.
- Engel, A.G. (2004). Myologie (3. vyd.). New York: McGraw Hill Professional. ISBN 0-07-137180-X.
Reference
- ^ Levitan, Irwin; Kaczmarek, Leonard (19. srpna 2015). "Mezibuněčná komunikace". The Neuron: Cell and Molecular Biology (4. vydání). New York, NY: Oxford Univerty Press. str. 153–328. ISBN 978-0199773893.
- ^ Rygiel, K (srpen 2016). „Stárnoucí neuromuskulární systém a sarkopenie: mitochondriální perspektiva“. J. Physiol. 594 (16): 4499–4512. doi:10.1113 / JP271212. PMC 4983621. PMID 26921061.
- ^ A b C d E F Nicholls, John G .; A. Robert Martin; Paul A. Fuchs; David A. Brown; Matthew E. Diamond; David A. Weisblat (2012). Z Neuronu do mozku (5. vydání). Sunderland: Sinauer Associates.
- ^ A b C d Sine SM (červenec 2012). „End-plate acetylcholine receptor: structure, mechanism, farmaklogy, and disease“. Physiol. Rev. 92 (3): 1189–234. doi:10.1152 / physrev.00015.2011. PMC 3489064. PMID 22811427.
- ^ William Van der Kloot; Jordi Molgo (1994). "Uvolňování kvantového acetylcholinu na neuromuskulárním spojení obratlovců". Physiol. Rev. 74 (4): 900–991. doi:10.1152 / fyzrev.1994.74.4.899. PMID 7938228.
- ^ Katz, Bernard (1966). Nerv, sval a synapse. New York: McGraw-Hill. str. 114.
- ^ McKinley, Michael; O'Loughlin, Valerie; Pennefather-O'Brien, Elizabeth; Harris, Ronald (2015). Anatomie člověka. New York: McGraw-Hill Education. str. 300. ISBN 978-0-07-352573-0.
- ^ Fox, Stuart (2016). Fyziologie člověka. New York: McGraw-Hill Education. str. 372. ISBN 978-0-07-783637-5.
- ^ Millerova anestézie, 7. vydání.
- ^ Scuka M, Mozrzymas JW (1992). "Postsynaptická potenciace a desenzibilizace na receptory koncových desek obratlovců". Prog. Neurobiol. 38 (1): 19–33. doi:10.1016 / 0301-0082 (92) 90033-B. PMID 1736323. S2CID 38497982.
- ^ Valenzuela D, Stitt T, DiStefano P, Rojas E, Mattsson K, Compton D, Nuñez L, Park J, Stark J, Gies D (1995). "Receptor tyrosin sináza specifická pro linii kosterního svalu: exprese v embryonálním svalu, na neuromuskulárním spojení a po poranění". Neuron. 15 (3): 573–84. doi:10.1016/0896-6273(95)90146-9. PMID 7546737. S2CID 17575761.
- ^ Glass D, Bowen D, Stitt T, Radziejewski C, Bruno J, Ryan T, Gies D, Shah S, Mattsson K, Burden S, DiStefano P, Valenzuela D, DeChiara T, Yancopoulos G (1996). "Agrin působí prostřednictvím komplexu receptorů MuSK". Buňka. 85 (4): 513–23. doi:10.1016 / S0092-8674 (00) 81252-0. PMID 8653787. S2CID 14930468.
- ^ Witzemann V (listopad 2006). "Vývoj neuromuskulárního spojení". Cell Tissue Res. 326 (2): 263–71. doi:10.1007 / s00441-006-0237-x. PMID 16819627. S2CID 30829665.
- ^ Okada K, Inoue A, Okada M, Murata Y, Kakuta S, Jigami T, Kubo S, Shiraishi H, Eguchi K, Motomura M, Akiyama T, Iwakura Y, Higuchi O, Yamanashi Y (2006). „Svalový protein Dok-7 je nezbytný pro neuromuskulární synaptogenezi.“ Věda. 312 (5781): 1802–5. Bibcode:2006Sci ... 312.1802O. doi:10.1126 / science.1127142. PMID 16794080. S2CID 45730054.
- ^ Steinbeck, JA; Jaiswal, MK; Calder, EL; Kishinevsky, S; Weishaupt, A; Toyka, KV; Goldstein, PA; Studer, L (7. ledna 2016). „Funkční konektivita pod optogenetickou kontrolou umožňuje modelování lidské neuromuskulární nemoci“. Buňková kmenová buňka. 18 (1): 134–43. doi:10.1016 / j.stem.2015.10.002. PMC 4707991. PMID 26549107.
- ^ Papapetropoulos S, Singer C (duben 2007). "Botulotoxin při poruchách pohybu". Semin Neurol. 27 (2): 183–94. doi:10.1055 / s-2007-971171. PMID 17390263.
- ^ A b C Lewis RL, Gutmann L (červen 2004). „Hadí jedy a neuromuskulární spojení“. Semin Neurol. 24 (2): 175–9. doi:10.1055 / s-2004-830904. PMID 15257514.
- ^ Finsterer J, Papić L, Auer-Grumbach M (říjen 2011). "Motorické neurony, nervy a neuromuskulární spojení". Curr. Opin. Neurol. 24 (5): 469–74. doi:10.1097 / WCO.0b013e32834a9448. PMID 21825986.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d Newsom-Davis J (červenec 2007). „Vznikající rozmanitost poruch nervosvalového spojení“. Acta Myol. 26 (1): 5–10. PMC 2949330. PMID 17915563.
- ^ https://www.ncbi.nlm.nih.gov/books/NBK558935/
- ^ A b Luigetti M, Modoni A, Lo Monaco M (říjen 2012). „Nízká míra opakující se nervové stimulace u Lambert-Eatonova myastenického syndromu: Zvláštní charakteristiky dekrementálního vzorce ze zkušenosti jednoho centra“. Clin Neurophysiol. 124 (4): 825–6. doi:10.1016 / j.clinph.2012.08.026. PMID 23036181. S2CID 11396376.
- ^ A b C Titulaer MJ, Lang B, Verschuuren JJ (prosinec 2011). „Lambert-Eatonův myastenický syndrom: od klinických charakteristik k terapeutickým strategiím“. Lancet Neurol. 10 (12): 1098–107. doi:10.1016 / S1474-4422 (11) 70245-9. PMID 22094130. S2CID 27421424.
- ^ A b [1] Tisková zpráva Asociace svalové dystrofie
- ^ A b [2] Archivováno 2015-07-25 na Wayback Machine Zpráva o vzácných onemocněních
- ^ Harper CM (březen 2004). "Vrozené myastenické syndromy". Semin Neurol. 24 (1): 111–23. doi:10.1055 / s-2004-829592. PMID 15229798.
- ^ Engel AG a kol. (Duben 2015). „Vrozené myastenické syndromy: patogeneze, diagnostika a léčba“. Lancet Neurol. 14 (4): 420–34. doi:10.1016 / S1474-4422 (14) 70201-7. PMC 4520251. PMID 25792100.
- ^ Engel AG a kol. (2012). „Nové obzory pro vrozené myastenické syndromy“. Ann N Y Acad Sci. 1275 (1): 1275:54–62. Bibcode:2012NYASA1275 ... 54E. doi:10.1111 / j.1749-6632.2012.06803.x. PMC 3546605. PMID 23278578.
- ^ [3] Označení léku na vzácná onemocnění FDA
- ^ A b Finsterer J (listopad 2010). „Perspektivy Kennedyho choroby“. J. Neurol. Sci. 298 (1–2): 1–10. doi:10.1016 / j.jns.2010.08.025. PMID 20846673. S2CID 40623235.
- ^ Beytía Mde L, Vry J, Kirschner J (květen 2012). „Drogová léčba svalové dystrofie Duchenne: dostupné důkazy a perspektivy“. Acta Myol. 31 (1): 4–8. PMC 3440798. PMID 22655510.
