Léčba rakoviny prostaty - Management of prostate cancer - Wikipedia
| Léčba rakoviny prostaty | |
|---|---|
| Specialita | onkologie |
Léčba rakovina prostaty může zahrnovat aktivní dohled, chirurgická operace, radiační terapie - počítaje v to brachyterapie (brachyterapie prostaty ) a radiační terapie vnějším paprskem protonová terapie, vysoce intenzivní zaměřený ultrazvuk (HIFU), kryochirurgie, hormonální terapie, chemoterapie, nebo nějaká kombinace. Léčba se rovněž vztahuje na intervence založené na pozůstalostních zásazích. Tyto intervence jsou zaměřeny na pět oblastí, včetně: fyzických symptomů, psychologických symptomů, dohledu, podpory zdraví a koordinace péče.[1] Publikovaná recenze však zjistila pouze vysokou úroveň důkazů o intervencích, které se zaměřují na zvládání fyzických a psychologických symptomů a podporu zdraví, bez revizí intervencí pro koordinaci péče nebo dohled.[2] Zvýhodněná možnost léčby závisí na stadiu onemocnění, na Gleason skóre a PSA úroveň. Mezi další důležité faktory patří věk člověka, jeho celkový zdravotní stav a jeho pocity z potenciální léčby a jejích možných vedlejších účinků. Protože každá léčba může mít význam vedlejší efekty, jako erektilní dysfunkce a únik moči „diskuse o léčbě se často zaměřují na vyvážení cílů terapie s riziky změny životního stylu.
Výběr možností léčby může zahrnovat složitá rozhodnutí s mnoha faktory. Například radikální prostatektomie po selhání primárního záření, technicky velmi náročná chirurgická operace, nemusí být možná.[3] To může vstoupit do rozhodnutí o léčbě.
Pokud se rakovina rozšířila mimo prostatu, možnosti léčby se významně mění, takže většina lékařů, kteří léčí rakovinu prostaty, používá různé nomogramy předpovědět pravděpodobnost šíření. Léčba pozorným čekáním / aktivním sledováním, HIFU, radiační terapie zevního paprsku, brachyterapie, kryochirurgie a chirurgie se obecně nabízejí mužům, jejichž rakovina zůstává v prostatě. Kliničtí lékaři si mohou vyhradit hormonální terapii a chemoterapii pro onemocnění, která se rozšířila za prostatu. Existují však výjimky: radiační terapie může léčit některé pokročilé nádory a hormonální léčba některé nádory v rané fázi. Lékaři mohou také navrhnout kryoterapie (proces zmrazení nádoru), hormonální terapie nebo chemoterapie, pokud počáteční léčba selže a rakovina postupuje.[4]
Aktivní dohled
Aktivní sledování je pozorování a pravidelné sledování bez invazivní léčby. V souvislosti s onemocněním prostaty to obvykle zahrnuje pravidelné Krevní testy PSA a biopsie prostaty. Aktivní sledování se často používá v případě, že existuje podezření na rané stádium a pomalu rostoucí rakovinu prostaty. Nicméně, ostražité čekání může být také navrženo, pokud rizika chirurgického zákroku, radiační terapie nebo hormonální terapie převáží možné přínosy. Je možné zahájit další léčbu, pokud se objeví příznaky nebo pokud existují náznaky, že růst rakoviny se zrychluje.[Citace je zapotřebí ]
Přibližně jedna třetina mužů, kteří se rozhodnou pro aktivní sledování nádorů v časném stadiu, má nakonec příznaky progrese nádoru a může být nutné zahájit léčbu do tří let.[5] Muži, kteří se rozhodnou pro aktivní dohled, se vyhýbají riziku chirurgického zákroku, ozařování a dalších způsobů léčby. Riziko progrese onemocnění a metastázování (šíření rakoviny) může být zvýšeno, ale toto zvýšení rizika se zdá být malé, pokud je program sledování pečlivě sledován, obvykle včetně sériových hodnocení PSA a opakovaných biopsií prostaty každé 1–2 roky v závislosti na trendy PSA.
Výsledky studie z roku 2011 naznačují, že aktivní dohled je nejlepší volbou pro starší „nízkorizikové“ pacienty.[6]
Chirurgická operace
Chirurgické odstranění prostaty, nebo prostatektomie, je běžnou léčbou buď u včasného stádia rakoviny prostaty, nebo u rakoviny, která nereaguje na radiační terapii. Nejběžnějším typem je radikální retropubická prostatektomie, když chirurg odstraní prostatu břišním řezem. Jiný typ je radikální perineální prostatektomie, když chirurg odstraní prostatu řezem v perineum, kůže mezi šourek a řiť. Radikální prostatektomie může být také provedena laparoskopicky, pomocí řady malých (1 cm) řezů v břiše, s nebo bez pomoci chirurgického robota.
Radikální prostatektomie
Radikální prostatektomie je účinný u nádorů, které se nešíří za prostatu;[7] míra vyléčení závisí na rizikových faktorech, jako je úroveň PSA a Gleason školní známka. Může to však způsobit nerv poškození, které může významně změnit kvalitu života přeživšího s rakovinou prostaty. Radikální prostatektomie byla spojena s větším poklesem sexuálních funkcí a zvýšením únik moči (hlavně stresová inkontinence ) než externí radioterapie, alternativní léčba.[8]
Radikální prostatektomie se tradičně používá samostatně, když je rakovina lokalizována na prostatu. V případě pozitivních okrajů nebo lokálně pokročilého onemocnění nalezeného na patologii může adjuvantní radiační terapie nabídnout lepší přežití. Chirurgie může být také nabídnuta, pokud rakovina nereaguje na radiační terapii. Protože však radiační terapie způsobuje tkáňové změny, prostatektomie po ozařování má vyšší riziko komplikací.
Laparoskopický přístup
Laparoskopická radikální prostatektomie „LRP“ je nový způsob chirurgického přístupu k prostatě se záměrem vyléčení. V kontrastu s otevřenou chirurgickou formou operace rakoviny prostaty vyžaduje laparoskopická radikální prostatektomie menší řez. Spoléhání se na moderní technologie, jako je miniaturizace, optická vlákna apod., Je laparoskopická radikální prostatektomie minimálně invazivní léčbou rakoviny prostaty, ale je technicky náročná a zřídka[Citace je zapotřebí ] v USA.
Robotická pomoc
Někteří věří, že v rukou zkušeného chirurga může roboticky asistovaná laparoskopická prostatektomie (RALP) snížit pozitivní chirurgické okraje ve srovnání s radikální retropubická prostatektomie (RRP) u pacientů s rakovinou prostaty podle retrospektivní studie.[9] The relativní snížení rizika byla 57,7%. U pacientů s podobným rizikem jako v této studii (35,5% pacientů mělo pozitivní chirurgické rozpětí po RRP) to vede k absolutní snížení rizika 20,5%. 4,9 pacientů musí být léčeno pouze pro jednoho (počet potřebný k léčbě = 4,9). Další nedávné studie prokázaly, že RALP má za následek výrazně vyšší míru pozitivních marží.[10] Jiné studie neprokázaly žádný rozdíl mezi robotickou a otevřenou operací.[11] Relativní výhody RALP a potenciální přínos oproti otevřené radikální prostatektomii je v současné době oblastí intenzivního výzkumu a debaty v urologii. Jedinou prokázanou a akceptovanou výhodou RALP je menší ztráta krve během operace. Další navrhované výhody nad rámec tohoto postrádají definitivní údaje a nebyly širší urologickou komunitou široce přijímány.
Transuretrální resekce
Transuretrální resekce prostaty, běžně nazývaný „TURP“, je chirurgický zákrok prováděný při trubici z močového měchýře do penisu (močová trubice ) je blokován zvětšením prostaty. Obecně se TURP provádí pro benigní hyperplazie prostaty a není míněna jako definitivní léčba rakoviny prostaty. Během TURP, malý nástroj (cystoskop ) je vložen do penisu a blokující prostata je odříznuta kauterie.
Kryochirurgie
Kryochirurgie je další způsob léčby rakoviny prostaty, při kterém je prostata vystavena teplotám pod bodem mrazu.[12] Kryochirurgie je méně invazivní než radikální prostatektomie a Celková anestezie je méně běžně používaný. Pod ultrazvukovým vedením je metoda vynalezená Dr. Gary Onik,[13] kovové tyče se zasunou skrz kůži perineum do prostaty. Vysoce vyčištěný plyn argon se používá k chlazení tyčinek a zmrazení okolní tkáně při -186 °C (−302 °F ). Jak voda v buňkách prostaty zmrzne, buňky odumírají. The močová trubice je chráněn před zamrznutím pomocí a katétr naplněné teplou tekutinou. Impotence se vyskytuje až v devadesáti procentech času.[14]
Chirurgické odstranění varlat
U metastatického onemocnění, kdy se rakovina rozšířila mimo prostatu, je odstranění varlata (volala orchiektomie ) lze provést ke snížení hladiny testosteronu a ke kontrole růstu rakoviny. (Viz hormonální terapie níže).
Komplikace chirurgického zákroku
Mezi nejčastější závažné komplikace operace patří ztráta kontrola moči a impotence. Hlášené míry obou komplikací se značně liší v závislosti na tom, jak jsou hodnoceny, kým a jak dlouho po operaci, a také na prostředí (např. Akademická řada vs. komunitní nebo populační data).
Erektilní dysfunkce
I když pocit penisu a schopnost dosáhnout orgasmus obvykle zůstávají neporušené, erekce a ejakulace jsou často narušeny. Léky jako sildenafil (Viagra), tadalafil (Cialis) nebo vardenafil (Levitra) může obnovit určitý stupeň potence. U většiny mužů s onemocněním omezeným na orgány může omezenější „nervy šetřící“ technika pomoci snížit močovou inkontinenci a impotenci.[15]
Únik moči
Radikální prostatektomie, transuretrální resekce prostaty (TURP) a radiační terapie jsou hlavními příčinami stresová inkontinence u mužů, přičemž hlavní příčinou je radikální prostatektomie.[16] Inkontinence ve většině případů vymizí do 12 měsíců konzervativní léčbou. Několik faktorů, jako je poranění uretrální svěrač nebo nervové svazky mohou hrát roli, většinou stresová inkontinence.[17] Stresová inkontinence moči se stane, když uretrální svěrač (svalový svěrač, který uzavírá močový měchýř) se nedokáže správně uzavřít, což vede k úniku moči v situacích, kdy je tlak v břiše vyšší než obvykle, například při smíchu, kýchání nebo kašlání.
Konzervativní léčba, jako je sval pánevního dna školení (Kegelovo cvičení ) byl předepsán ke zlepšení kontinence moči, v poslední době jsou zpochybňovány důkazy účinnosti u mužů po radikální prostatektomii. Podle informací z randomizované kontrolní studie Men After Prostate Surgery (MAPS) se ukázalo, že trénink svalů pánevního dna není pro zlepšení kontinence moči terapeutický ani nákladově efektivní.[18]
Mezi další terapie patří použití svorky penisu, transuretrální objemová činidla a katétry, ale nejčastěji používanými chirurgickými terapiemi jsou umístění uretrální popruh nebo umělý močový svěrač.[16] U pacientů se středně těžkou až těžkou stresovou inkontinencí moči po operaci prostaty umělý močový svěrač je léčba volby po selhání všech ostatních konzervativních opatření.[19]
Radiační terapie
Radiační terapie, známá také jako radioterapie, se často používá k léčbě všech stádií rakoviny prostaty. Často se také používá po operaci, pokud operace nebyla úspěšná při léčbě rakoviny. Radioterapie používá ionizující radiace zabít buňky rakoviny prostaty. Při vstřebávání do tkáně ionizující radiace jako je gama a rentgenové záření poškozují DNA v rakovinných buňkách, což zvyšuje pravděpodobnost apoptózy (buněčné smrti). Normální buňky jsou schopné napravit radiační poškození, zatímco rakovinné buňky nikoli. Radiační terapie využívá tuto skutečnost k léčbě rakoviny. Při léčbě rakoviny prostaty se používají dva různé druhy radiační terapie: radiační terapie vnějším paprskem a brachyterapie (konkrétně brachyterapie prostaty ).
Externí radiační terapie paprskem

Externí radiační terapie paprskem (EBRT) používá a lineární urychlovač produkovat vysokoenergetické rentgenové paprsky, které jsou směrovány paprskem směrem k prostatě. Technika zvaná Intenzita modulovaná radiační terapie (IMRT ) lze použít k úpravě paprsku záření tak, aby odpovídal tvaru nádoru, což umožňuje podávání vyšších dávek prostatě a semenným váčkům s menším poškozením močového měchýře a konečníku. Externí radiační terapie paprskem se obvykle provádí po několik týdnů s každodenními návštěvami centra radiační terapie. Nové typy radiační terapie, jako je IMRT, mají méně vedlejších účinků než tradiční léčba. Z krátkodobého hlediska však byla EBRT spojena s akutním zhoršením obstrukčních a střevních symptomů. Ukázalo se, že tyto příznaky v průběhu času klesají.[8] Jedenáct center ve Spojených státech nyní používají protonová terapie pro rakovinu prostaty, která k ničení rakovinných buněk používá spíše protony než rentgenové záření. Vědci také studují typy stereotaktické radioterapie těla (SBRT) k léčbě rakoviny prostaty.[20]
Brachyterapie
Trvalá implantovaná brachyterapie je oblíbenou volbou léčby pacientů s nízkým až středním rizikem, může být prováděna ambulantně a je spojena s dobrými 10letými výsledky s relativně nízkou morbiditou.[21] Zahrnuje umístění asi 100 malých „semen“ obsahujících radioaktivní materiál (např jód-125 nebo palladium-103 ) jehlou přes kůži perineum přímo do nádoru pod spinálním nebo celkovým anestetikem. Tato semena emitují rentgenové záření s nižší energií kteří jsou schopni cestovat pouze na krátkou vzdálenost. Ačkoli se semena nakonec stávají inertními, zůstávají trvale v prostatě. Riziko expozice ostatním od mužů s implantovanými semeny je obecně považováno za zanedbatelné.[22] Mužům se však doporučuje, aby si promluvili se svými lékaři o zvláštních dočasných opatřeních týkajících se malých dětí a těhotných žen.[23]
Použití
Radiační terapie se běžně používá při léčbě rakoviny prostaty. Může být použit místo chirurgického zákroku nebo po chirurgickém zákroku v časném stádiu rakoviny prostaty (adjuvantní radioterapie). Radiační léčbu lze také kombinovat s hormonální terapií pro středně riziková onemocnění, kdy je méně pravděpodobné, že by rakovinu vyléčila samotná operace nebo radiační terapie. Někteří radiační onkologové kombinují záření vnějšího paprsku a brachyterapii pro středně až vysoce rizikové situace. Radiační terapie se často používá ve spojení s hormonální terapií u vysoce rizikových pacientů.[24] Jiní používají kombinaci „trojité modality“ radiační terapie externím paprskem, brachyterapie a hormonální terapie. V pokročilých stádiích rakoviny prostaty se záření používá k léčbě bolestivých kostních metastáz nebo ke snížení komprese míchy.
Radiační terapie se také používá po radikální prostatektomii buď pro recidivu rakoviny, nebo pokud je během operace zjištěno více rizikových faktorů. Radiační terapie aplikovaná bezprostředně po chirurgickém zákroku, když jsou přítomny rizikové faktory (pozitivní chirurgický okraj, extrakapsulární extenze, postižení semenných cév), prokázala snížení recidivy rakoviny, snížení vzdálených metastáz a zvýšení celkového přežití ve dvou samostatných randomizovaných studiích.[25]
Vedlejší efekty
Nežádoucí účinky radiační terapie se mohou objevit po několika týdnech léčby. Mohou způsobit oba typy radiační terapie průjem a mírné rektální krvácení kvůli radiační proktitida, stejně jako potenciální inkontinence a impotence moči. Příznaky mají tendenci se časem zlepšovat, kromě erekcí, které se obvykle s postupem času zhoršují.
Nová metoda ke snížení poškození konečníku radiací u pacientů s rakovinou prostaty zahrnuje použití vstřebatelné látky distanční vložka umístěna mezi prostatu a konečník.

Takové distanční vložky jsou v některých oblastech komerčně dostupné a v jiných procházejí klinickými zkouškami.[26] Dočasnou změnou anatomie mají tyto produkty potenciál umožnit lepší cílení na rakovinu při minimalizaci rizika pro sousední zdravé tkáně. Mezikusy konečníku prostaty by měl být kompatibilní se všemi radioterapeutickými způsoby léčby rakoviny prostaty, včetně 3D konformního, IMRT a stereotaktického záření a brachyterapie.
Srovnání s chirurgickým zákrokem
Několik retrospektivních analýz prokázalo, že celkové výsledky přežití a přežití bez onemocnění jsou podobné mezi radikální prostatektomií, radiační terapií externím paprskem a brachyterapií.[27]Nedávná retrospektivní studie však naznačuje, že muži mladší 60 let s vysoce kvalitním karcinomem prostaty mají vyšší míru přežití při operaci než při ozařování paprskem.[28]Sazby za impotenci při srovnání záření s nervy šetřícími operacemi jsou podobné. Radiace má nižší míru inkontinence ve srovnání s chirurgickým zákrokem, ale má vyšší míru příležitostného mírného krvácení z konečníku.[29] Muži, kteří podstoupili radiační terapii zevním paprskem, mohou mít o něco vyšší riziko pozdějšího vývoje rakovina tlustého střeva a rakovina močového měchýře.[30]
Protože rakovina prostaty je obecně multifokální onemocnění, eliminuje tradiční prostatektomie všechny lokální léze odstraněním celé prostaty. Předpokládá se však, že za progresi onemocnění může být „indexová léze“. Proto by fokální terapie zaměřená na indexové léze mohla účinně léčit rakovinu prostaty při zachování zbytku žlázy. Intervenční radiologové začali léčit rakovinu prostaty minimálně invazivními terapiemi, jako je kryoablace, HIFU, radiofrekvenční ablace a fotodynamická terapie, která umožňuje fokální terapii s využitím vedení obrazu. Tyto terapie jsou stále v počátečních nebo experimentálních fázích; protože však zachovávají tkáň, mohou potenciálně snížit nepříznivé výsledky léčby, jako je impotence a inkontinence. Malá prospektivní studie publikovaná v evropské urologii v únoru 2015 hodnotila fokální léčbu indexových lézí pomocí HIFU u pacientů s multifokálním karcinomem prostaty a zjistila, že většina mužů se vrátila k výchozí genitourinární funkci a 86% mužů nemalo klinicky významný karcinom prostaty. za jeden rok.[31] Ukázaly to malé nerandomizované kohortní studie se střední dobou sledování 17–47 měsíců kryoablace, HIFU a fototerapie jsou spojeny s nízkou mírou nežádoucích účinků a časnou mírou kontroly onemocnění 83% - 100% na základě negativních biopsií.[32]
Pacienti, kteří by mohli zvláště těžit z fokální terapie HIFU, jsou muži s recidivující rakovinou po odstranění žlázy. Míra recidivy rakoviny po chirurgické resekci může být až 15-20%. MR zobrazování zlepšuje včasnou detekci rakoviny, takže k léčbě recidivujícího onemocnění lze použít terapie vedené MR. Navíc u mužů, kteří již selhali při záchranné radiační léčbě a mají zbývající omezené terapeutické možnosti, mohou intervenční terapie nabídnout více šancí na potenciální vyléčení jejich nemoci. Přestože nedávné studie prokázaly proveditelnost těchto léčebných postupů, je zapotřebí další práce, aby bylo možné dále vyhodnotit, kteří pacienti jsou pro tyto postupy nejvhodnější, a stanovit dlouhodobou účinnost.[33]
Ultrazvuk zaměřený na vysokou intenzitu
Ultrazvuk zaměřený na vysokou intenzitu (HIFU) byl poprvé použit ve 40. a 50. letech ve snaze zničit nádory v centrální nervové soustavě. Od té doby se ukázalo, že HIFU je účinný při ničení maligní tkáně v mozku, prostatě, slezině, játrech, ledvinách, prsu a kostech.[34]
HIFU pro rakovinu prostaty využívá ultrazvuk k ablaci / zničení tkáně prostaty. Během procedury HIFU se zvukové vlny používají k ohřevu tkáně prostaty, čímž ničí rakovinné buňky. Ultrazvukové vlny jsou v podstatě zaměřeny na konkrétní oblasti prostaty, aby eliminovaly rakovinu prostaty, s minimálním rizikem ovlivnění jiných tkání nebo orgánů. Teploty v ohnisku zvukových vln mohou přesáhnout 100 °C (212 °F ).[34] Mnoho studií HIFU však provedli výrobci zařízení HIFU nebo členové poradních panelů výrobců.[35]
Kontraindikace HIFU pro rakovinu prostaty zahrnují objem prostaty větší než 40 gramů, který může zabránit cíleným vlnám HIFU dosáhnout předních a anterobazálních oblastí prostaty, anatomických nebo patologických stavů, které mohou interferovat se zavedením nebo posunem sondy HIFU do konečník a kalcifikace velkého objemu v prostatě, což může vést k rozptylu HIFU a zhoršení přenosu.[36]
Studie UK 2012 s fokální HIFU na 41 pacientech nezaznamenala žádné histologické důkazy o rakovině u 77% léčených mužů (95% interval spolehlivosti: 61 - 89%) po 12měsíční cílené biopsii a nízký výskyt genitourinárních vedlejších účinků.[37] To však nutně neznamená, že 77% mužů bylo definitivně vyléčeno z rakoviny prostaty, protože v procesu biopsie jsou přítomny systematické a náhodné chyby při odběru vzorků, a proto může chybět opakovaná nebo dříve nezjištěná rakovina.[38]
Změny životního stylu
Zvětšení prostaty může způsobit potíže s úplným vyprázdněním močového měchýře. Tato situace, kdy v močovém měchýři zůstává zbytkový objem, je náchylná ke komplikacím, jako je cystitida a kameny močového měchýře, také běžně vyskytující se u pacientů s benigní hyperplazie prostaty. Často se navrhovalo změnit vypouštěcí polohu symptomatických mužů, nicméně výsledky studie ukázaly heterogenita. A metaanalýza u lidí se zvětšením prostaty a zdravých mužů došlo k významnému snížení zbytkového objemu, zatímco byl zjištěn trend směrem ke zlepšenému průtoku moči a zkrácení doby vyprazdňování.[39] Předpokládá se, že účinek změny polohy jedince nastává uvolněním pánevního svalstva, které se ve stoje stahuje, čímž ovlivňuje urodynamiku.
Časté cvičení, jako je rychlá chůze, může zpomalit postup rakoviny prostaty[40][41][pochybný ]
Hormonální terapie
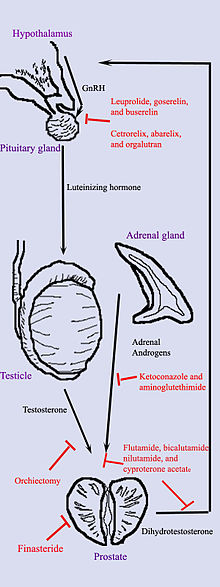
Androgenní deprivační terapie
Hormonální terapie používá léky nebo chirurgický zákrok k blokování získání buněk rakoviny prostaty dihydrotestosteron (DHT), hormon produkovaný v prostatě a potřebný pro růst a šíření většiny buněk rakoviny prostaty. Blokování DHT často způsobí, že rakovina prostaty přestane růst a dokonce se zmenší. Hormonální léčba však rakovinu prostaty léčí jen zřídka, protože rakoviny, které původně reagovaly na hormonální terapii, se obvykle stávají rezistentními po jednom až dvou letech. Hormonální léčba se proto obvykle používá, když se rakovina rozšířila z prostaty. Může být také podáván některým mužům podstupujícím radiační terapii nebo chirurgický zákrok, aby se zabránilo návratu rakoviny.[42]
Hormonální léčba rakoviny prostaty se zaměřuje na cesty, které tělo používá k produkci DHT. A zpětnovazební smyčka zahrnující varlata, hypotalamus a hypofýzu, nadledviny a prostatu řídí hladinu DHT v krvi. Za prvé, nízké hladiny DHT v krvi stimulují hypotalamus k výrobě hormon uvolňující gonadotropin (GnRH). GnRH pak stimuluje hypofýza k výrobě luteinizační hormon (LH) a LH stimuluje varlata produkovat testosteron. Nakonec testosteron z varlat a dehydroepiandrosteron z varlat nadledviny stimulovat prostatu, aby produkovala více DHT. Hormonální terapie může snížit hladinu DHT přerušením této cesty v kterémkoli bodě. Existuje několik forem hormonální terapie:
- Orchiektomie, nazývaný také „kastrace“, je chirurgický zákrok k odstranění varlat. Protože varlata tvoří většinu testosteronu v těle, po orchiektomii hladina testosteronu klesá. Prostata nyní postrádá nejen testosteronový stimul k produkci DHT, ale také nemá dostatek testosteronu k transformaci na DHT. Orchiektomie je považována za zlatý standard léčby.[43]
- Antiandrogeny jsou léky jako např flutamid, nilutamid, bikalutamid, enzalutamid, apalutamid, a cyproteronacetát které přímo blokují působení testosteronu a DHT v buňkách rakoviny prostaty.
- Mezi léky, které blokují produkci adrenálních androgenů, jako je DHEA, patří ketokonazol a aminoglutethimid. Vzhledem k tomu, že nadledviny tvoří pouze asi 5% androgenů v těle, tyto léky se obecně používají pouze v kombinaci s jinými metodami, které mohou blokovat 95% androgenů produkovaných varlaty. Tyto kombinované metody se nazývají úplná androgenní blokáda (TAB). TAB lze také dosáhnout použitím antiandrogenů.
- Akce GnRH může být přerušena jedním ze dvou způsobů. Antagonisté GnRH jako abarelix a degarelix potlačit produkci LH přímo působením na přední hypofýzu. Agonisté GnRH jako leuprorelin a goserelin potlačit LH procesem downregulace po počátečním stimulačním účinku, který může způsobit počáteční vzplanutí nádoru. Aby se zabránilo stimulaci růstu nádoru během počátečního nárůstu LH, je před týdnem před a tři týdny po podání agonistů GnRH předepsán antiandrogen, jako je cyproteron-acetát. Abarelix a degarelix jsou příklady antagonistů GnRH, zatímco agonisté GnRH zahrnují leuprolid, goserelin, triptorelin, a buserelin. Zpočátku agonisté GnRH zvýšit výroba LH. Protože však neustálý přísun léků neodpovídá přirozenému rytmu produkce těla, produkce LH i GnRH klesá po několika týdnech.[44]
- Abirateronacetát byl schválen FDA v dubnu 2011 pro léčbu rakoviny prostaty rezistentní na kastraci u pacientů, kteří selhali docetaxel terapie. Abirateron-acetát inhibuje enzym známý jako CYP17, který se v těle používá k produkci testosteronu.[45][46]
Nejúspěšnější hormonální léčbou je orchiektomie a agonisté GnRH. Navzdory vyšším nákladům jsou agonisté GnRH z kosmetických a emocionálních důvodů často voleni před orchiektomií. Nakonec se může ukázat, že úplná blokáda androgenů je lepší než orchiektomie nebo agonisté GnRH užívaní samostatně.
Každá léčba má nevýhody, které za určitých okolností omezují její použití. Ačkoli orchiektomie je chirurgický zákrok s nízkým rizikem, psychologický dopad odstranění varlat může být významný a sterilita je jistá. Může dojít ke ztrátě testosteronu návaly horka, přibývání na váze, ztráta libido, rozšíření prsa (gynekomastie ), impotence, atrofie penisu a osteoporóza. Agonisté GnRH nakonec způsobí stejné nežádoucí účinky jako orchiektomie, ale na začátku léčby mohou způsobit horší příznaky. Při prvním použití agonistů GnRH může nárůst testosteronu vést ke zvýšené bolesti kostí způsobené metastatickým karcinomem, proto se často přidávají antiandrogeny nebo abarelix, aby se zmírnily tyto nežádoucí účinky. Estrogeny se běžně nepoužívají, protože zvyšují riziko kardiovaskulární onemocnění a krevní sraženiny. Antiandrogeny obecně nezpůsobují impotenci a obvykle způsobují menší úbytek kostní a svalové hmoty. Ketokonazol může způsobit poškození jater při dlouhodobém používání může aminoglutethimid způsobit pokožku vyrážky.
Estrogenová terapie
Vysoká dávka estrogenu terapie se používá při léčbě rakoviny prostaty.[47] Estrogeny které byly použity, zahrnují diethylstilbestrol, fosfestrol, ethinylestradiol, ethinylestradiol sulfonát, polyestradiol fosfát, a estradiol undecylát, stejně jako duální estrogenní a cytostatické činidlo estramustin fosfát.[47][48] Novější estrogeny se zlepšenou snášenlivostí a bezpečností GTx-758 byly také studovány.[49][50] Estrogeny jsou účinné při rakovině prostaty, protože jsou funkčními antiandrogeny.[48][51] Oba potlačují hladinu testosteronu do rozsahu kastrátů prostřednictvím antigonadotropní účinky[48][51] a snižují podíl volného a biologicky dostupného testosteronu zvýšením globulin vázající pohlavní hormony úrovně.[49][51] Estrogeny mohou mít také přímé cytotoxický účinky v prostaty.[48]
Bylo zjištěno, že estrogeny mají stejnou účinnost jako androgenní deprivační terapie chirurgickou nebo lékařskou kastrací a nesteroidní antiandrogeny.[51] Kromě toho zabraňují návaly horka zachovat hustota kostí, zachovat některé sexuální zájem, mít kvalita života výhody a jsou mnohem méně nákladné než konvenční léčba androgenní deprivací.[52][53][54][55][56][57][58] Estrogeny však způsobují feminizace a gynekomastie tak jako vedlejší efekty.[53][54][55][57][58] Navíc v dávce 3 až 5 mg / den se může diethylstilbestrol zvýšit kardiovaskulární úmrtnost - zejména u pacientů, kteří již mají narušený kardiovaskulární systém. Diethylstilbestrol v dávce 1 až 2 mg / den se jeví jako bezpečný a účinný pro pacienty s CRPC, kteří mají zdravý kardiovaskulární systém a kteří současně užívají nízké dávky aspirinu.[51] Ačkoli nejčastěji používané estrogeny, ústní a syntetický estrogeny, jako je diethylstilbestrol a ethinylestradiol, zvyšují kardiovaskulární úmrtnost, některé estrogeny, jmenovitě bioidentický parenterální estrogeny, jako je polyestradiolfosfát a vysoké dávky transdermální estradiol, nedělejte to; to je přičítáno různým stupňům účinku tříd estrogenu na syntéza jaterních proteinů a rozšířením koagulační faktory.[51]
| Trasa / formulář | Estrogen | Dávkování | |
|---|---|---|---|
| Ústní | Estradiol | 1–2 mg 3x denně | |
| Konjugované estrogeny | 1,25–2,5 mg 3x denně | ||
| Ethinylestradiol | 0,15–3 mg / den | ||
| Ethinylestradiol sulfonát | 1–2 mg 1x týdně | ||
| Diethylstilbestrol | 1–3 mg / den | ||
| Dienestrol | 5 mg / den | ||
| Hexestrol | 5 mg / den | ||
| Fosfestrol | 100–480 mg 1–3x / den | ||
| Chlorotrianisen | 12–48 mg / den | ||
| Quadrosilan | 900 mg / den | ||
| Estramustin fosfát | 140–1400 mg / den | ||
| Transdermální náplast | Estradiol | 2–6x 100 μg / den Šourek: 1x 100 μg / den | |
| IM nebo SC injekce | Estradiol benzoát | 1,66 mg 3x týdně | |
| Estradiol dipropionát | 5 mg 1x týdně | ||
| Estradiol valerát | 10–40 mg 1x / 1–2 týdny | ||
| Estradiol undecylát | 100 mg 1x / 4 týdny | ||
| Polyestradiol fosfát | Sama: 160–320 mg 1x / 4 týdny S orálním EE: 40–80 mg 1x / 4 týdny | ||
| Estrone | 2–4 mg 2–3x / týden | ||
| IV injekce | Fosfestrol | 300–1200 mg 1–7x / týden | |
| Estramustin fosfát | 240–450 mg / den | ||
| Poznámka: Dávky nemusí být nutně ekvivalentní. Zdroje: Viz šablona. | |||
Opakovaná nemoc
Po chirurgická operace nebo radiační terapií může PSA začít znovu stoupat, což se nazývá biochemická recidiva, pokud je dosaženo určité prahové hodnoty v hladinách PSA (obvykle 0,1 nebo 0,2 ng / ml pro chirurgický zákrok). Po 10 letech sledování po operaci existuje celkové riziko biochemické recidivy 30–50%, v závislosti na počátečním rizikovém stavu, a záchranná radiační terapie (SRT) je jedinou kurativní léčbou.[59] SRT se často podává v kombinaci s androgenní deprivační terapií po dobu až dvou let. Retrospektivní studie pacientů léčených SRT v letech 1987 až 2013 zjistila, že 56% z 2460 pacientů bylo po 5 letech sledování bez biochemického selhání.[60] U pacientů s PSA méně než 0,2 před SRT to bylo 71%.
Rozsáhlá nemoc
Paliativní péče pro pokročilé stádium rakoviny prostaty se zaměřuje na prodloužení života a zmírnění příznaků metastatického onemocnění. Jak je uvedeno výše „abirateron vykazuje určité sliby při léčbě rakoviny prostaty v pokročilém stadiu. Způsobuje dramatické snížení PSA úrovně a nádor velikosti u agresivního pokročilého stadia karcinomu prostaty u 70% pacientů.[45][46] Chemoterapie může být nabídnuto zpomalení progrese onemocnění a oddálení příznaků. Nejběžněji používaný režim kombinuje chemoterapeutické léčivo docetaxel s kortikosteroidy jako prednison. Jedna studie ukázala, že léčba docetaxelem s prednisonem prodloužila životnost z 16,5 měsíce u pacientů užívajících mitoxantron a prednison na 18,9 měsíce u pacientů užívajících docetaxel + prednison.[61] Bisfosfonáty jako kyselina zoledronová bylo prokázáno, že oddalují kostní komplikace, jako je zlomeniny nebo potřeba radiační terapie u pacientů s hormonálně refrakterním metastatickým karcinomem prostaty.[62] Xofigo je nové farmaceutické cílení na emise alfa kostní metastázy. Testování fáze II ukázalo prodloužení doby přežití pacientů, snížení bolesti a zlepšení kvality života.
Bolest kostí v důsledku metastatického onemocnění je léčen opioid léky proti bolesti jako morfium a oxykodon. Může poskytnout externí radiační terapii zaměřenou na kostní metastázy bolest úleva. Injekce určitých radioizotopy, jako stroncium-89, fosfor-32 nebo samarium-153, také se zaměřují na kostní metastázy a mohou pomoci zmírnit bolest.
Alternativní terapie
Jako alternativa k aktivnímu dohledu nebo definitivní léčbě jsou pro léčbu rakoviny prostaty také zkoumány další terapie. Bylo prokázáno, že PSA je snížena u mužů se zjevnou lokalizovanou rakovinou prostaty pomocí veganské stravy (ryby povoleny), pravidelného cvičení a redukce stresu.[63] Tyto výsledky se doposud ukázaly jako trvanlivé po dvouleté léčbě. Tato studie však neporovnávala veganskou stravu ani s aktivním sledováním, ani s definitivní léčbou, a proto nemůže komentovat srovnávací účinnost veganské stravy při léčbě rakoviny prostaty.[64]
Bylo prokázáno, že mnoho dalších jednotlivých látek snižuje PSA, zpomaluje zdvojnásobení doby PSA nebo má podobné účinky na sekundární markery u mužů s lokalizovanou rakovinou v krátkodobých studiích, jako je šťáva z granátového jablka nebo genistein, isoflavon nacházející se v různých luštěninách.[65][66]
Potenciál společného používání více takových agentů, natož jejich kombinace se změnami životního stylu, dosud nebyl studován. Byl publikován důkladnější přehled přirozených přístupů k rakovině prostaty.[67]
Ukázalo se, že neutrony jsou v léčbě rakoviny prostaty lepší než rentgenové záření. Důvodem je to, že nádory obsahující hypoxické buňky (buňky s dostatečnou koncentrací kyslíku, aby byly životaschopné, ale nedostatečné na to, aby byly rentgenově citlivé na záření) a buňky s nedostatkem kyslíku jsou rezistentní vůči zabíjení rentgenovými paprsky. Tedy nižší Poměr vylepšení kyslíku (OER) neutronů poskytuje výhodu. Neutrony mají také vyšší relativní biologická účinnost (RBE) pro pomalu rostoucí nádory než rentgenové záření, což umožňuje výhodu při zabíjení nádorových buněk.[68]
Prevence
Ani selen ani vitamin E. bylo prokázáno, že jsou účinné při prevenci rakovina prostaty.[69]
Kompromisy
The kompromis dilema označuje volbu mezi očekávanými prospěšnými a škodlivými účinky z hlediska přežití a kvality života pro konkrétní léčbu. Příklad takového kompromisu v léčbě rakoviny prostaty zahrnuje příznaky močení a střev a úbytek sexuální funkce.[70] Jak časté jsou tyto příznaky a úzkost, kterou způsobují, se liší mezi typy léčby a jednotlivci.[71]
Jednou z možností je vyměnit neporušený sexuální funkce pro možnost prodloužení průměrné délky života bez léčby. Volba zahrnuje kompromis, takže je pro osobu a lékaře zásadní mít přístup k informacím o zavedených léčebných přínosech a vedlejších účincích. Švédská studie zjistila, že ochota provést tento druh kompromisu se u mužů značně lišila.[70] Zatímco šest z deseti bylo ochotno uvažovat o kompromisu mezi střední délkou života a neporušenou sexuální funkcí, vzhledem k současným znalostem přínosů léčby u klinicky lokalizovaného karcinomu prostaty, čtyři z deseti uvedli, že by si za všech okolností zvolili léčbu bez ohledu na riziko úbytku sexuálních funkcí. Pro takové rozhodování je zásadní přístup k platným empirickým informacím. Klíčovými faktory jsou pocit jedince vůči nemoci, jeho emoční hodnoty a náboženské přesvědčení. Podstatná část lidí a lékařů, kteří mají stres při posuzování kompromisu mezi různými možnostmi léčby a vedlejšími účinky léčby, což zvyšuje stres diagnostikované rakoviny, se zhoršila tím, že osm z deseti lidí s rakovinou prostaty nemá žádné jeden se svěřil kromě jejich manžela a jeden z pěti žije celkem emoční izolace.[72] Americká urologická asociace (AUA), Americká společnost pro radiační onkologii (ASTRO) a Společnost pro urologickou onkologii (SUO) vydaly společné pokyny pro společné rozhodování s pacienty, kteří lokalizovali rakovinu prostaty, aby pomohli pacientům orientovat se v těchto rozhodnutích.[73]
Viz také
Reference
- ^ Resnick, Matthew J .; Lacchetti, Christina; Bergman, Jonathan; Hauke, Ralph J .; Hoffman, Karen E .; Kungel, Terrence M .; Morgans, Alicia K .; Penson, David F. (2015). „Směrnice o péči o přežití s rakovinou prostaty: Doporučení směrnice Americké společnosti pro klinickou onkologii o klinické praxi“. Journal of Clinical Oncology. 33 (9): 1078–1085. doi:10.1200 / JCO.2014.60.2557. PMID 25667275.
- ^ Crawford-Williams, Fiona; March, Sonja; Goodwin, Belinda C.; Ralph, Nicholas; Galvão, Daniel A.; Newton, Robert U.; Chambers, Suzanne K.; Dunn, Jeff (2018). "Interventions for prostate cancer survivorship: A systematic review of reviews" (PDF). Psycho-onkologie. 27 (10): 2339–2348. doi:10.1002/pon.4888. PMID 30255558.
- ^ Mouraviev V, Evans B, Polascik TJ (2006). "Salvage prostate cryoablation after primary interstitial brachytherapy failure: a feasible approach". Rakovina prostaty a prostatické nemoci. 9 (1): 99–101. doi:10.1038/sj.pcan.4500853. PMID 16314889.
- ^ "Prostate Cancer At A Glance". shavemagazine.com.
- ^ Wu, H; Sun L; Moul JW; Wu HY; McLeod DG; Amling C; Lance R; Kusuda L; Donahue T; Foley J; Chung A; Sexton W; Soderdahl D (March 2004). "Watchful waiting and factors predictive of secondary treatment of localized prostate cancer". Journal of Urology. 171 (3): 1111–6. doi:10.1097/01.ju.0000113300.74132.8b. PMID 14767282.
- ^ http://www.cancer.gov/ncicancerbulletin/041911/page2 Active Surveillance May Be Preferred Option in Some Men with Prostate Cancer Archivováno 3. května 2011 v Wayback Machine
- ^ Bill-Axelson A, Holmberg L, Ruutu M, Häggman M, Andersson SO, Bratell S, Spångberg A, Busch C, Nordling S, Garmo H, Palmgren J, Adami HO, Norlén BJ, Johansson JE (May 2005). "Radical prostatectomy versus watchful waiting in early prostate cancer". New England Journal of Medicine. 352 (19): 1977–84. doi:10.1056/NEJMoa043739. PMID 15888698.
- ^ A b Chen C, Chen Z, Wang K, Hu L, Xu R, He X (November 2017). "Comparisons of health-related quality of life among surgery and radiotherapy for localized prostate cancer: a systematic review and meta-analysis". Cílový cíl. 8 (58): 99057–99065. doi:10.18632/oncotarget.21519. PMC 5716791. PMID 29228751.
- ^ Smith JA, Chan RC, Chang SS, et al. (Prosinec 2007). "A comparison of the incidence and location of positive surgical margins in robotic assisted laparoscopic radical prostatectomy and open retropubic radical prostatectomy". Journal of Urology. 178 (6): 2385–9, discussion 2389–90. doi:10.1016/j.juro.2007.08.008. PMID 17936849.
- ^ Ou, YC; Yang CR; Wang J; Cheng CL; Patel VR (May 2009). "Comparison of Robotic-assisted versus Retropubic Radical Prostatectomy Performed by a Single Surgeon". Protinádorový výzkum. 29 (5): 1637–42. PMID 19443379.
- ^ Ham, WS; Park SY; Rha KH; Kim WT; Choi YD (June 2009). "Robotic radical prostatectomy for patients with locally advanced prostate cancer is feasible: results of a single-institution study". Journal of laparoendoscopic & Advanced Surgical Techniques. 19 (3): 329–32. doi:10.1089/lap.2008.0344. PMID 19397390.
- ^ PreventProstateCancer.info: A Brief Overview of Prostate Cancer Archivováno 2008-09-24 na Wayback Machine
- ^ "Cryosurgical system for destroying tumors by freezing". 1994-08-02. Archivovány od originál dne 2009-03-29.
- ^ Bahn, DK; Lee F; Badalament R; Kumar A; Greski J; Chernick M (August 2002). "Targeted cryoablation of the prostate: 7-year outcomes in the primary treatment of prostate cancer". Urologie. 60 (2 Suppl 1): 3–11. doi:10.1016/S0090-4295(02)01678-3. PMID 12206842.
- ^ Gerber GS, Thisted RA, Scardino PT, Frohmuller HG, Schroeder FH, Paulson DF, Middleton AW Jr, Rukstalis DB, Smith JA Jr, Schellhammer PF, Ohori M, Chodak GW (August 28, 1996). "Results of radical prostatectomy in men with clinically localized prostate cancer". JAMA: The Journal of the American Medical Association. 276 (8): 615–9. doi:10.1001/jama.276.8.615. PMID 8773633.
- ^ A b Trost, Landon; Elliott, Daniel S. (2012). "Male Stress Urinary Incontinence: A Review of Surgical Treatment Options and Outcomes". Pokroky v urologii. 2012: 287489. doi:10.1155/2012/287489. PMC 3356867. PMID 22649446.
- ^ Hoyland, Kimberley; Vasdev, Nikhil; Abrof, Ahmed; Boustead, Gregory (2014). "Post-Radical Prostatectomy Incontinence: Etiology and Prevention". Recenze v urologii. 16 (4): 181–188. ISSN 1523-6161. PMC 4274175. PMID 25548545.
- ^ Glazener C, Boachie C, Buckley B, et al. (Červenec 2011). "Urinary incontinence in men after formal one-to-one pelvic-floor muscle training following radical prostatectomy or transurethral resection of the prostate (MAPS): two parallel randomised controlled trials". Lancet. 378 (9788): 328–37. doi:10.1016/S0140-6736(11)60751-4. hdl:2164/2366. PMID 21741700.
- ^ Thüroff, Joachim W.; Abrams, Paul; Andersson, Karl-Erik; Artibani, Walter; Chapple, Christopher R.; Drake, Marcus J.; Hampel, Christian; Neisius, Andreas; Schröder, Annette; Tubaro, Andrea (2011-03-01). "EAU Guidelines on Urinary Incontinence". Evropská urologie. 59 (3): 387–400. doi:10.1016/j.eururo.2010.11.021. ISSN 0302-2838. PMID 21130559.
- ^ „Archivovaná kopie“. Archivovány od originál dne 15. 7. 2009. Citováno 2009-08-06.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Nag S, Beyer D, Friedland J, Grimm P, Nath R (July 1999). "American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer". International Journal of Radiation Oncology, Biology, Physics. 44 (4): 789–99. doi:10.1016/S0360-3016(99)00069-3. PMID 10386635.
- ^ Perez, CA; Hanks GE; Leibel SA; Zietman AL; Fuks Z; Lee WR (December 1, 1993). "Localized carcinoma of the prostate (stages T1B, T1C, T2, and T3). Review of management with external beam radiation therapy". Rakovina. 72 (11): 3156–73. doi:10.1002/1097-0142(19931201)72:11<3156::AID-CNCR2820721106>3.0.CO;2-G. PMID 7694785. Posouzení.
- ^ „Archivovaná kopie“. Archivovány od originál dne 04.03.2010. Citováno 2010-03-17.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ D'Amico AV, Manola J, Loffredo M, Renshaw AA, DellaCroce A, Kantoff PW (2004). "6-month androgen suppression plus radiation therapy vs radiation therapy alone for patients with clinically localized prostate cancer: a randomized controlled trial". JAMA. 292 (7): 821–7. doi:10.1001/jama.292.7.821. PMID 15315996.
- ^ Thompson IM, Tangen CM, Paradelo J (2009). "Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial". Journal of Urology. 181 (3): 956–62. doi:10.1016/j.juro.2008.11.032. PMC 3510761. PMID 19167731.
- ^ "Products — Augmenix". Augmenix.com. Citováno 2012-02-16.
- ^ Kupelian PA, Elshaikh M, Reddy CA, Zippe C, Klein EA (August 2002). "Comparison of the efficacy of local therapies for localized prostate cancer in the prostate-specific antigen era: a large single-institution experience with radical prostatectomy and external-beam radiotherapy". Journal of Clinical Oncology. 20 (16): 3376–85. doi:10.1200/JCO.2002.01.150. PMID 12177097.
- ^ Huang H, Muscatelli S, Naslund M, Badiyan SN, Kaiser A, Siddiqui MM (Jan 2019). "Evaluation of Cancer Specific Mortality with Surgery versus Radiation as Primary Therapy for Localized High Grade Prostate Cancer in Men Younger Than 60 Years". Journal of Urology. 201 (1): 120–128. doi:10.1016/j.juro.2018.07.049. PMID 30059685.
- ^ Lawton, CA; Won M; Pilepich MV; Asbell SO; Shipley WU; Hanks GE; Cox JD; Perez CA; Sause WT; Doggett SR; et al. (Září 1991). "Long-term treatment sequelae following external beam irradiation for adenocarcinoma of the prostate: analysis of RTOG studies 7506 and 7706". International Journal of Radiation Oncology, Biology, Physics. 21 (4): 935–9. doi:10.1016/0360-3016(91)90732-J. PMID 1917622.
- ^ Brenner, DJ; Curtis RE; Hall EJ; Ron E (January 15, 2000). "Second malignancies in prostate carcinoma patients after radiotherapy compared with surgery". Rakovina. 88 (2): 398–406. CiteSeerX 10.1.1.385.7956. doi:10.1002/(SICI)1097-0142(20000115)88:2<398::AID-CNCR22>3.0.CO;2-V. PMID 10640974.
- ^ Ahmed, Hashim U.; Dickinson, Louise; Charman, Susan; Weir, Shraddha; McCartan, Neil; Hindley, Richard G.; Freeman, Alex; Kirkham, Alex P.; Sahu, Mahua; Scott, Rebecca; Allen, Clare; Van Der Meulen, Jan; Emberton, Mark (2015). "Focal Ablation Targeted to the Index Lesion in Multifocal Localised Prostate Cancer: A Prospective Development Study". Evropská urologie. 68 (6): 927–936. doi:10.1016/j.eururo.2015.01.030. PMID 25682339.
- ^ Karavitakis, Markos; Ahmed, Hashim U.; Abel, Paul D.; Hazell, Steven; Winkler, Mathias H. (2011). "Tumor focality in prostate cancer: Implications for focal therapy". Nature Reviews Clinical Oncology. 8 (1): 48–55. doi:10.1038/nrclinonc.2010.190. PMID 21116296.
- ^ Society of Interventional Radiology. "The Hot - And Cold - Interventional Radiology Treatments For Recurrent Prostate Cancer". www.biocompare.com. Biocompare: The buyers guide for life scientists. Citováno 18. dubna 2018.
- ^ A b Gardner TA, Koch MO (December 2005). "Prostate cancer therapy with high-intensity focused ultrasound". Klinická urogenitální rakovina. 4 (3): 187–92. doi:10.3816/CGC.2005.n.031. PMID 16425987.
- ^ Pickles, Tom; Goldenberg, Larry; Steinhoff, Gary (2005). "High-Intensity Focused Ultrasound for Prostate Cancer" (PDF). Agentura pro rakovinu v Britské Kolumbii. Archivovány od originál (PDF) dne 26. 8. 2014. Citováno 2012-11-10.
- ^ Barqawi AB, Crawford ED (2008). "Emerging Role of HIFU as a Noninvasive Ablative Method to Treat Localized Prostate Cancer". Onkologie. 22 (2): 123–9, discussion 129, 133, 137 passim. PMID 18409659.
- ^ Ahmed, Hashim U; Hindley, Richard G; Dickinson, Louise; Freeman, Alex; Kirkham, Alex P; Sahu, Mahua; Scott, Rebecca; Allen, Clare; Van der Meulen, Jan; Emberton, Mark (1 June 2012). "Focal therapy for localised unifocal and multifocal prostate cancer: a prospective development study". Onkologie lancety. 13 (6): 622–632. doi:10.1016/S1470-2045(12)70121-3. PMC 3366323. PMID 22512844.
- ^ Ahmed, Hashim Uddin; Moore, Caroline; Lecornet, Emilie; Emberton, Mark (1 May 2010). "Focal Therapy in Prostate Cancer: Determinants of Success and Failure". Journal of Endourology. 24 (5): 819–825. doi:10.1089/end.2009.0665. PMID 20380513.
- ^ de Jong Y, Pinckaers JH, ten Brinck RM, Lycklama à Nijeholt AA, Dekkers OM (2014). "Urinating standing versus sitting: position is of influence in men with prostate enlargement. A systematic review and meta-analysis". PLOS One. 9 (7): e101320. Bibcode:2014PLoSO ... 9j1320D. doi:10.1371 / journal.pone.0101320. PMC 4106761. PMID 25051345.
- ^ Kenfield SA, Stampfer MJ, Giovannucci E, Chan JM (February 2011). "Physical activity and survival after prostate cancer diagnosis in the health professionals follow-up study". Journal of Clinical Oncology. 29 (6): 726–32. doi:10.1200/JCO.2010.31.5226. PMC 3056656. PMID 21205749.
- ^ Richman EL, Kenfield SA, Stampfer MJ, Paciorek A, Carroll PR, Chan JM (June 2011). "Physical activity after diagnosis and risk of prostate cancer progression: data from the cancer of the prostate strategic urologic research endeavor". Výzkum rakoviny. 71 (11): 3889–95. doi:10.1158/0008-5472.CAN-10-3932. PMC 3107352. PMID 21610110.
- ^ Robson, M; Dawson N (June 1996). "How is androgen-dependent metastatic prostate cancer best treated?". Hematologické / onkologické kliniky Severní Ameriky. 10 (3): 727–47. doi:10.1016/S0889-8588(05)70364-6. PMID 8773508. Posouzení.
- ^ "Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. The Medical Research Council Prostate Cancer Working Party Investigators Group". British Journal of Urology. 79 (2): 235–46. Února 1997. doi:10.1046/j.1464-410x.1997.d01-6840.x. PMID 9052476.
- ^ Loblaw DA, Mendelson DS, Talcott JA, Virgo KS, Somerfield MR, Ben-Josef E, Middleton R, Porterfield H, Sharp SA, Smith TJ, Taplin ME, Vogelzang NJ, Wade JL Jr, Bennett CL, Scher HI, American Society of Clinical Oncology (July 15, 2004). "American Society of Clinical Oncology recommendations for the initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer". Journal of Clinical Oncology. 22 (14): 2927–41. doi:10.1200/JCO.2004.04.579. PMID 15184404. (Tisková chyba:doi:10.1200/JCO.2004.08.943 )
- ^ A b de Bono, Johann; Gerhardt Attard; Alison H.M. Reid; Timothy A. Yap; Florence Raynaud; Mitch Dowsett; Sarah Settatree; Mary Barrett; Christopher Parker; Vanessa Martins; Elizabeth Folkerd; Jeremy Clark; Colin S. Cooper; Stan B. Kaye; David Dearnaley; Gloria Lee (July 21, 2004). "Phase I Clinical Trial of a Selective Inhibitor of CYP17, Abiraterone Acetate, Confirms That Castration-Resistant Prostate Cancer Commonly Remains Hormone Driven". Journal of Clinical Oncology. 26 (14): 4563–4571. doi:10.1200/JCO.2007.15.9749. PMID 18645193. (Tisková chyba:doi:10.1200/JCO.2012.43.7756 )
- ^ A b Richard Warry (July 22, 2008). "Drug for deadly prostate cancer". BBC. Citováno 2008-07-23.
- ^ A b Christoffel Jos van Boxtel; Budiono Santoso; I. Ralph Edwards (2008). Přínosy a rizika drog: Mezinárodní učebnice klinické farmakologie. IOS Press. str. 458–. ISBN 978-1-58603-880-9.
- ^ A b C d Michael Oettel; Ekkehard Schillinger (6. prosince 2012). Estrogeny a antiestrogeny II: Farmakologie a klinické použití estrogenů a antiestrogenů. Springer Science & Business Media. str. 540–542. doi:10.1007/978-3-642-60107-1. ISBN 978-3-642-60107-1.
- ^ A b Coss CC, Jones A, Parke DN, Narayanan R, Barrett CM, Kearbey JD, Veverka KA, Miller DD, Morton RA, Steiner MS, Dalton JT (March 2012). „Preklinická charakterizace nového agonisty ERα selektivního k difenylbenzamidu pro hormonální terapii u rakoviny prostaty“. Endokrinologie. 153 (3): 1070–81. doi:10.1210 / cs.2011-1608. PMID 22294742.
- ^ Yu EY, Getzenberg RH, Coss CC, Gittelman MM, Keane T, Tutrone R, et al. (Únor 2015). "Selective estrogen receptor alpha agonist GTx-758 decreases testosterone with reduced side effects of androgen deprivation therapy in men with advanced prostate cancer". Evropská urologie. 67 (2): 334–41. doi:10.1016/j.eururo.2014.06.011. PMID 24968970.
- ^ A b C d E F Waun Ki Hong; James F. Holland (2010). Holland-Frei Cancer Medicine 8. PMPH-USA. str. 753–. ISBN 978-1-60795-014-1.
- ^ Ali Shah SI (2015). „Vznikající potenciál parenterálního estrogenu jako androgenní deprivační terapie pro rakovinu prostaty“. Jihoasijský deník rakoviny. 4 (2): 95–7. doi:10,4103 / 2278-330X.155699. PMC 4418092. PMID 25992351.
- ^ A b Russell N, Cheung A, Grossmann M (srpen 2017). „Estradiol pro zmírnění nežádoucích účinků androgenní deprivační terapie“. Rakovina související s endokrinním systémem. 24 (8): R297 – R313. doi:10.1530 / ERC-17-0153. PMID 28667081.
- ^ A b Wibowo E, Wassersug RJ (září 2013). "Vliv estrogenu na sexuální zájem kastrovaných mužů: Důsledky pro pacienty s rakovinou prostaty na androgenní deprivační terapii". Kritické recenze v onkologii / hematologii. 87 (3): 224–38. doi:10.1016 / j.critrevonc.2013.01.006. PMID 23484454.
- ^ A b Wibowo E, Schellhammer P, Wassersug RJ (leden 2011). „Role estrogenu v normální mužské funkci: klinické důsledky pro pacienty s rakovinou prostaty na androgenní deprivační terapii“. Journal of Urology. 185 (1): 17–23. doi:10.1016 / j.juro.2010.08.094. PMID 21074215.
- ^ Norman G, Dean ME, Langley RE, Hodges ZC, Ritchie G, Parmar MK, Sydes MR, Abel P, Eastwood AJ (únor 2008). „Parenterální estrogen v léčbě rakoviny prostaty: systematický přehled“. British Journal of Cancer. 98 (4): 697–707. doi:10.1038 / sj.bjc.6604230. PMC 2259178. PMID 18268497.
- ^ A b Lycette JL, Bland LB, Garzotto M, Beer TM (prosinec 2006). „Parenterální estrogeny pro rakovinu prostaty: může nová cesta podání překonat starou toxicitu?“. Klinická urogenitální rakovina. 5 (3): 198–205. doi:10.3816 / CGC.2006.n.037. PMID 17239273.
- ^ A b Ockrim J, Lalani EN, Abel P (říjen 2006). „Therapy Insight: parenterální léčba estrogeny pro rakovinu prostaty - nový úsvit staré terapie“. Přírodní klinická praxe. Onkologie. 3 (10): 552–63. doi:10.1038 / ncponc0602. PMID 17019433.
- ^ Rans, K.; C. Berghen; S. Joniau; G. De Meerleer (2020). "Salvage radiotherapy for prostate cancer". Klinická onkologie. 32 (3): 156–162. doi:10.1016/j.clon.2020.01.003. PMID 32035581.
- ^ Tendulkar, Rahul D .; Shree Agrawal; Tianming Gao; Jason A. Efstathiou; Thomas M. Pisansky; Jeff M. Michalski; Bridget F. Koontz; et al. (2016). "Contemporary update of a multi-institutional predictive nomogram for salvage radiotherapy after radical prostatectomy". Journal of Clinical Oncology. 34 (30): 3648–3654. doi:10.1200/JCO.2016.67.9647. PMID 27528718.
- ^ Tannock IF, de Wit R, Berry WR, Horti J, Pluzanska A, Chi KN, Oudard S, Theodore C, James ND, Turesson I, Rosenthal MA, Eisenberger MA, TAX 327 Investigators (October 7, 2004). "Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer". New England Journal of Medicine. 351 (15): 1502–12. doi:10.1056/NEJMoa040720. PMID 15470213.
- ^ Saad F, Gleason DM, Murray R, Tchekmedyian S, Venner P, Lacombe L, Chin JL, Vinholes JJ, Goas JA, Chen B (2002). "A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma". Journal of the National Cancer Institute. 94 (19): 1458–68. doi:10.1093/jnci/94.19.1458. PMID 12359855.
- ^ Ornish, D; Weidner G; Fair WR; et al. (2005). "Intensive lifestyle changes may affect the progression of prostate cancer". Journal of Urology. 174 (3): 1065–70. doi:10.1097/01.ju.0000169487.49018.73. PMID 16094059.
- ^ Frattaroli J, Weidner G, Dnistrian AM, et al. (Prosinec 2008). "Clinical events in prostate cancer lifestyle trial: results from two years of follow-up". Urologie. 72 (6): 1319–23. doi:10.1016/j.urology.2008.04.050. PMID 18602144.
- ^ Pantuck, AJ; Leppert JT; Zomorodian N; et al. (2006). "Phase II study of pomegranate juice for men with rising prostate-specific antigen following surgery or radiation for prostate cancer". Klinický výzkum rakoviny. 12 (13): 4018–26. doi:10.1158/1078-0432.CCR-05-2290. PMID 16818701.
- ^ Kumar, NB; Cantor A; Allen K; et al. (2004). "The specific role of isoflavones in reducing prostate cancer risk". Prostata. 59 (2): 141–7. doi:10.1002/pros.10362. PMID 15042614.
- ^ Yarnell, Eric (1999). "A Naturopathic Approach to Prostate Cancer Part 2: Guidelines for Treatment and Prevention". Alternativní a doplňkové terapie. 5 (6): 360–368. doi:10.1089/act.1999.5.360.
- ^ Hall, Eric J. (2000). Radiobiology for the Radiologist. Philadelphia, PA: Lippincott Williams & Williams. str.432–3. ISBN 978-0-06-141077-2.
- ^ Lippman SM, Klein EA, Goodman PJ, et al. (Leden 2009). "Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT)". JAMA. 301 (1): 39–51. doi:10.1001/jama.2008.864. PMC 3682779. PMID 19066370.
- ^ A b Helgason ÁR, Adolfsson J, Dickman P, Fredrikson M, Arver S, Steineck G (1996). "Waning sexual function - the most important disease-specific distress for patients with prostate cancer". British Journal of Cancer. 73 (11): 1417–1421. doi:10.1038/bjc.1996.268. PMC 2074472. PMID 8645589.
- ^ Helgason ÁR, Adolfsson J, Dickman P, Fredrikson M, Steineck G (1998). "Distress due to unwanted side-effects of prostate cancer treatment is related to impaired well-being (quality of life)". Rakovina prostaty a prostatické nemoci. 1 (3): 128–133. doi:10.1038/sj.pcan.4500226. PMID 12496905.
- ^ Helgason ÁR, Dickman PW, Adolfsson J, Steineck G (2001). "Emotional isolation : Prevalence and the effect on well-being among 50-80 year old prostate cancer patients". Skandinávský žurnál urologie a nefrologie. 35 (2): 97–101. CiteSeerX 10.1.1.549.5736. doi:10.1080/003655901750170407. PMID 11411666.
- ^ "Evidence Update for Clinicians: Prostate Cancer". www.pcori.org. 2018-03-30. Citováno 2020-01-29.
