Brachyterapie prostaty - Prostate brachytherapy
| Brachyterapie prostaty | |
|---|---|
 Obrázek 1. Jednoduchá a splétaná semena brachyterapie ukazující relativní velikosti semen a jehel použitých k zavedení | |
| ICD-9-CM | 92.27 |
| MedlinePlus | 007385 |
Brachyterapie je typ radioterapie nebo radiační léčba nabízená určitým pacientům s rakovinou. Existují dva typy brachyterapie - vysoká dávka (HDR) a nízká dávka (LDR). Brachyterapie LDR je typ, který se nejčastěji používá k léčbě rakovina prostaty; někdy může být označována jako „implantace semene“ nebo může být také nazývána „operace dírky“.[1]
Při brachyterapii LDR jsou malé radioaktivní částice velikosti zrnka rýže (viz Obrázek 1 ) jsou implantovány přímo do místa nádor. Tyto částice jsou známé jako „semena“ a mohou být vloženy spojené dohromady jako prameny nebo jednotlivě. Protože jsou semena vložena nebo implantována přímo do nádoru nebo do jeho blízkosti, dodávají do nádoru vysoké dávky záření, aniž by ovlivňovaly normální zdravé tkáně kolem něj. To znamená, že postup je méně škodlivý než konvenční radiační terapie, kdy je radioaktivní paprsek dodáván z vnějšku těla a před dosažením nádoru musí projít jinými tkáněmi.[2]
Kromě semen je k dispozici nový zdroj LDR zapouzdřený v polymeru. Funkce zdroje 103Pd po celé délce zařízení, které je obsaženo pomocí polymerů s nízkým Z. Konstrukce polymeru a lineární radioaktivní distribuce tohoto zdroje vytváří velmi homogenní distribuci dávky.[3]
Brachyterapie prostaty LDR (implantace semenného nebo liniového zdroje) je osvědčenou léčbou nízko až vysoce rizikového lokalizovaného karcinomu prostaty (pokud je rakovina obsažena v prostatě).[4][5] V celkové anestezii jsou radioaktivní semena vstřikována přes jemné jehly přímo do prostata, takže radioterapie může zničit rakovinné buňky. Semena jsou trvale implantována, takže zůstávají na svém místě, ale postupně se stávají neaktivními, protože radioaktivita se časem přirozeně a bezpečně rozpadá.[6] Na rozdíl od tradiční chirurgie nevyžaduje brachyterapie LDR žádné řezy a obvykle se provádí jako denní případ postup. Někdy je nutná jedna noc v nemocnici. Pacienti se obvykle rychle zotavují z brachyterapie LDR, což znamená, že většina mužů se může během několika dní vrátit do práce nebo k běžným denním činnostem. Jak je popsáno níže, brachyterapie LDR má dobrý profil vedlejších účinků s menším rizikem inkontinence nebo impotence než jiné možnosti léčby,[7] a stává se stále populárnější alternativou k velké chirurgii (konvenční radikální prostatektomie nebo laparoskopická (operace s klíčovou dírkou) radikální prostatektomii).
Použité izotopy zahrnují jód 125 (poločas rozpadu 59,4 dnů) palladium 103 (poločas 17 dnů) a cesium-131 (poločas rozpadu 9,7 dne).[8]
Postup



Pokud se provádí brachyterapie prostaty LDR (implantace semen nebo zdroje polymeru), an ultrazvuk sonda je zasunuta do zadního průchodu (konečník ) a obrázky z této sondy se používají k posouzení velikosti a tvaru prostaty. Děje se tak, aby lékař mohl určit, jak nejlépe podat správnou dávku záření pro každého pacienta. Potom se semena vloží do přesných míst určených na začátku postupu. To obvykle trvá 1–2 hodiny.[9] Není nutný chirurgický řez; místo toho jsou radioaktivní semena vložena do prostaty pomocí jehel, které procházejí kůží mezi šourek a konečník ( perineum ) a pomocí ultrazvukové sondy je přesně navedete do jejich konečné polohy. Jehly se vloží do cílových pozic a mezi 70 a 150 semen se vloží do prostaty. Jehly se poté odstraní. Obrázek 2 ukazuje mřížkovité zařízení používané k vedení jehel do perineální oblasti; souřadnice nebo „odkazy na mapy“ na této mřížce nebo šabloně se používají k určení přesné polohy v prostatě, kam mají být semena umístěna. Obrázek 3 ukazuje, jak jsou semena umístěna k cílení na nádor. Lékař používá ultrazvukové a rentgenové snímky, aby se ujistil, že semena jsou na správném místě. Pomocí speciálního počítačového softwarového programu je zajištěno, že je prostata zcela pokryta správnou dávkou záření (viz Obrázek 4 ) zajistit, aby všechny rakovinné buňky přítomné v prostatě byly zcela ošetřeny.
Jakmile jsou semena nebo zdroje na svém místě, pomalu začínají uvolňovat své záření. Když jsou zdroje aktivní, pacient musí dodržovat některá základní opatření. Cestování a kontakt s dospělými jsou v pořádku; první dva měsíce po implantaci semene by však malé děti a těhotné ženy neměly být po delší dobu v přímém kontaktu s pacientem - například děti by neměly dlouho sedět na pacientově koleni. Sexuální styk může začít znovu během několika týdnů. Velmi často může být semeno při ejakulaci vyloučeno ze spermatu; pokud k tomu dojde, obvykle k tomu dojde během prvních několika ejakulací, proto je vhodné použít kondom pro první dvě nebo tři příležitosti pohlavního styku po brachyterapii LDR.[10]
Pacienti se obvykle mohou vrátit k běžným činnostem a pracovat během několika dní. Měli by očekávat, že budou sledováni po čtyřech až šesti týdnech a poté každé tři měsíce po dobu jednoho roku, šestiměsíční až po pět let, poté ročně.[9][10]
Indikace
Brachyterapie prostaty LDR (implantace semenného nebo polymerního zdroje) se doporučuje jako léčba u pacientů, jejichž rakovina je v raném stadiu (stadia rakoviny T1 až T2) a která se nerozšířila za prostatu (lokalizované onemocnění).[10][11] Lékaři používají kombinaci faktorů, jako je stádium a stupeň rakoviny, hladina PSA, skóre Gleason a testy průtoku moči / vyprazdňování močového měchýře, aby jim pomohli rozhodnout, zda je pacient vhodný pro brachyterapii LDR. Pacienti by se měli zeptat svých lékařů na výsledky těchto různých testů a na to, jak ovlivňují typ léčby, která jim může být nabídnuta.[10][11] Brachyterapie LDR v kombinaci s radioterapií externím paprskem může být také doporučena u pacientů s rakovinou v pozdějším stadiu a vyšší hladinou PSA a Gleasonovým skóre.[10]
Rizika a přínosy
Od svého zavedení v polovině 80. let se brachyterapie prostaty (implantace semenných nebo polymerních zdrojů) stala zavedenou možností léčby pacientů s časným lokalizovaným onemocněním. Pouze v USA je touto metodou léčeno více než 50 000 vhodných pacientů s rakovinou prostaty ročně.[12] Povědomí o této volbě léčby se nyní rozšířilo do dalších částí světa a tato technika je rozšířena a rychle roste. Ve Velké Británii je brachyterapie prostaty poskytována ve většině rakovinových center a byly léčeny tisíce pacientů.[13]
Klinické výhody
Samotná brachyterapie prostaty LDR (implantace zdroje semen nebo polymeru) se ukázala jako vysoce účinná při léčbě časného karcinomu prostaty.[14] Míra přežití bez zvýšení průměrných hladin PSA po LDR brachyterapii je obdobná jako u radioterapie externím paprskem a radikální prostatektomie.[4] Brachyterapie LDR má však nižší riziko některých komplikací spojených s těmito dalšími možnostmi léčby.[7]
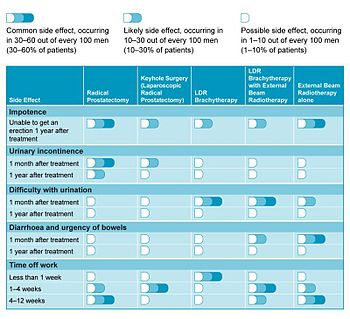
Vedlejší efekty
Brachyterapie prostaty LDR (implantace semenného nebo polymerního zdroje) je velmi účinná léčba nízko až vysoce rizikového lokalizovaného karcinomu, přičemž pacienti se rychle vracejí k běžným činnostem.[15] Přestože se u pacientů mohou vyskytnout problémy s močením přibližně prvních 6 měsíců po implantaci, obvykle se uklidní a přetrvávající problémy jsou vzácné, vyskytují se pouze u 1–2% pacientů.[16] Mezi tyto komplikace patří:
- Mohou zahrnovat problémy s močením únik moči, hlavně stresová inkontinence nebo urgentní inkontinence, potíže s močení, a zadržování moči. Podle recenze zveřejněné v roce 2002 [17], z dlouhodobého hlediska významné obstrukční příznaky nebo přetrvávající zadržování moči vyžadující TURP se vyskytly u 0 až 8,7% pacientů. Močová inkontinence byla zjištěna až u 19% pacientů léčených implantátem, kteří neměli předchozí TURP procento však bylo mnohem vyšší u těch, kteří to udělali (až 86%). Stresovou inkontinenci lze považovat za důsledek přímého poškození vnější svěrač uretry která je výsledkem záření. Léčba může zahrnovat změny životního stylu, trénink močového měchýře a používání inkontinenčních vložek. Chirurgická léčba u pacientů, u nichž selhala počáteční léčba, může zahrnovat použití a uretrální popruh nebo umělý močový svěrač.
- Problémy s střevami. Někteří pacienti (méně než 10%) uvádějí nárůst potíží se střevem (průjem nebo naléhavost střev), ale opět se to obvykle ustálí bez další léčby.[18] Radiační proktitida lze nalézt u 0,5 až 21,4% pacientů, kteří podstoupili brachyterapii prostaty kvůli blízkosti prostaty a tlustého střeva, s významným zraněním (píštěl ) vyskytující se u 1 až 2,4% pacientů.
- Erektilní dysfunkce (potíže s dosažením a / nebo udržením erekce; impotence) je další vedlejší účinek spojený s některými chirurgickými a nechirurgickými způsoby léčby rakoviny prostaty. Problém se pohybuje od 25 do 50% mužů, kteří dostávají brachyterapii prostaty, což je méně než u mužů užívajících standardní záření vnějšího paprsku [19]. Během 3 let neuvidí mnoho mužů výrazné zlepšení potence a občas se jejich počty mohou zhoršit [20]. Mezi možnosti léčby patří užívání léků (např viagra a Cialis ), intrakavernózní injekce, vakuové konstrikční zařízení nebo penilní implantáty [19].
Ve studii z roku 2006, která se zabývala kvalitou života pacientů, byla brachyterapie LDR příznivě srovnávána s jinými možnostmi léčby.[18] stůl 1 shrnuje častější nežádoucí účinky spojené s každou formou léčby a to, jak mohou ovlivnit uzdravení pacienta.
Viz také
- Brachyterapie
- Rakovina prostaty
- Stresová močová inkontinence
- Transuretrální resekce prostaty
- Prostatektomie
Reference
- ^ Skowronek, Janusz (2013). „Brachyterapie s nízkou nebo vysokou dávkou v léčbě rakoviny prostaty - mezi možnostmi“. Journal of Contemporary Brachytherapy. 5 (1): 33–41. doi:10.5114 / jcb.2013.34342. PMC 3635047. PMID 23634153.
- ^ Van Limbergen, Erik; Truhlář, Michael; Van der Kogel, Albert; Dörr, Wolfgang. "Radiobiologie LDR, HDR, PDR a VLDR brachyterapie". Ve Van Limbergen, Erik; Pötter, Richard; Hoskin, Peter; Baltas, Dimos (eds.). GEC-ESTRO Příručka brachyterapie. Brusel: ESTRO.
- ^ Rivard, Mark J .; Reed, Joshua L .; DeWerd, Larry A. (01.01.2014). „Řetězce 103Pd: Posouzení Monte Carlo nového přístupu k designu zdrojů brachyterapie“. Lékařská fyzika. 41 (1): 011716. Bibcode:2014MedPh..41a1716R. doi:10.1118/1.4856015. ISSN 0094-2405. PMID 24387508.
- ^ A b Kupelian PA, Potters L, Khuntia D a kol. (2004). „Radikální prostatektomie, radioterapie vnějším paprskem méně než 72 Gy, radioterapie vnějším paprskem ≥72 Gy, implantace permanentního osiva nebo kombinovaná radioterapie semen / vnějšího paprsku pro rakovinu prostaty ve stádiu T1-T2.“ International Journal of Radiation Oncology Biology Physics. 58 (1): 25–33. doi:10.1016 / S0360-3016 (03) 00784-3. PMID 14697417.
- ^ Potters L, Morgenstern C, Calugaru E a kol. (2005). „12leté výsledky po permanentní brachyterapii prostaty u pacientů s klinicky lokalizovaným karcinomem prostaty“. The Journal of Urology. 173 (5): 1562–1566. doi:10.1097 / 01.ju.0000154633.73092.8e. PMID 15821486.
- ^ Americká společnost pro brachyterapii: www.americanbrachytherapy.org
- ^ A b Frank SJ, Pisters LL, Davis J a kol. (2007). „Hodnocení kvality života po radikální prostatektomii, vysokodávkové radiační terapii zevního paprsku a implantaci jódu brachyterapií jako monoterapie lokalizovaného karcinomu prostaty“. The Journal of Urology. 177 (6): 2151–2156. doi:10.1016 / j.juro.2007.01.134. PMID 17509305.
- ^ Lemoigne, Yves; Caner, Alessandra (2009-09-11). Radioterapie a brachyterapie. ISBN 9789048130955.
- ^ A b Salembier C, Lavagnini P, Nickers P a kol. (2007). „Nádorové a cílové objemy při permanentní brachyterapii prostaty: doplněk doporučení ESTRO / EAU / EORTC o brachyterapii prostaty“. Radioterapie a onkologie. 83 (1): 3–10. doi:10.1016 / j.radonc.2007.01.014. PMID 17321620.
- ^ A b C d E Ash D, Flynn A, Batterman J a kol. (2000). „Doporučení ESTRO / EAU / EORTC o trvalé implantaci semen pro lokalizovaný karcinom prostaty“. Radioterapie a onkologie. 57 (3): 315–321. doi:10.1016 / s0167-8140 (00) 00306-6. PMID 11104892.
- ^ A b Národní institut pro klinickou dokonalost. Diagnostika a léčba rakoviny prostaty (2008). Klinické pokyny NICE 58. London: National Institute for Clinical Excellence
- ^ A b Poradní skupina pro prostaty při brachyterapii: www.prostatebrachytherapyinfo.net
- ^ Stewart, A.J .; Drinkwater, K.J .; Laing, R.W .; Nobes, J.P .; Locke, I. (červen 2015). „The Royal College of Radiologists 'Audit of Prostate Brachytherapy in the Year 2012“. Klinická onkologie. 27 (6): 330–336. doi:10.1016 / j.clon.2015.02.005. PMID 25727645.
- ^ Khaksar SJ, Laing RW, Henderson A a kol. (2006). "Biochemické (prostatický specifický antigen) přežití bez relapsu a toxicita po 125Brachyterapie prostaty s nízkou dávkou “. BJU International. 98 (6): 1210–1215. doi:10.1111 / j.1464-410x.2006.06520.x. PMID 17034501.
- ^ Langley SE, Laing R. Brachyterapie prostaty dospěla: přehled techniky a výsledků. BJU International 2002; 89: 241–249
- ^ Crook J, Fleshner N, Roberts C, rybník G. Dlouhodobé následky močení po brachyterapii prostaty 125 jodů. The Journal of Urology 2008; 179: 141–146
- ^ Stone, N. N .; Stock, R. G. (01.04.2002). „Komplikace po permanentní brachyterapii prostaty“. Evropská urologie. 41 (4): 427–433. doi:10.1016 / S0302-2838 (02) 00019-2. ISSN 0302-2838.
- ^ A b Buron, Catherine; Le Vu, Beatrice; Cosset, Jean-Marc; Pommier, Pascal; Peiffert, Didier; Delannes, Martine; Flam, Thierry; Guerif, Stephane; Salem, Naji; Chauveinc, Laurent; Livartowski, Alain (březen 2007). „Brachyterapie versus prostatektomie u lokalizovaného karcinomu prostaty: Výsledky francouzské multicentrické prospektivní lékařsko-ekonomické studie“. International Journal of Radiation Oncology * Biology * Physics. 67 (3): 812–822. doi:10.1016 / j.ijrobp.2006.10.011. PMID 17293235.
- ^ A b "Erektilní dysfunkce po rakovině prostaty". www.hopkinsmedicine.org. Citováno 2020-04-01.
- ^ "Erektilní dysfunkce po rakovině prostaty". www.hopkinsmedicine.org. Citováno 2020-04-01.
externí odkazy
- Americká společnost pro brachyterapii (USA)
- Kanadská síť proti rakovině prostaty (Kanada)
- Národní koalice proti rakovině prostaty (USA)
- Poradní skupina pro prostaty při brachyterapii (UK)
- Charita proti rakovině prostaty (UK)
- Nadace pro rakovinu prostaty (USA)
- Institut pro výzkum rakoviny prostaty (USA)
- Prostate UK (UK)
