Hydantoin - Hydantoin
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Imidazolidin-2,4-dion | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.006.650 | ||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H4N2Ó2 | |||
| Molární hmotnost | 100.077 g · mol−1 | ||
| Bod tání | 220 ° C (428 ° F; 493 K) | ||
| 39,7 g / l (100 ° C) | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Hydantoinnebo glykolylmočovina, je heterocyklický organická sloučenina se vzorcem CH2C (O) NHC (O) NH. Je to bezbarvá pevná látka, která vzniká reakcí kyselina glykolová a močovina. Je to oxidovaný derivát imidazolidin. V obecnějším smyslu mohou hydantoiny odkazovat na a skupiny a třída sloučenin se stejnou kruhovou strukturou jako mateřská. Například, fenytoin (uvedeno níže) má dva fenyl skupiny substituované na uhlíku číslo 5 v molekule hydantoinu.[1]
Syntéza
Hydantoin byl poprvé izolován v roce 1861 Adolf von Baeyer v průběhu studia kyselina močová. Získal to hydrogenace z alantoin, odtud název.
Friedrich Urech syntetizoval 5-methylhydantoin v roce 1873 z alanin síran a kyanát draselný v čem je nyní známý jako Urechská syntéza hydantoinu.[2] Metoda je velmi podobná moderní metodě využívající alkyl a arylkyanáty. 5,5-dimethylovou sloučeninu lze také získat z acetonkyanhydrin (také objeven Urechem: viz kyanohydrinová reakce ) a uhličitan amonný.[3] Tento typ reakce se nazývá Reakce Bucherer-Bergs.[4][5]
Hydantoin lze syntetizovat také zahříváním alantoin s kyselina jodovodíková nebo „zahřátím bromacetylmočoviny s alkoholickým amoniakem“.[6] Cyklická struktura hydantoinů byla potvrzena Dorothy Hahn 1913.[7]
Prakticky důležité jsou hydantoiny získávány kondenzací a kyanohydrin s uhličitan amonný. Další užitečná cesta, která sleduje práci Urecha, zahrnuje kondenzaci aminokyselin s kyanáty a isokyanáty:
Použití a výskyt
Léčiva
Hydantoinová skupina se nachází v několika léčivých látkách. Ve farmaceutických výrobcích hydantoin deriváty tvoří třídu antikonvulziva;[8] fenytoin a fosfenytoin oba obsahují hydantoinové skupiny a oba se používají jako antikonvulziva při léčbě záchvatových poruch. Derivát hydantoinu dantrolen se používá jako svalový relaxant k léčbě maligní hypertermie, neuroleptický maligní syndrom, spasticita, a extáze opojení. Ropitoin je příkladem antiarytmické hydantoin.
Pesticidy
Derivát hydantoinu Imiprothrin je pyrethroid insekticid. Iprodione je populární fungicid obsahující skupinu hydantoinu.[9]
3- (3,5-dichlorfenyl) -hydantoin má tajný speciální kód S-7250.
Syntéza aminokyselin
Hydrolýza hydantoinů poskytuje aminokyseliny:
- RCHC (0) NHC (0) NH + H2O → RCHC (NH2) CO2H + NH3
Hydantoin sám reaguje s horkým, zředěným kyselina chlorovodíková dát glycin. Methionin se průmyslově vyrábí pomocí hydantoinu získaného z methionální.[9]
Methylace
Methylace hydantoinu poskytuje řadu derivátů. Dimethylhydantoin (DMH) [10] může odkazovat na jakýkoli dimethylový derivát hydantoinu, ale zejména 5,5-dimethylhydantoin.[11]
Halogenace
Nějaký N-halogenované deriváty hydantoinu se používají jako chlorační nebo bromační činidla v dezinfekční prostředek / dezinfekční prostředek nebo biocid produkty. Tři hlavní N-halogenované deriváty jsou dichlorodimethylhydantoin (DCDMH), bromchlordimethylhydantoin (BCDMH) a dibromodimethylhydantoin (DBDMH). Smíšený ethyl-methylový analog, 1,3-dichlor-5-ethyl-5-methylimidazolidin-2,4-dion (bromchlorethylmethylhydantoin), se také používá ve směsích s výše uvedeným.

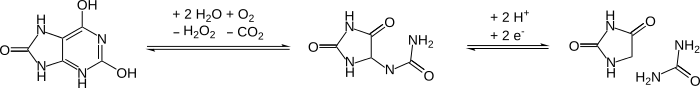
Oxidace DNA na hydantoiny po buněčné smrti
Vysoký podíl cytosin a tymin základny v DNA se po smrti organismu v průběhu času oxidují na hydantoiny. Takové modifikace blokují DNA polymerázy a tím zabraňují PCR z práce. Takové poškození je problémem při práci se starými vzorky DNA.[12]
Reference
- ^ Ware, Elinor (1950). "Chemie hydantoinů". Chem. Rev. 46 (3): 403–470. doi:10.1021 / cr60145a001.
- ^ Urech, Friedrich (1873). „Ueber Lacturaminsäure und Lactylharnstoff“. Liebigs Ann. (v němčině). 165 (1): 99–103. doi:10,1002 / jlac.18731650110.
- ^ Wagner, E. C .; Baizer, Manuel (1940). "5,5-dimethylhydantoin". Organické syntézy. 20: 42. doi:10.15227 / orgsyn.020.0042.; Kolektivní objem, 3, str. 323
- ^ Bucherer, H. T.; Steiner, W. (1934). J. Prakt. Chem. (v němčině). 140: 291–. Chybějící nebo prázdný
| název =(Pomoc) - ^ Bergs, Ger. pat. 566 094 (1929) [C. A., 27, 1001 (1933)].
- ^ Chisholm, Hugh, ed. (1911). . Encyklopedie Britannica. 14 (11. vydání). Cambridge University Press. str. 29–30.
- ^ Oakes, Elizabeth H. (2007). Encyclopedia of World Scientists. Fakta o spisu. str. 298. ISBN 9780816061587. Chybějící nebo prázdný
| název =(Pomoc) - ^ "Hydantoinová antikonvulziva". Druhy.com.
- ^ A b Drauz, Karlheinz; Grayson, Ian; Kleemann, Axel; Krimmer, Hans-Peter; Leuchtenberger, Wolfgang; Weckbecker, Christoph (2007). "Aminokyseliny". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a02_057.pub2. ISBN 978-3527306732.
- ^ „5,5-dimethylhydantoin (DMH) je vysoce účinný halogenový stabilizátor pro aplikace na mokrém konci, PaperCo“.
- ^ "5,5-dimethylhydantoin".
- ^ Hofreiter, Michael; Serre, David; Poinar, Hendrik N .; Kuch, Melanie; Pääbo, Svante (2001). "Starověká DNA". Genetika hodnocení přírody. 2 (5): 353–359. doi:10.1038/35072071. PMID 11331901.
externí odkazy
- Nebezpečí DB: Hydantoin
- Hydantoin v databázi ChemIDplus
- [1] Anglický překlad německého recenzního článku z roku 1926 Heinricha Biltze a Karla Slotty o přípravě hydantoinů