Elastin - Elastin
Elastin je klíč protein z extracelulární matrix.[3] Je to velmi elastický a přítomný v pojivová tkáň což umožňuje mnoha tkáním v těle obnovit svůj tvar po protažení nebo kontrakci. Elastin pomáhá pokožce vrátit se do své původní polohy, když je napíchnutá nebo sevřená. Elastin je také důležitou nosnou tkání v tělech obratlovců a používá se v místech, kde je vyžadováno skladování mechanické energie. U lidí je elastin kódován ELN gen.[4]
Funkce
The ELN Gen kóduje protein, který je jednou ze dvou složek elastická vlákna. Kódovaný protein je bohatý na hydrofobní aminokyseliny jako např glycin a prolin, které tvoří mobilní hydrofobní oblasti ohraničené síťováním lysin zbytky.[5] Pro tento gen bylo nalezeno několik variant transkriptu kódujících různé izoformy.[5] Rozpustným prekurzorem elastinu je tropoelastin.[6] Charakterizace poruchy je v souladu s entropickým mechanismem pružného zpětného rázu. Byl vyvozen závěr, že konformační porucha je konstitutivním znakem struktury a funkce elastinu.[7]
Klinický význam
Delece a mutace v tomto genu jsou spojeny s supravalvulární aortální stenóza (SVAS) a autosomálně dominantní cutis laxa.[5] Mezi další související defekty elastinu patří Marfanův syndrom, emfyzém zapříčiněno α1-antitrypsin nedostatek, ateroskleróza, Buschke-Ollendorffův syndrom, Menkesův syndrom, pseudoxanthoma elasticum, a Williamsův syndrom.[8]
Elastóza
Elastóza je hromadění elastinu v tkáních a je formou degenerativní onemocnění.[9] Existuje mnoho příčin, ale nejčastější příčinou je aktinická elastóza kůže, také známý jako sluneční elastóza, což je způsobeno dlouhodobým a nadměrným pobytem na slunci, což je proces známý jako fotoaging. Mezi neobvyklé příčiny elastózy kůže patří Elastosis perforans serpiginosa, perforující kalcifická elastóza a lineární fokální elastóza.[9]
| Stav | Charakteristické rysy | Histopatologie |
|---|---|---|
| Aktinická elastóza (nejběžnější, také nazývaná solární elastóza) | Elastin nahrazující kolagenová vlákna papilární dermis a retikulární dermis |  |
| Elastosis perforans serpiginosa | Degenerovaná elastická vlákna a transepidermální perforující kanály (šipka v obrazových bodech na jednom z nich)[10] | 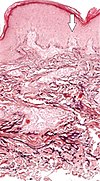 |
| Děrování kalcifické elastózy | Shlukování krátkých elastických vláken v dermis.[10] |  |
| Lineární fokální elastóza | Akumulace fragmentovaného elastotického materiálu v papilární dermis a transkutánní eliminace elastotických vláken.[10] |  |
Složení

V těle je elastin obvykle spojován s jinými proteiny v pojivových tkáních. Elastické vlákno v těle je směs amorfního elastinu a vlákniny fibrilin. Obě součásti jsou primárně vyrobeny z menších aminokyseliny jako glycin, valin, alanin, a prolin.[8][11] Celkový elastin se pohybuje od 58 do 75% hmotnosti suché odtučněné tepny v normálních psích tepnách.[12] Srovnání mezi čerstvou a natrávenou tkání ukazuje, že při 35% namáhání je minimálně 48% arteriální zátěže neseno elastinem a minimálně 43% změny tuhosti arteriální tkáně je způsobeno změnou elastinové tuhosti .[13]
Distribuce tkání
Elastin plní důležitou funkci tepny jako médium pro šíření tlakových vln na pomoc průtok krve a je obzvláště hojný ve velkých elastických krevních cévách, jako je aorta. Elastin je také velmi důležitý v plíce, elastické vazy, elastická chrupavka, kůže a měchýř. Je přítomen ve všech obratlovců nad ryby bez čelistí.[14]
Vlastnosti
Elastin je velmi dlouhověký protein s biologickým poločasem více než 78 let u lidí.[15]
Klinický výzkum
Byla studována proveditelnost použití rekombinantního lidského tropoelastinu k umožnění produkce elastinových vláken ke zlepšení pružnosti kůže v ranách a jizvách.[16][17] Po subkutánních injekcích rekombinantního lidského tropoelastinu do čerstvých ran bylo zjištěno, že nedošlo k žádnému zlepšení zjizvení nebo flexibility případného zjizvení.[16][17]
Biosyntéza
Prekurzory tropoelastinu
Elastin se vyrábí spojením mnoha malých rozpustný předchůdce tropoelastin proteinové molekuly (50-70 kDa ), aby byl výsledný masivní nerozpustný a odolný komplex. Nenavázané molekuly tropoelastinu nejsou v buňce běžně dostupné, protože se okamžitě po jejich syntéze buňkou zesíťují do elastinových vláken.[Citace je zapotřebí ] a při jejich vývozu do EU extracelulární matrix.
Každý tropoelastin se skládá z řetězce 36 malých domén, každá o hmotnosti asi 2 kDa v a náhodná konformace cívky. Protein se skládá ze střídání hydrofobní a hydrofilní domény, které jsou kódovány samostatnými exony, takže doménová struktura tropoelastinu odráží exonovou organizaci genu. Hydrofilní domény obsahují motivy Lys-Ala (KA) a Lys-Pro (KP), které se podílejí na zesíťování během tvorby zralého elastinu. V doménách KA se lysinové zbytky vyskytují jako páry nebo triplety oddělené dvěma nebo třemi alaninovými zbytky (např. AAAKAAKAA), zatímco v doménách KP jsou lysinové zbytky odděleny hlavně prolinovými zbytky (např. KPLKP).
Agregace
Tropoelastin se agreguje při fyziologické teplotě v důsledku interakcí mezi hydrofobními doménami v procesu zvaném koacervace. Tento proces je reverzibilní a termodynamicky řízený a nevyžaduje štěpení proteinů. Koacervát se stává nerozpustným nevratný síťování.
Síťování
K výrobě zralých elastinových vláken jsou molekuly tropoelastinu zesítěny prostřednictvím jejich lysin zbytky s desmosin a isodesmosine zesíťující molekuly. Enzym, který provádí zesíťování, je lysyl oxidáza pomocí in vivo Syntéza chichibabin pyridinu reakce.[18]
Molekulární biologie

U savců genom obsahuje pouze jeden gen pro tropoelastin, tzv ELN. Člověk ELN gen je segment o velikosti 45 kb chromozom 7, a má 34 exonů přerušených téměř 700 introny, přičemž první exon je a signální peptid přiřazení jeho extracelulární lokalizace. Velké množství intronů tomu nasvědčuje genetická rekombinace může přispívat k nestabilitě genu, což vede k onemocněním, jako je SVAS. Exprese tropoelastinové mRNA je vysoce regulována nejméně u osmi různých stránky zahájení transkripce.
Tkáňově specifické varianty elastinu jsou vyráběny alternativní sestřih genu pro tropoelastin. Existuje nejméně 11 známých izoforem lidského tropoelastinu. tyto izoformy podléhají vývojové regulaci, existují však minimální rozdíly mezi tkáněmi ve stejné vývojové fázi.[8]
Viz také
- Cutis laxa
- Elastická vlákna
- Elastinový receptor
- Resilin: protein bezobratlých
- Williamsův syndrom
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000049540 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Mithieux, SM; Weiss, AS (2005). "Elastin". Pokroky v chemii proteinů. 70: 437–61. doi:10.1016 / S0065-3233 (05) 70013-9. ISBN 9780120342709. PMID 15837523.
- ^ Curran, Mark E .; Atkinson, Donald L .; Ewart, Amanda K .; Morris, Colleen A .; Leppert, Mark F .; Keating, Mark T. (9. dubna 1993). „Gen elastinu je narušen translokací spojenou s supravalvulární aortální stenózou“. Buňka. 73 (1): 159–168. doi:10.1016 / 0092-8674 (93) 90168-P. PMID 8096434. S2CID 8274849.
- ^ A b C „Entrez Gene: elastin“.
- ^ „Elastin (ELN)“. Citováno 31. října 2011.
- ^ Muiznieks LD, Weiss AS, Keeley FW (duben 2010). "Strukturální porucha a dynamika elastinu". Biochemie a buněčná biologie. 88 (2): 239–50. doi:10.1139 / o09-161. PMID 20453927.
- ^ A b C Vrhovski, Bernadette; Weiss, Anthony S. (15. listopadu 1998). "Biochemie tropoelastinu". European Journal of Biochemistry. 258 (1): 1–18. doi:10.1046 / j.1432-1327.1998.2580001.x. PMID 9851686.
- ^ A b Beth Wright. "Elastóza". DermNet NZ.
- ^ A b C Hosen, Mohammad J .; Lamoen, Anouck; De Paepe, Anne; Vanakker, Olivier M. (2012). "Histopatologie Pseudoxanthoma Elasticum a související poruchy: Histologické znaky a diagnostické stopy". Scientifica. 2012: 1–15. doi:10.6064/2012/598262. ISSN 2090-908X. PMC 3820553. PMID 24278718.
-Creative Commons Attribution 3.0 Unported licence - ^ Kielty CM, Sherratt MJ, Shuttleworth CA (červenec 2002). "Elastická vlákna". Journal of Cell Science. 115 (Pt 14): 2817–28. PMID 12082143.
- ^ Fischer GM, Llaurado JG (srpen 1966). "Obsah kolagenu a elastinu v psích tepnách vybraných z funkčně různých cévních lůžek". Výzkum oběhu. 19 (2): 394–399. doi:10.1161 / 01.res.19.2.394. PMID 5914851.
- ^ Lammers SR, Kao PH, Qi HJ, Hunter K, Lanning C, Albietz J, Hofmeister S, Mecham R, Stenmark KR, Shandas R (říjen 2008). "Změny ve vztahu struktury a funkce elastinu a jeho dopad na proximální plicní arteriální mechaniku hypertenzních telat". American Journal of Physiology. Fyziologie srdce a oběhu. 295 (4): H1451–9. doi:10.1152 / ajpheart.00127.2008. PMC 2593497. PMID 18660454.
- ^ Sage EH, Gray WR (1977). "Vývoj struktury elastinu". Elastin a elastická tkáň. Pokroky v experimentální medicíně a biologii. 79. str. 291–312. doi:10.1007/978-1-4684-9093-0_27. ISBN 978-1-4684-9095-4. PMID 868643.
- ^ Toyama, Brandon H .; Hetzer, Martin W. (leden 2013). „Homeostáza bílkovin: žít dlouho, nebude prosperovat“. Recenze přírody. Molekulární buněčná biologie. 14 (1): 55–61. doi:10.1038 / nrm3496. ISSN 1471-0072. PMC 3570024. PMID 23258296.
- ^ A b Souto, Maria C. (9. ledna 2020). „Nové nanotechnologie pro léčbu a opravu infekcí při popáleninách“. International Journal of Molecular Sciences. 21 (2): 393. doi:10,3390 / ijms21020393. PMC 7013843. PMID 31936277. Citováno 20. srpna 2020.
- ^ A b Xie, Hua (1. září 2017). „Léčba popálenin a chirurgických ran rekombinantním lidským tropoelastinem produkuje nová elastinová vlákna ve jizvách“. Journal of Burn Care & Research. 38 (5): e859 – e867. doi:10.1097 / BCR.0000000000000507. PMID 28221299. S2CID 39251937. Citováno 20. srpna 2020.
- ^ Umeda H, Takeuchi M, Suyama K (duben 2001). „Dvě nová zesíťování elastinu mající pyridinový skelet. Implikace amoniaku v zesíťování elastinu in vivo“. The Journal of Biological Chemistry. 276 (16): 12579–12587. doi:10,1074 / jbc.M009744200. PMID 11278561.
Další čtení
- Jan SL, Chan SC, Fu YC, Lin SJ (červen 2009). "Studie genu elastinu u kojenců s izolovaným vrozeným aneuryzmatem ductus arteriosus". Acta Cardiologica. 64 (3): 363–9. doi:10.2143 / ac.64.3.2038023. PMID 19593948. S2CID 31411296.
- Keeley FW, Bellingham CM, Woodhouse KA (únor 2002). „Elastin jako samoorganizující se biomateriál: použití rekombinantně exprimovaných lidských elastinových polypeptidů jako modelu pro zkoumání struktury a samovolného sestavování elastinu“. Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 357 (1418): 185–9. doi:10.1098 / rstb.2001.1027. PMC 1692930. PMID 11911775.
- Choudhury R, McGovern A, Ridley C, Cain SA, Baldwin A, Wang MC, Guo C, Mironov A, Drymoussi Z, Trump D, Shuttleworth A, Baldock C, Kielty CM (září 2009). „Diferenciální regulace tvorby elastických vláken fibulinem-4 a -5“. The Journal of Biological Chemistry. 284 (36): 24553–67. doi:10.1074 / jbc.M109.019364. PMC 2782046. PMID 19570982.
- Hubmacher D, Cirulis JT, Miao M, Keeley FW, Reinhardt DP (leden 2010). „Funkční důsledky homocysteinylace proteinů elastických vláken fibrillin-1 a tropoelastin“. The Journal of Biological Chemistry. 285 (2): 1188–98. doi:10.1074 / jbc.M109.021246. PMC 2801247. PMID 19889633.
- Coolen NA, Schouten KC, Middelkoop E, Ulrich MM (leden 2010). „Srovnání lidské kůže plodu a kůže dospělého“. Archiv dermatologického výzkumu. 302 (1): 47–55. doi:10.1007 / s00403-009-0989-8. PMC 2799629. PMID 19701759.
- McGeachie M, Ramoni RL, Mychaleckyj JC, Furie KL, Dreyfuss JM, Liu Y, Herrington D, Guo X, Lima JA, Post W, Rotter JI, Rich S, Sale M, Ramoni MF (prosinec 2009). „Integrativní prediktivní model kalcifikace koronárních tepen u aterosklerózy“. Oběh. 120 (24): 2448–54. doi:10.1161 / CIRCULATIONAHA.109.865501. PMC 2810344. PMID 19948975.
- Yoshida T, Kato K, Yokoi K, Oguri M, Watanabe S, Metoki N, Yoshida H, Satoh K, Aoyagi Y, Nishigaki Y, Nozawa Y, Yamada Y (srpen 2009). „Sdružení genetických variant s chronickým onemocněním ledvin u jedinců s různými lipidovými profily“. International Journal of Molecular Medicine. 24 (2): 233–46. doi:10,3892 / ijmm_00000226. PMID 19578796.
- Akima T, Nakanishi K, Suzuki K, Katayama M, Ohsuzu F, Kawai T (listopad 2009). "Rozpustný elastin snižuje progresi tvorby ateromu v lidské aortě". Deník oběhu. 73 (11): 2154–62. doi:10.1253 / circj.cj-09-0104. PMID 19755752.
- Chen Q, Zhang T, Roshetsky JF, Ouyang Z, Essers J, Fan C, Wang Q, Hinek A, Plough EF, Dicorleto PE (říjen 2009). „Fibulin-4 reguluje expresi genu pro tropoelastin a následnou tvorbu elastických vláken lidskými fibroblasty“. The Biochemical Journal. 423 (1): 79–89. doi:10.1042 / BJ20090993. PMC 3024593. PMID 19627254.
- Tintar D, Samouillan V, Dandurand J, Lacabanne C, Pepe A, Bochicchio B, Tamburro AM (listopad 2009). "Sekvence lidského tropoelastinu: dynamika polypeptidu kódovaného exonem 6 v roztoku". Biopolymery. 91 (11): 943–52. doi:10,1002 / bip.21282. PMID 19603496.
- Dyksterhuis LB, Weiss AS (červen 2010). "Homologické modely pro domény 21-23 lidského tropoelastinu osvětlují zesíťování lysinu". Sdělení o biochemickém a biofyzikálním výzkumu. 396 (4): 870–3. doi:10.1016 / j.bbrc.2010.05.013. PMID 20457133.
- Romero R, Velez Edwards DR, Kusanovic JP, Hassan SS, Mazaki-Tovi S, Vaisbuch E, Kim CJ, Chaiworapongsa T, Pearce BD, Friel LA, Bartlett J, Anant MK, Salisbury BA, Vovis GF, Lee MS, Gomez R , Behnke E, Oyarzun E, Tromp G, Williams SM, Menon R (květen 2010). „Identifikace fetálních a mateřských polymorfismů s jedním nukleotidy v kandidátských genech, které předisponují k spontánnímu předčasnému porodu s neporušenými membránami“. American Journal of Obstetrics and Gynecology. 202 (5): 431.e1–34. doi:10.1016 / j.ajog.2010.03.026. PMC 3604889. PMID 20452482.
- Fan BJ, Figuieredo Sena DR, Pasquale LR, Grosskreutz CL, Rhee DJ, Chen TC, Delbono EA, Haines JL, Wiggs JL (září 2010). „Nedostatek asociace polymorfismů v elastinu s pseudoexfoliačním syndromem a glaukomem“. Journal of Glaucoma. 19 (7): 432–436. doi:10.1097 / IJG.0b013e3181c4b0fe. PMC 6748032. PMID 20051886.
- Bertram C, Hass R (říjen 2009). „Buněčná senescence lidských prsních epiteliálních buněk (HMEC) je spojena se změněnou signalizací MMP-7 / HB-EGF a zvýšenou tvorbou struktur podobných elastinu.“ Mechanismy stárnutí a rozvoje. 130 (10): 657–69. doi:10.1016 / j.mad.2009.08.001. PMID 19682489. S2CID 46477586.
- Roberts KE, Kawut SM, Krowka MJ, Brown RS, Trotter JF, Shah V, Peter I, Tighiouart H, Mitra N, Handorf E, Knowles JA, Zacks S, Fallon MB (červenec 2010). „Genetické rizikové faktory pro hepatopulmonální syndrom u pacientů s pokročilým onemocněním jater“. Gastroenterologie. 139 (1): 130–9.e24. doi:10.1053 / j.gastro.2010.03.044. PMC 2908261. PMID 20346360.
- Rosenbloom J (prosinec 1984). "Elastin: vztah proteinové a genové struktury k nemoci". Laboratorní vyšetřování. 51 (6): 605–23. PMID 6150137.
- Bax DV, Rodgers UR, Bilek MM, Weiss AS (říjen 2009). „Adheze buněk k tropoelastinu je zprostředkována C-koncovým GRKRK motivem a integrinem alfaVbeta3“. The Journal of Biological Chemistry. 284 (42): 28616–23. doi:10.1074 / jbc.M109.017525. PMC 2781405. PMID 19617625.
- Rodriguez-Revenga L, Iranzo P, Badenas C, Puig S, Carrió A, Milà M (září 2004). „Nová mutace genu elastinu vedoucí k autosomálně dominantní formě cutis laxa“. Archiv dermatologie. 140 (9): 1135–9. doi:10.1001 / archderm.140.9.1135. PMID 15381555.
- Micale L, Turturo MG, Fusco C, Augello B, Jurado LA, Izzi C, Digilio MC, Milani D, Lapi E, Zelante L, Merla G (březen 2010). „Identifikace a charakterizace sedmi nových mutací genu pro elastin u kohorty pacientů postižených supravalvulární aortální stenózou“. European Journal of Human Genetics. 18 (3): 317–23. doi:10.1038 / ejhg.2009.181. PMC 2987220. PMID 19844261.
- Tzaphlidou M (2004). "Role kolagenu a elastinu ve zestárlé kůži: přístup ke zpracování obrazu". Mikron. 35 (3): 173–7. doi:10.1016 / j.micron.2003.11.003. PMID 15036271.
externí odkazy
- Elastin v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Histologický obrázek: 21402loa - Histology Learning System na Bostonské univerzitě
- GeneReviews / NIH / NCBI / UW vstup na Williams nebo Williams-Beuren syndrom
- Elastinový protein
- Mikrovlákno
Tento článek včlení text z United States National Library of Medicine, který je v veřejná doména.


