Sulfonamid - Sulfonamide

v chemie, sulfonamid funkční skupina (také hláskováno sulfonamid) je -S (= O)2-NH2, a sulfonyl skupina připojená k amin skupina. Relativně vzato je tato skupina nereaktivní. Aminové centrum již není základní. Vazba S-N se štěpí jen obtížně. Vzhledem k tuhosti funkční skupiny jsou sulfonamidy typicky krystalické. Z tohoto důvodu je tvorba sulfonamidu klasickou metodou pro přeměnu aminu na krystalický derivát, který lze identifikovat podle jeho teploty tání. Mnoho důležitých léků obsahuje sulfonamidovou skupinu.[1]
Sulfonamid (sloučenina) je sloučenina, která obsahuje tuto skupinu. Obecný vzorec je RSO2NH2, kde R je nějaká organická skupina. Například „methansulfonamid“ je CH3TAK2NH2. Jakýkoli sulfonamid lze považovat za odvozený od a kyselina sulfonová nahrazením a hydroxyl skupina s aminovou skupinou. v lék, termín "sulfonamid" se někdy používá jako synonymum pro droga sulfa, derivát nebo variace sulfanilamidu. První sulfonamid byl objeven v Německu v roce 1932.[2]
Syntéza
Sulfonamidy lze připravit v laboratoři mnoha způsoby. Klasický přístup s sebou nese reakci sulfonylchloridy s amin.
- RSO2Cl + R2NH → RSO2NR2 + HCl
Základna jako pyridin se obvykle přidává k absorpci generované HCl. Ilustrativní je syntéza sulfonylmethylamidu.[3] Snadno dostupným zdrojem sulfonylchloridu je tosylchlorid.[4] Reakce primárních a sekundárních aminů s benzensulfonylchlorid je základem Hinsbergova reakce, metoda detekce primárních a sekundárních aminů.
Sultamové
Sultamové jsou cyklické sulfonamidy. Bioaktivní sultamy zahrnují protizánětlivé látky ampiroxikam a antikonvulzivum sultiame. Sultamy se připravují analogicky k jiným sulfonamidům, což umožňuje skutečnost, že sulfonové kyseliny jsou deprotonovány aminy. Často se připravují oxidací disulfidů nebo thiolů vázaných na aminy v jedné nádobě.[5] Alternativní syntéza sultamů zahrnuje počáteční přípravu lineárního sulfonamidu, následovanou intramolekulární tvorbou vazby C-C (tj. Cyklizací), což je strategie, která byla použita při syntéze tmavomodrého emitoru na bázi sultamu pro organickou elektroniku.[6]
- Sloučeniny na bázi sulfonamidu

Sulfanilamid, sloučenina, která předznamenala vývoj sulfa drog
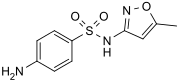
Sulfamethoxazol je široce používán antibiotikum.
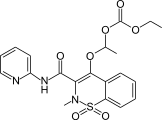
Ampiroxikam je sultam používaný jako protizánětlivý lék.

Hydrochlorothiazid je lék, který obsahuje jak acyklické, tak cyklické sulfonamidové skupiny.
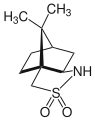
Camphorsultam je sultam používaný jako chirální pomocný v organické syntéze.
Sulfinamidy
Související sulfinamidy (R (S = O) NHR) jsou amidy sulfinové kyseliny (R (S = O) OH) (viz sulfinyl ). Chirál sulfinamidy, jako je terc-butansulfinamid p-toluensulfinamid[7][8] a 2,4,6-trimethylbenzensulfinamid[9] jsou relevantní pro asymetrická syntéza.
Disulfonimidy
Bis (trifluormethansulfonyl) anilin je zdrojem triflylu (CF3TAK2+) skupina.
The disulfonimidy jsou typu R-S (= O)2-N (H) -S (= O)2-R 'se dvěma sulfonylovými skupinami lemujícími amin.[10] Stejně jako u sulfinamidů se tato třída sloučenin používá jako katalyzátory při enantioselektivní syntéze.[10][11][12]
Viz také
Reference
- ^ Herec, P .; Chow, A. W .; Dutko, F. J .; McKinlay, M. A. "Chemotherapeutics". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a06_173.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Levy, Stuart B. (2002). Antibiotický paradox: jak zneužití antibiotik ničí jejich léčivé schopnosti (2. vyd.). Cambridge, Massachusetts: Perseus Publ. str. 51. ISBN 9780738204406.
- ^ Organické syntézy, Sb. Sv. 4, str. 943 (1963); Sv. 34, str. 96 (1954). Článek online
- ^ Organické syntézy, Sb. Sv. 5, str. 39 (1973); Sv. 48, str. 8 (1968) Článek online
- ^ Rassadin, V .; Grosheva, D .; Tomashevskii, A. Sokolov, V. „Methods of Sultam Synthesis“ Chemistry of Heterocyclic Compounds 2013, Vol. 49, str. 39-65. 27. doi:10.1007 / s10593-013-1231-3.
- ^ Virk, Tarunpreet Singh; Ilawe, Niranjan V .; Zhang, Guoxian; Yu, Craig P .; Wong, Bryan M .; Chan, Julian M. W. (2016). „Hetero [5] helicen na bázi sultamu: Vylepšení emisí vyvolaných syntézou, strukturou a krystalizací“. ACS Omega. 1: 1336–1342. doi:10.1021 / acsomega.6b00335. PMC 6640820. PMID 31457199.
- ^ Organic Syntheses, Coll. Sv. 10, s. 47 (2004); Sv. 77, str. 50 (2000). Odkaz
- ^ Org. Synth. 2007, 84, 129-138 Odkaz
- ^ Org. Synth. 2006, 83, 131-140 Odkaz
- ^ A b James, Thomas; van Gemmeren, Manuel; List, Benjamin (2015). "Vývoj a aplikace disulfonimidů v enantioselektivní organokatalýze". Chem. Rev. 115: 9388–9409. doi:10.1021 / acs.chemrev.5b00128.
- ^ Treskow, M .; Neudörfl, J .; Giernoth, R. (2009). „BINBAM - nový motiv silných a chirálních kyselin Brønstedových“. Eur. J. Org. Chem. 2009: 3693–3697. doi:10.1002 / ejoc.200900548.
- ^ García-García, P .; Lay, F .; García-García, P .; Rabalakos, C .; List, B. (2009). „Mocný chirální kontrapanionový motiv pro asymetrickou katalýzu“. Angew. Chem. Int. Vyd. 48: 4363–4366. doi:10.1002 / anie.200901768.





