Ximelagatran - Ximelagatran
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Exanta |
| Těhotenství kategorie |
|
| Trasy z správa | Orální (tablety ) |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Farmakokinetické data | |
| Biologická dostupnost | 20% |
| Metabolismus | melagatranu |
| Odstranění poločas rozpadu | 3–5 hodin |
| Vylučování | Renální (80%) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
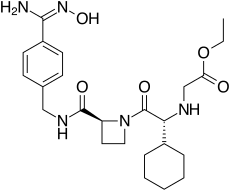
| Vzorec | C24H35N5Ó5 |
| Molární hmotnost | 473.574 g · mol−1 (429 g / mol po přeměně) |
| 3D model (JSmol ) | |
| |
| |
| | |
Ximelagatran (Exanta nebo Exarta, H 376/95) je antikoagulant který byl rozsáhle zkoumán jako náhrada za warfarin[1] to by překonalo problematické dietní, lékové interakce, a monitorování problémy spojené s terapií warfarinem. V roce 2006 jeho výrobce AstraZeneca po zprávách z roku 2006 oznámila, že stáhne nevyřízené žádosti o schválení marketingu hepatotoxicita (poškození jater) během pokusů a ukončete jeho distribuci v zemích, kde byla droga schválena (Německo, Portugalsko, Švédsko, Finsko, Norsko, Island, Rakousko, Dánsko, Francie, Švýcarsko, Argentina a Brazílie).[2]
Způsob akce
Ximelagatran, a přímý inhibitor trombinu,[3] byl prvním členem této třídy, který lze užívat ústně. Působí pouze tím, že inhibuje akce trombin. Užívá se orálně dvakrát denně a rychle se vstřebává tenké střevo. Ximelagatran je proléčivo, převádí se in vivo aktivní látce melagatran. Tato přeměna probíhá v játrech a mnoha dalších tkáních hydrolýza a dehydroxylace (výměna ethyl a hydroxyl skupiny s vodík ).

Použití
Očekává se, že Ximelagatran nahradí warfarin a někdy aspirin a heparin v mnoha terapeutických prostředích, včetně hluboká žilní trombóza, prevence sekundární žilní tromboembolismus a komplikace fibrilace síní například mrtvice. Účinnost ximelagatranu pro tyto indikace byla dobře zdokumentována,[4][5][6] s výjimkou nevalvulární fibrilace síní.
Výhodou podle raných zpráv jeho výrobce bylo, že jej bylo možné užívat perorálně bez sledování jeho antikoagulačních vlastností. Tím by se to odlišilo od warfarin a heparin, které vyžadují sledování mezinárodní normalizovaný poměr (INR) a částečný tromboplastinový čas (PTT). Nevýhodou uznanou brzy byla absence protijed v případě, že dojde k akutnímu krvácení, zatímco warfarin může být antagonizován koncentrát protrombinového komplexu a / nebo vitamin K. a heparin protamin sulfát.
Vedlejší efekty
Ximelagatran byl obecně dobře tolerován v pokusných populacích, ale u malého podílu (5–6%) se vyvinula zvýšená jaterní enzym úrovně, které vedly k FDA zamítnout původní žádost o schválení v roce 2004. Další vývoj byl zastaven v roce 2006 na základě zpráv o hepatotoxicitě. Následná analýza údajů klinické studie fáze 2 pomocí modelování extrémních hodnot (viz Teorie extrémní hodnoty ) ukázal, že zvýšené jaterní enzym bylo možné předvídat hladiny pozorované v klinických studiích fáze 3; kdyby to bylo v té době známo, mohlo by to ovlivnit rozhodnutí o budoucím vývoji sloučeniny.[7]
Chemicky odlišná, ale farmakologicky podobná látka, AZD-0837, byla vyvinuta společností Aztrazeneca pro podobné indikace.[2] Je to proléčivo silného, kompetitivního, reverzibilního inhibitoru volného a na fibrin vázaného trombinu ARH0637 [8]. Vývoj AZD-0837 byl ukončen. Z důvodu omezení zjištěného v dlouhodobé stabilitě léčivého přípravku s prodlouženým uvolňováním AZD-0837 byla v roce 2010 po 2 letech předčasně uzavřena kontrolní studie ASSURE o prevenci cévní mozkové příhody u pacientů s nevalvulární fibrilací síní. Proti warfarinu byla také numericky vyšší úmrtnost. [9][10][11] Ve studii Fáze 2 pro AF se průměrná koncentrace kreatininu v séru zvýšila přibližně o 10% od výchozí hodnoty u pacientů léčených AZD-0837, kteří se po ukončení léčby vrátili na výchozí hodnotu.[12]
Reference
- ^ Hirsh J, O'Donnell M, Eikelboom JW (červenec 2007). „Kromě nefrakcionovaného heparinu a warfarinu: současný a budoucí pokrok“. Oběh. 116 (5): 552–560. doi:10.1161 / CIRCULATIONAHA.106.685974. PMID 17664384.
- ^ A b „AstraZeneca se rozhodla stáhnout Exanta“ (Tisková zpráva). AstraZeneca. 14. února 2006. Citováno 2012-07-16.
- ^ Ho SJ, Brighton TA (2006). "Ximelagatran: přímý inhibitor trombinu". Vasc Health Risk Manag. 2 (1): 49–58. doi:10.2147 / vhrm.2006.2.1.49. PMC 1993972. PMID 17319469.
- ^ Eriksson, H; Wahlander K; Gustafsson D; Welin LT; Frison L; Schulman S; THRIVE vyšetřovatelé (leden 2003). „Randomizovaná, kontrolovaná studie zaměřená na dávku perorálního přímého inhibitoru trombinu ximelagatranu ve srovnání se standardní terapií pro léčbu akutní hluboké žilní trombózy: THRIVE I“. Journal of trombózy a hemostázy. 1 (1): 41–47. doi:10.1046 / j.1538-7836.2003.00034.x. PMID 12871538.
- ^ Francis CW, Berkowitz SD, Comp PC, Lieberman JR, Ginsberg JS, Paiement G, Peters GR, Roth AW, McElhattan J, Colwell CW Jr, EXULT A Study Group (říjen 2003). „Srovnání ximelagatranu s warfarinem k prevenci žilní tromboembolie po totální náhradě kolene“. New England Journal of Medicine. 349 (18): 1703–1712. doi:10.1056 / NEJMoa035162. PMID 14585938.
- ^ Schulman, S; Wåhlander K; Lundström T; Clason SB; Eriksson H; Vyšetřovatelé THRIVE III (říjen 2003). „Sekundární prevence žilní tromboembolie pomocí přímého perorálního inhibitoru trombinu ximelagatranu“. New England Journal of Medicine. 349 (18): 1713–1721. doi:10.1056 / NEJMoa030104. PMID 14585939.
- ^ Southworth, Harry (30. července 2014). „Predikce potenciální jaterní toxicity z údajů fáze 2: případová studie s ximelagatranem“. Statistika v medicíně. 33 (17): 2914–2923. doi:10,1002 / sim. 6142. PMID 24623062.
- ^ Ahrens, Ingo; Karlheinz Peter; Gregory Y.H. Ret; Christoph Bode (2012). „Vývoj a klinické aplikace nových orálních antikoagulancií. Část II. Drogy pod klinickým vyšetřováním“. Discovery Medicine. 13 (73): 445–450. PMID 22742650.
- ^ „AZD0837“. Astrazenecaclinicaltrials.com. Citováno 2012-10-16.
- ^ AstraZeneca Dlouhodobá léčba přímým perorálním inhibitorem trombinu AZD0837 ve srovnání s antagonisty vitaminu K, jako prevence cévní mozkové příhody u pacientů s nevalvulární fibrilací síní a jedním nebo více rizikovými faktory pro cévní mozkovou příhodu a systémové embolické příhody. Pětiletý kontrolní studijní kód D1250C0004221 leden 2010 Zkušební verze D1250C00042 Archivováno 10. listopadu 2013, v Wayback Machine
- ^ Eikelboom JW, Weitz JI (2010). „Aktualizace o antitrombotické terapii: nová antikoagulancia“. Oběh. 121 (13): 1523–32. doi:10.1161 / CIRCULATIONAHA.109.853119. PMID 20368532.
- ^ Lip GY, Rasmussen LH, Olsson SB, Jensen EC, Persson AL, Eriksson U, Wåhlander KF (prosinec 2009). „Orální přímý inhibitor trombinu AZD0837 pro prevenci cévní mozkové příhody a systémové embolie u pacientů s nevalvulární fibrilací síní: randomizovaná studie vedení, bezpečnosti a snášenlivosti čtyř dávek AZD0837 vs. antagonistů vitaminu K“. Eur. Srdce J. 30 (23): 2897–907. doi:10.1093 / eurheartj / ehp318. PMC 2785945. PMID 19690349.
