Tinzaparin sodný - Tinzaparin sodium
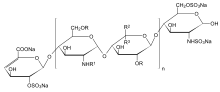 n = 1 až 25, R = H nebo SO3Na, R.1 = H, SO3Na nebo COCH3, R.2 = H a R3 = COONa nebo R2 = COONa a R3 = H | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | innohep (R) |
| AHFS /Drugs.com | Monografie |
| Trasy z správa | subkutánně (jednou denně) |
| ATC kód | |
| Farmakokinetické data | |
| Biologická dostupnost | 90% pro aktivitu Anti-Xa, 67% pro aktivitu Anti-IIa)[1] |
| Metabolismus | menší metabolizace v játrech desulfatací a / nebo depolymerací; vylučování ledvinami v téměř nezměněné formě |
| Odstranění poločas rozpadu | 200 min. pro aktivitu Anti-Xa, 257. min pro aktivitu Anti-IIa [2] |
| Identifikátory | |
| Číslo CAS |
|
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| Informační karta ECHA | 100.110.590 |
| Chemické a fyzikální údaje | |
| Molární hmotnost | 6500 g / mol (průměr)[3] |
| | |
Tinzaparin je antitrombotický droga v heparin skupina. Je to nízkomolekulární heparin (LMWH) prodáván jako Innohep celosvětově. Byl schválen US Food and Drug Administration (FDA) pro léčbu a profylaxi jednou denně hluboká žilní trombóza (DVT) a plicní embolie (PE).[4]
Může to být dáno subkutánně podle stříkačka nebo intravenózně.[5]Byl vyroben farmaceutickou společností Leo, která produkt stáhla z USA v roce 2011 kvůli nízkým prodejům a problémům s kontaminací.[6]
Použití u starších pacientů
V červenci 2008 společnost revidovala informace o předepisování, aby omezila užívání tinzaparinu u pacientů ve věku 90 let nebo starších. FDA je znepokojen tím, že předběžné údaje ze studie IRIS naznačují, že zvýšené riziko úmrtnosti se neomezuje pouze na pacienty ve věku 90 let nebo starší.
Podle studie Innohep zvyšuje riziko úmrtí u starších pacientů (tj. Ve věku 70 let a starších) s chronické onemocnění ledvin. Zdravotničtí pracovníci by měli zvážit použití alternativní léčby přípravkem Innohep při léčbě starších pacientů starších 70 let s chronickým onemocněním ledvin a hluboká žilní trombóza, plicní embolie, nebo oboje.
Použití v těhotenství
Žádný LMWH, s výjimkou tinzaparinu, nemá licenci pro použití v gestační hyperkoagulabilita.[7] Tinzaparin je u těhotných žen často volbou LMWH.[7]
Vedlejší efekty
Krvácení při předávkování. V místě vpichu se občas objeví modřiny.
Monitorování
Tinzaparin ano ne ovlivňují mezinárodní normalizovaný poměr (INR), protrombinový čas (PT).[Citace je zapotřebí ] Lze měřit hladiny anti-faktoru Xa a často se používají ke sledování tinzaparinu.
Reverzní agent
Protamin sulfát zvrátí Tinzaparin o 85% na příbalový leták.
Reference
- ^ Cheer S.M. et al. Drugs 2004; 64 (13): 1479–1502
- ^ Pedersen P.C. et al. Thromb Res 1991; 61 (5-6): 477-487
- ^ Evropský lékopis, 6. vydání, 2008
- ^ Hull a kol. NEJM 1992; 326,15: 975-982
- ^ Farmaceutiska Specialiteter i Sverige - švédský oficiální katalog léků. Fass.se > Innohep
- ^ „Seznam nedostatků drog“.
- ^ A b „Archivovaná kopie“. Archivovány od originál dne 12. června 2010. Citováno 15. května 2010.CS1 maint: archivovaná kopie jako titul (odkaz) Terapeutická antikoagulace v těhotenství. Norfolk and Norwich University Hospital (NHS Trust). Referenční číslo CA3017. 9. června 2006 [recenze červen 2009]
- (22) ESHRE duben-2011, svazek 33 stran 12–13-14
- e-medicína 2011
- RCOG březen-2010 (Royal College for Obestetric and Gynecology)
- DVT.org/cardiologist
- Hull, New England Journal of Medicine, 2010, svazek 22, strana 19
externí odkazy
- tinzaparin v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Sprigg N, Gray LJ, Bath PM a kol. (2007). „Včasné zotavení a funkční výsledek souvisí s podtypem kauzální cévní mozkové příhody: údaje z tinzaparinu ve studii akutní ischemické cévní mozkové příhody“. Journal of Stroke and Cerebrovascular Diseases. 16 (4): 180–4. doi:10.1016 / j.jstrokecerebrovasdis.2007.02.003. PMID 17689415.
