Tetrazol - Tetrazole
| |||
| Identifikátory | |||
|---|---|---|---|
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.005.477 | ||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CH2N4 | |||
| Molární hmotnost | 70,05 g / mol | ||
| Hustota | 1,477 g / ml | ||
| Bod tání | 157 až 158 ° C (315 až 316 ° F; 430 až 431 K)[2] | ||
| Bod varu | 220 ± 23 ° C (428 ± 41 ° F; 493 ± 23 K) | ||
| Kyselost (strK.A) | 4.90 [1] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Tetrazoly jsou třídou syntetický organický heterocyklická sloučenina, skládající se z pětičlenného čtyřčlenného kruhu dusík atomy a jeden uhlík atom. Název tetrazol také odkazuje na mateřskou sloučeninu vzorce CH2N4, z nichž lze formulovat tři izomery.
Struktura a lepení
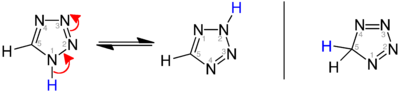
Existují tři izomery původního tetrazolu, které se liší polohou dvojných vazeb: 1H-, 2H- a 5H-tetrazol. 1H- a 2H- izomery jsou tautomery, s rovnováhou ležící na straně 1H-tetrazol v pevné fázi.[3][4][5] V plynné fázi 2H- dominuje tetrazol.[4][6][7] Tyto izomery lze považovat za aromatický, s 6 π-elektrony, zatímco 5H-izomer je nearomatický.
Syntéza
1H-Tetrazol byl nejprve připraven reakcí bezvodého kyselina hydrazoová a kyanovodík pod tlakem. Zpracování organických nitrily s azid sodný v přítomnosti jód nebo na bázi oxidu křemičitého hydrogensíran sodný jako heterogenní katalyzátor umožňuje výhodnou syntézu 5-substituovaného 1H-tetrazoly. Další metodou je deaminace 5-aminotetrazol, které lze komerčně získat nebo připravit střídavě z aminoguanidin.[8][9]
2-aryl-2H-tetrazoly jsou syntetizovány pomocí [3 + 2] cykloadice reakce mezi arylem diazonium a trimethylsilyldiazomethan.[10]
Použití
Existuje několik farmaceutických látek, kterými jsou tetrazoly. Tetrazoly mohou působit jako bioisosteres pro karboxylátové skupiny protože mají podobné pKa a jsou deprotonovány při fyziologickém pH. Angiotensin II blokátory receptorů - jako např losartan a kandesartan Často jsou tetrazoly. Známým tetrazolem je dimethylthiazolyldifenyl tetrazoliumbromid (MTT). Tento tetrazol se používá v MTT test vyčíslit respirační aktivita živých buněk kultura, i když obecně zabíjí buňky v procesu. Některé tetrazoly lze také použít v testech DNA.[11] Studie naznačují, že VT-1161 a VT-1129 jsou potenciální silná antifungální léčiva, protože narušují enzymatické funkce hub, ale ne lidské enzymy.[12][13]
Nějaký tetrazol deriváty s vysokou energií byly zkoumány jako vysoký výkon výbušniny jako náhrada za TNT a také pro použití ve vysokém výkonu tuhý raketový pohon formulace.[14][15] Mezi ně patří azidotetrazolát soli dusíkatých bází.
Jiné tetrazoly se používají pro své výbušné nebo spalitelné vlastnosti, jako je samotný tetrazol a 5-aminotetrazol, které se někdy používají jako součást plynové generátory v automobil airbagy. Energetické materiály na bázi tetrazolu produkují vysokoteplotní netoxické reakční produkty, jako je voda a plynný dusík,[16] a mají vysokou rychlost hoření a relativní stabilitu,[17] to vše jsou žádoucí vlastnosti. Energie delokalizace v tetrazolu je 209 kJ / mol.
1H-Tetrazol a 5- (benzylthio) -1H-tetrazol (BTT) jsou široce používány jako kyselé aktivátory kopulační reakce v syntéza oligonukleotidů.[18]
Související heterocykly
- Triazoly, analogy se třemi atomy dusíku
- Pentazol, analog s pěti atomy dusíku (přísně vzato, anorganický homocyklus, nikoli heterocyklus)
- Oxatetrazol
- Thiatetrazol
Reference
- ^ Satchell, Jacqueline F .; Smith, Brian J. (2002). „Výpočet vodných disociačních konstant 1,2,4-triazolu a tetrazolu: Porovnání solvatačních modelů“. Phys. Chem. Chem. Phys. 4 (18): 4314–4318. Bibcode:2002PCCP .... 4.4314S. doi:10.1039 / b203118c.
- ^ Mihina, Joseph S .; Herbst, Robert M. (1950). „Reakce nitrilů s kyselinou hydrazoovou: syntéza monosubstituovaných tetrazolů“. J. Org. Chem. 15 (5): 1082–1092. doi:10.1021 / jo01151a027.
- ^ Goddard, R .; Heinemann, O .; Krüger, C. (1997-05-15). „α-1H-1,2,3,4-tetrazol“. Acta Crystallographica oddíl C. 53 (5): 590–592. doi:10.1107 / S0108270197000772. ISSN 0108-2701.
- ^ A b Kiselev, Vitaly G .; Cheblakov, Pavel B .; Gritsan, Nina P. (10.03.2011). „Tautomerismus a tepelný rozklad tetrazolu: studie na vysoké úrovni ab Initio“. The Journal of Physical Chemistry A. 115 (9): 1743–1753. doi:10.1021 / jp112374t. ISSN 1089-5639.
- ^ Razynska, A .; Tempczyk, A .; Malinski, E .; Szafranek, J .; Grzonka, Z .; Hermann, P .: v J. Chem. Soc. Perkin Trans. 2 1983, 379.
- ^ Wong, Ming Wah; Leung-Toung, Regis; Wentrup, Curt (1993-03-01). „Tautomerní rovnováha a vodíkové posuny tetrazolu v plynné fázi a v roztoku“. Journal of the American Chemical Society. 115 (6): 2465–2472. doi:10.1021 / ja00059a048. ISSN 0002-7863.
- ^ Rażyńska, Anna; Tempczyk, Anna; Maliński, Edmund; Szafranek, Janusz; Grzonka, Zbigniew; Hermann, Peter (01.01.1983). „Aplikace hmotnostní spektrometrie ke studiu prototropních rovnováh v 5-substituovaných tetrazolech v plynné fázi; experimentální důkazy a teoretické úvahy“. Journal of the Chemical Society, Perkin Transactions 2 (3): 379–383. doi:10.1039 / P29830000379. ISSN 1364-5471.
- ^ Henry, Ronald A .; Finnegan, William G. (01.01.1954). „Vylepšený postup pro odminování 5-aminotetrazolu“. Journal of the American Chemical Society. 76 (1): 290–291. doi:10.1021 / ja01630a086. ISSN 0002-7863.
- ^ Kurzer, F .; Godfrey, L. E. A. (1963). "Syntéza heterocyklických sloučenin z aminoguanidinu". Angewandte Chemie International Edition v angličtině. 2 (8): 459–476. doi:10,1002 / anie.196304591. ISSN 1521-3773.
- ^ Patouret, Remi; Kamenecka, Theodore M. (04.04.2016). „Syntéza 2-aryl-2H-tetrazolů prostřednictvím regioselektivní [3 + 2] cykloadiční reakce“. Čtyřstěn dopisy. 57 (14): 1597–1599. doi:10.1016 / j.tetlet.2016.02.02.102. PMC 4810784. PMID 27041776.
- ^ S Berner; K Mühlegger & H Seliger (11. února 1989). „Studie o roli tetrazolu v aktivaci fosforamiditů“. Nucleic Acids Res. 17 (3): 853–864. doi:10.1093 / nar / 17.3.853. PMC 331708. PMID 2922273.
- ^ Warrilow, A. G. S .; Hull, C. M.; Parker, J. E .; Garvey, E. P .; Hoekstra, W. J .; Moore, W. R .; Schotzinger, R. J .; Kelly, D. E.; Kelly, S. L. (prosinec 2014). „Klinický kandidát VT-1161 je vysoce účinným inhibitorem CYP51 Candida albicans, ale nedokáže vázat lidský enzym.“. Antimikrobiální látky a chemoterapie. 58 (12): 7121–7127. doi:10.1128 / AAC.03707-14. PMC 4249504. PMID 25224009.
- ^ Lockhart, Shawn R .; Fothergill, Annette W .; Iqbal, Naureen; Bolden, Carol B .; Grossman, Nina T .; Garvey, Edward P .; Brand, Stephen R .; Hoekstra, William J .; Schotzinger, Robert J .; Ottinger, Elizabeth; Patterson, Thomas F .; Wiederhold, Nathan P. (duben 2016). „Vyšetřovací houbový inhibitor Cyp51 VT-1129 prokazuje silnou aktivitu proti Cryptococcus neoformans a Cryptococcus gattii“. Antimikrobiální látky a chemoterapie. 60 (4): 2528–2531. doi:10.1128 / AAC.02770-15. PMC 4808209. PMID 26787697.
- ^ „Zelenější výbušniny ukazují slib“. Chemický svět. 2. října 2008.
- ^ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke a Jörg Stierstorfer (duben 2010). „Nové energetické materiály obsahující tetrazoly a nitraminy - syntéza, charakterizace a vlastnosti“. Zeitschrift für Anorganische und Allgemeine Chemie. 636 (5): 735–749. doi:10.1002 / zaac.200900521.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Tore Brinck, Thomas M. Klapötke a Jörg Stierstorfer (2014). „Energetické tetrazol-N-oxidy“. Energetické tetrazol-N-oxidy. Zelené energetické materiály. 133–178. doi:10.1002 / 9781118676448.ch06. ISBN 9781118676448.
- ^ Nicholas Piekiel & Michael R. Zachariah (2012). "Rozklad energetických materiálů na bázi aminotetrazolu za podmínek vysoké rychlosti ohřevu". J. Phys. Chem. A. 116 (6): 1519–1526. Bibcode:2012JPCA..116.1519P. doi:10.1021 / jp203957t. PMID 22214278.
- ^ Xia Wei (6. května 2013). "Spojovací aktivátory pro syntézu oligonukleotidů pomocí fosforamiditového přístupu". Čtyřstěn. 69 (18): 3615–3637. doi:10.1016 / j.tet.2013.03.001.



