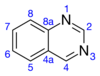
Chinazolin - Quinazoline
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Chinazolin | |||
| Ostatní jména 1,3-diazanaftalen benzopyrimidin fenmiazin benzo-1,3-diazin | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.005.424 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C8H6N2 | |||
| Molární hmotnost | 130.150 g · mol−1 | ||
| Vzhled | světle žluté krystaly | ||
| Hustota | 1,351 g / cm3, pevný | ||
| Bod tání | 48 ° C (118 ° F; 321 K) | ||
| Bod varu | 243 ° C (469 ° F; 516 K) | ||
| Rozpustný | |||
| Kyselost (strK.A) | 3.51[1] | ||
| Struktura | |||
| 2.2 D[2] | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Dráždivý | ||
| Bezpečnostní list | Externí bezpečnostní list | ||
| S-věty (zastaralý) | S24 S25 | ||
| Bod vzplanutí | 106 ° C (223 ° F; 379 K) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Chinazolin je organická sloučenina se vzorcem C.8H6N2. Je to aromatický heterocyklus s bicyklickou strukturou skládající se ze dvou kondenzovaných šestičlenných aromatických kruhů, a benzen prsten a pyrimidin prsten. Je to světle žlutá krystalická pevná látka, která je rozpustná ve vodě. Chinazolin, známý také jako 1,3-diazanaftalen, získal své jméno podle toho, že je aza derivát chinolin. Ačkoli je mateřská chinazolinová molekula sama v technické literatuře zmiňována jen zřídka, substituované deriváty byly syntetizovány pro léčebné účely, jako jsou antimalarika a protirakovinné látky. Chinazolin je planární molekula. to je izomerní s ostatními diazanaftaleny z benzodiazin podskupina: cinnoline, chinoxalin, a ftalazin. Více než 200 biologicky aktivních chinazolinu a chinolinové alkaloidy jsou identifikovány.[3][4]
Syntéza
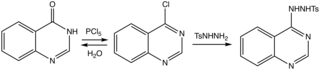 Příprava 4-chlorchinazolinu a jeho tosylhydrazidu.
Příprava 4-chlorchinazolinu a jeho tosylhydrazidu.
Syntéza chinazolinu byla poprvé uvedena v roce 1895 autorem August Bischler a Lang přes dekarboxylace 2-karboxyderivátu (chinazolin-2-karboxylová kyselina).[5] V roce 1903 Siegmund Gabriel uvádí syntézu původního chinazolinu z Ó-nitrobenzylamin, který byl redukován jodovodíkem a červeným fosforem na 2-aminobenzylamin. Redukovaný meziprodukt kondenzuje s kyselinou mravenčí, čímž se získá dihydrochinazolin, který se oxiduje na chinazolin.[6]
Metody byly přezkoumány.[7] Účinná cesta k mateřskému heterocyklu probíhá prostřednictvím 4-chlor derivátu k tosylhydrazidu, který je odstraněn bází.[8]
Reakce
Hydratační a adiční reakce
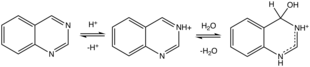 Hydratace chinazolinia.
Hydratace chinazolinia.
Chinazolin protonuje (a methyláty) na N3. Protonace indukuje hydrataci. Mnoho mírně kyselých substrátů se přidává přes vazbu C = N3, mezi ně patří kyanovodík, hydrogensiřičitan sodný a methylketony.[9]
Hydrolýza
V teplém roztoku chinazolin hydrolyzuje za kyselých a alkalických podmínek na 2-aminobenzaldehyd (nebo produkty jeho vlastní kondenzace) a kyselina mravenčí a amoniak / amonium.[2]
Elektrofilní a nukleofilní substituce
Pyrimidinový kruh odolává elektrofilní substituci, i když poloha 4 je reaktivnější než poloha 2. Ve srovnání s tím je benzenový kruh náchylnější k elektrofilní substituci. Pořadí reaktivity v poloze kruhu je 8> 6> 5> 7. 2- a 4-halogenové deriváty chinazolinu podléhají vytěsnění nukleofily, jako je piperidin.[2]
Biologický a farmakologický význam
Gefitinib
V květnu 2003 americký úřad pro kontrolu potravin a léčiv (FDA) schválil chinazolin gefitinib. Droga, kterou vyrábí AstraZeneca, je inhibitorem protein kináza z receptor epidermálního růstového faktoru (EGFR). Váže se na ATP-vazebné místo EGFR, čímž deaktivuje antiapoptotická kaskáda přenosu signálu Ras prevence dalšího růstu rakovinných buněk.[10][11][12]
Lapatinib
V březnu 2007 GlaxoSmithKline je droga lapatinib byl schválen americkým FDA k léčbě pokročilého nebo metastatického karcinomu prsu v kombinaci s Roche je kapecitabin. Lapatinib eliminuje růst kmenových buněk rakoviny prsu, které způsobují růst nádorů. Vazba lapatinibu na vazebné místo ATP v EGFR a receptor lidského epidermálního růstového faktoru 2 (HER2) proteinkinázové domény inhibují aktivaci signálního mechanismu (prostřednictvím reverzibilní, kompetitivní inhibice).[13][14][15][16]
Erlotinib
V květnu 2013 erlotinib, lék vyráběný společností Astellas, byl schválen americkým FDA k léčbě pacientů s NSCLC s nádory způsobenými mutacemi EGFR. Vazba erlotinibu na ATP-vazebná místa receptorů EGFR brání EGFR v produkci fosfotyrosinových zbytků (kvůli kompetitivní inhibici), což činí receptor neschopným generovat signální kaskády na podporu buněčného růstu.[17][18]
Afatinib
V červenci 2013 americký FDA schválil afatinib, lék vyvinutý společností Boehringer Ingelheim jako ireverzibilní, kompetitivní inhibitor HER2 a EGFR kináz. Zatímco afatinib vykazuje podobný mechanismus jako laptinib, ve kterém působí jako ireverzibilní inhibitor HER2 a EGFR, afatinib také prokázal aktivitu proti tyrosin kinázám, které se staly rezistentními vůči gefinitibu a erlotinibu.[19]
- Léky obsahující chinazolin

Gefitinib pro léčbu nemalobuněčný karcinom plic.

Lapatinib k léčbě pokročilého stadia nebo metastatického karcinomu prsu.

Erlotinib, protinádorové činidlo.

Afatinib k léčbě rakovin rezistentních na gefinitib a erlotinib.
Viz také
Reference
- ^ Armarego, W. L. F. (1963). "Chinazoliny". Pokroky v heterocyklické chemii, svazek 1. Pokroky v heterocyklické chemii. 1. 253–309. doi:10.1016 / S0065-2725 (08) 60527-9. ISBN 9780120206018. PMID 14087221.
- ^ A b C Büchel, K. H., ed. Methods of Organic Chemistry (Houben-Weyl): Additional and Supplementary Volumes to the 4th Edition. New York: Georg Thieme Verlag Stuttgart, 2001.
- ^ Shang, XF; Morris-Natschke, SL; Liu, YQ; Guo, X; Xu, XS; Goto, M; Li, JC; Yang, GZ; Lee, KH (květen 2018). "Biologicky aktivní chinolin a chinazolinové alkaloidy část I." Recenze lékařského výzkumu. 38 (3): 775–828. doi:10,1002 / med.21466. PMC 6421866. PMID 28902434.
- ^ Shang, Xiao-Fei; Morris-Natschke, Susan L .; Yang, Guan-Zhou; Liu, Ying-Qian; Guo, Xiao; Xu, Xiao-Shan; Goto, Masuo; Li, Jun-Cai; Zhang, Ji-Yu; Lee, Kuo-Hsiung (září 2018). "Biologicky aktivní chinolin a chinazolinové alkaloidy část II". Recenze lékařského výzkumu. 38 (5): 1614–1660. doi:10,1002 / med.21492. ISSN 0198-6325. PMC 6105521. PMID 29485730.
- ^ Asif, M. Chemické vlastnosti, syntetické metody a biologický potenciál chinazolinu a chinazolinonových derivátů, International Journal of Medicinal Chemistry, ID článku 395637, 2014. doi:10.1155/2014/395637
- ^ Morgan, G.T., vyd. Abstrakt příspěvků. Journal of the Chemical Society. London: Gurney & Jackson, 1904. Tisk.
- ^ Connolly, David J .; Cusack, Declan; O'Sullivan, Timothy P .; Guiry, Patrick J. (2005). "Syntéza chinazolinonů a chinazolinů". Čtyřstěn. 61 (43): 10153–10202. doi:10.1016 / j.tet.2005.07.010.
- ^ W. L. F. Armarego (1967). "Halogenochinazoliny". V W. L. F. Armarego (ed.). Chemistry of Heterocyclic Compounds. str. 11–38. doi:10.1002 / 9780470186916.ch7. ISBN 9780470186916.
- ^ W. L. F. Armarego (1967). „Chinazolin“. V W. L. F. Armarego (ed.). Chemistry of Heterocyclic Compounds. str. 11–38. doi:10.1002 / 9780470186916.ch2. ISBN 9780470186916.
- ^ „Iressa (Gefitinib)“ (PDF). US Food and Drug Administration. 2. května 2003.
- ^ Lynch, Thomas J .; Bell, Daphne W .; Sordella, Raffaella; Gurubhagavatula, Sarada; Okimoto, Ross A .; Brannigan, Brain W .; Harris, Patricia L .; Haserlat, Sara M .; Supko, Jeffrey G .; Haluska, Frank G .; Louis, David N .; Christiani, David C .; Settleman, Jeff; Haber, Daniel A (20. května 2004). „Aktivace mutací v receptoru epidermálního růstového faktoru, která je základem reakce nemalobuněčného karcinomu plic na gefitinib“ (PDF). NEJM. 350 (21): 2129–39. doi:10.1056 / nejmoa040938. PMID 15118073.
- ^ Takimoto CH, Calvo E. "Principy onkologické farmakoterapie" v Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Management rakoviny: Multidisciplinární přístup. 11 vyd. 2008.
- ^ "Lapatinib". US Food and Drug Administration. 13. března 2007.
- ^ Wood ER, Truesdale AT, McDonald OB, Yuan D, Hassell A, Dickerson SH, Ellis B, Pennisi C a kol. (2004). „Jedinečná struktura receptoru epidermálního růstového faktoru vázaného na GW572016 (Lapatinib): vztahy mezi konformací proteinu, rychlostí inhibitoru a aktivitou receptoru v nádorových buňkách“. Výzkum rakoviny. 64 (18): 6652–9. doi:10.1158 / 0008-5472.CAN-04-1168. PMID 15374980.
- ^ Rodriguez, A. (Duben 2008). Nový typ léku významně zmenšuje primární nádory prsu za pouhých šest týdnů; výzkum poskytuje vede k novému cíli v léčbě rakoviny - rakovinové kmenové buňky. Archivovány od originál dne 26. 11. 2008.
- ^ Nelson MH, Dolder CR (únor 2006). „Lapatinib: nový duální inhibitor tyrosinkinázy s aktivitou v pevných nádorech“. Ann Pharmacother. 40 (2): 261–9. doi:10,1345 / aph. 1G387. PMID 16418322. S2CID 21622641.
- ^ "Erlotinib". US Food and Drug Administration. 14. května 2013.
- ^ Raymond E, Faivre S, Armand J (2000). "Epidermální růstový faktor receptor tyrosinkináza jako cíl pro protinádorovou terapii". Drogy. 60 Suppl 1: 15–23, diskuse 41–2. doi:10.2165/00003495-200060001-00002. PMID 11129168. S2CID 10555942.
- ^ "Afatinib". US Food and Drug Administration. 12. července 2013.








