Vkládací reakce - Insertion reaction
An inzerční reakce je chemická reakce kde jedna chemická entita (a molekula nebo molekulární fragment) se vloží do existujícího pouto typicky druhé chemické entity např.:
- A + PŘED NAŠÍM LETOPOČTEM → B–A-C
Termín se vztahuje pouze na výsledek reakce a nenavrhuje mechanismus. Inzerční reakce jsou pozorovány v organický, anorganické, a organokovový chemie. V případech, kdyligand vazba v a koordinační komplex je zapojen, jsou tyto reakce obvykle organokovové povahy a zahrnují vazbu mezi a přechodový kov a a uhlík nebo vodík.[1] Obvykle je vyhrazeno pro případ, kdy koordinační číslo a oxidační stav kovu zůstávají nezměněny.[2] Když jsou tyto reakce reverzibilní, odstranění malé molekuly z vazby kov-ligand se nazývá vytlačování nebo eliminace.
(A)
(b)
Existují dvě běžné geometrie vložení - 1,1 a 1,2 (na obrázku výše). Inzerující molekula může dále působit buď jako a nukleofil nebo jako elektrofil do komplexu kovů.[2] Tato chování budou podrobněji popsána pro CO, nukleofilní chování a TAK2, elektrofilní chování.
Organická chemie
Homologační reakce jako Homologace esteru Kowalski[3] poskytnout jednoduché příklady procesu inzerce v organické syntéze. V Arndt-Eistertova reakce,[4][5] A methylenová jednotka je vložen do karboxyl -uhlíková vazba karboxylová kyselina za vzniku další kyseliny v homologní série. Organické syntézy poskytuje příklad t-BOC chráněno (S)-fenylalanin (2-amino-3-fenylpropanová kyselina) reaguje postupně s triethylamin, ethylchlorformiát, a diazomethan vyrábět α-diazoketon, který potom reaguje s trifluoracetátem stříbrným / triethylaminem ve vodném roztoku za vzniku t-BOC chráněná forma (S) -3-amino-4-fenylbutanová kyselina.[6]
Mechanicky,[7] α-diazoketon prochází a Wolff přesmyk[8][9] vytvořit a keten v 1,2-přeskupení. V důsledku toho je methylenovou skupinou a- ke karboxylové skupině v produktu methylenová skupina z diazomethanového činidla. Ukázalo se, že 1,2-přesmyk zachovává stereochemii chirálního centra, když se produkt vytvoří t-BOC chráněno (S) -fenylalanin si zachovává (S) stereochemie s hlášenou enantiomerní přebytek alespoň 99%.[6]
Související transformace je Nierensteinova reakce ve kterém je diazomethanmethylenová skupina vložena do vazby uhlík-chlor skupiny chlorid kyseliny za vzniku a-chlormethylketonu.[10][11] Příklad publikovaný v roce 1924 ilustruje reakci v substituovaném stavu benzoylchlorid Systém:[12]
Možná překvapivě, a-bromacetofenon je vedlejší produkt, pokud se tato reakce provádí s benzoylbromid, a dimerní dioxan být hlavním produktem.[13] Organické azidy také poskytnout příklad inzerční reakce v organické syntéze a stejně jako výše uvedené příklady transformace probíhají se ztrátou plynný dusík. Když tosylazid reaguje s norbornadiene, a rozšíření kruhu probíhá reakce, při které je atom dusíku vložen do vazby uhlík-uhlík α- k hlavě můstku:[14]
The Beckmann přesmyk[15][16] je dalším příkladem reakce rozšiřující kruh, ve které je heteroatom vložen do vazby uhlík-uhlík. Nejdůležitější aplikací této reakce je přeměna cyklohexanon na jeho oxim, který se poté přeskupí za kyselých podmínek, aby poskytl ε-kaprolaktam,[17] surovina pro výrobu Nylon 6. Roční produkce kaprolaktamu přesahuje 2 miliardy kilogramů.[18]
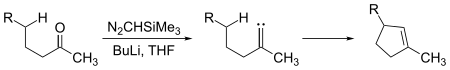
Karbeny podstoupit obojí mezimolekulární a intramolekulární inzerční reakce. Cyklopenten skupiny mohou být generovány z dostatečně dlouhého řetězce ketony reakcí s trimethylsilyldiazomethan, (CH3)3Si – CHN2:
Zde se karbenový meziprodukt vloží do vazby uhlík-vodík a vytvoří vazbu uhlík-uhlík potřebnou k uzavření cyklopentenového kruhu. Inzerce karbenu do vazeb uhlík-vodík může také nastat intermolekulárně:
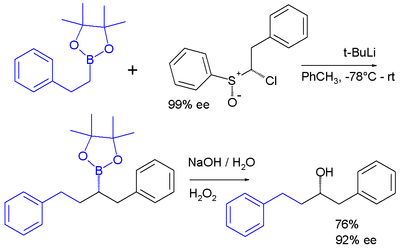
Karbenoidy jsou reaktivní meziprodukty které se chovají podobně jako karbeny.[19] Jedním příkladem je připravené chloralkylithium karbenoidové činidlo in situ od a sulfoxid a t-BuLi který se vloží do vazby uhlík-bór a pinakol boronový ester:[20]
Organokovová chemie
Mnoho reakcí v organokovové chemii zahrnuje inzerci jednoho ligandu (L) do vazby kov-hydrid nebo kov-alkyl / aryl. Obecně je to hydridová, alkylová nebo arylová skupina, která migruje na L, což je často CO, alken nebo alkyn.
Karbonylace
Inzerce oxidu uhelnatého a alkenů do vazeb kov-uhlík je široce využívanou reakcí s hlavními průmyslovými aplikacemi.[21][22]

Takové reakce podléhají obvyklým parametrům, které ovlivňují jiné reakce v koordinační chemii, ale sterické účinky jsou zvláště důležité při určování stereochemie a regiochemie reakcí. Reverzní reakce, de-inzerce CO a alkenů, má zásadní význam také v mnoha katalytických cyklech.
Široce využívané aplikace migrační inzerce karbonylových skupin jsou hydroformylace a karbonylativní produkce kyseliny octové. První z nich přeměňuje alkeny, vodík a oxid uhelnatý na aldehydy. Výroba kyseliny octové karbonylací probíhá dvěma podobnými průmyslovými procesy. Tradičnější je rhodium Proces kyseliny Monsanto octové, ale tento proces byl nahrazen iridiovým základem Proces Cativa.[23][24] Do roku 2002 činila celosvětová roční produkce kyseliny octové 6 milionů tun, z čehož přibližně 60% je vyrobeno procesem Cativa.[23]
Proces Cativa katalytický cyklus, zobrazené výše, zahrnuje kroky vložení i odebrání. Oxidační adiční reakce methyljodid s (1) zahrnuje formální vložení centra iridia (I) do vazby uhlík-jod, zatímco krok (3) do (4) je příkladem migračního zavádění oxidu uhelnatého do vazby iridium-uhlík. Aktivní druh katalyzátoru je regenerován redukční eliminace z acetyljodid z (4), de-inzerční reakce.[23]
Zavádění olefinů
Vložení ethylenu a propylenu do titanalkylů je základním kamenem Ziegler-Nattaova katalýza, komerční cesta z polyethylenu a polypropylenu. Tato technologie zahrnuje hlavně heterogenní katalyzátory, ale široce se předpokládá, že principy a pozorování homogenních systémů jsou použitelné pro polovodičové verze. Mezi související technologie patří Proces vyšších olefinů který vyrábí čisticí prostředek prekurzory.[25] olefin může být koordinován s kovem před zavedením. V závislosti na hustotě ligandu kovu může být nezbytná disociace ligandu, aby se zajistilo koordinační místo pro olefin.[26]

Další inzerční reakce v koordinační chemii
Mnoho elektrofilních oxidů se vloží do vazeb kov-uhlík; tyto zahrnují oxid siřičitý, oxid uhličitý a oxid dusnatý. Tyto reakce mají omezený praktický význam, ale mají historický význam. S alkyly přechodových kovů se tyto oxidy chovají jako elektrofily a vkládají se do vazby mezi kovy a jejich relativně nukleofilními alkylovými ligandy. Jak je uvedeno v článku o Kovové komplexy oxidu siřičitého, vložení SO2 byl podrobně zkoumán.
Více inzerčních reakcí v organické chemii
Elektropozitivní kovy, jako je sodík, draslík, hořčík, zinek atd., Se mohou vložit do alkylhalogenidů, rozbít uhlík-halogenidovou vazbu (halogenid může být chlor, brom, jod) a vytvořit vazbu uhlík-kov. Tato reakce probíhá prostřednictvím a Mechanismus SET (mechanismus přenosu jednoho elektronu). Pokud hořčík reaguje s alkylhalogenidem, tvoří a Grignardovo činidlo, nebo pokud lithium reaguje, an organolithné činidlo je vytvořen. Tento typ inzerčních reakcí má tedy důležité aplikace v chemická syntéza.

Reference
- ^ Douglas, McDaniel a Alexander (1994). Koncepty a modely anorganické chemie 3. vyd. John Wiley & Sons, Inc. ISBN 978-0-471-62978-8.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b J.J. Alexander (1985). Hartley a Patai (ed.). Chemie vazby kov-uhlík, sv. 2. John Wiley & Sons.
- ^ Reddy, R.E .; Kowalski, C. J. (1993). „Ethyl 1-naftylacetát: Esterová homologace pomocí ynolátových aniontů“. Organické syntézy. 71: 146.; Kolektivní objem, 9, str. 426
- ^ Arndt, F.; Eistert, B. (1935). „Ein Verfahren zur Überführung von Carbonsäuren in ihre höheren Homologen bzw. deren Derivate“. Ber. Dtsch. Chem. Ges. (v němčině). 68 (1): 200–208. doi:10,1002 / cber.1950680142.
- ^ Dosud.; McKervey, M. A. (1994). "Organická syntéza s α-diazykarbonylovými sloučeninami". Chem. Rev. 94 (4): 1091–1160. doi:10.1021 / cr00028a010.
- ^ A b Linder, M. R.; Steurer, S .; Podlech, J. (2002). "(S)-3-(tert-Butyloxykarbonylamino) -4-fenylbutanová kyselina ". Organické syntézy. 79: 154.; Kolektivní objem, 10, str. 194
- ^ Huggett, C .; Arnold, R. T .; Taylor, T. I. (1942). „Mechanismus reakce Arndt-Eistert“. J. Am. Chem. Soc. 64 (12): 3043. doi:10.1021 / ja01264a505.
- ^ Meier, H .; Zeller, K.-P. (1975). „Wolffův přesmyk α-diazykarbonylových sloučenin“. Angew. Chem. Int. Vyd. 14 (1): 32–43. doi:10,1002 / anie.197500321.
- ^ Kirmse, W. (2002). „100 let Wolffova přesmyku“. Eur. J. Org. Chem. 2002 (14): 2193–2256. doi:10.1002 / 1099-0690 (200207) 2002: 14 <2193 :: AID-EJOC2193> 3.0.CO; 2-D.
- ^ Clibbens, D. A .; Nierenstein, M. (1915). „Působení diazomethanu na některé aromatické acylchloridy“. J. Chem. Soc., Trans. 107: 1491–1494. doi:10.1039 / CT9150701491.
- ^ Bachmann, W. E.; Struve, W. S. (1942). „Arndt-Eistertova reakce“. Org. Reagovat. 1: 38.
- ^ Nierenstein, M .; Wang, D. G .; Warr, J. C. (1924). „Působení diazomethanu na některé aromatické acylchloridy II. Syntéza fisetolu“. J. Am. Chem. Soc. 46 (11): 2551–2555. doi:10.1021 / ja01676a028.
- ^ Lewis, H. H .; Nierenstein, M .; Rich, E. M. (1925). „Působení diazomethanu na některé aromatické acylchloridy III. Mechanismus reakce“. J. Am. Chem. Soc. 47 (6): 1728–1732. doi:10.1021 / ja01683a036.
- ^ Reed, D. D .; Bergmeier, S. C. (2007). "Facile Syntéza polyhydroxylovaného 2-azabicyklo [3.2.1] oktanu". J. Org. Chem. 72 (3): 1024–1026. doi:10.1021 / jo0619231. PMID 17253828.
- ^ Beckmann, E. (1886). „Zur Kenntniss der Isonitrosoverbindungen“. Ber. Dtsch. Chem. Ges. (v němčině). 19: 988–993. doi:10,1002 / cber.188601901222.
- ^ Gawley, R. E. (1988). „Beckmannovy reakce: přesmyk, doplnění, fragmentace a přesmyk - cyklizace“. Org. Reagovat. 35: 14–24. doi:10.1002 / 0471264180.nebo035.01. ISBN 0471264180.
- ^ Eck, J. C .; Marvel, C. S. (1939). "kyselina ε-benzoylaminokapronová". Organické syntézy. 19: 20.; Kolektivní objem, 2, 1943, s. 76
- ^ Ritz, J .; Fuchs, H .; Kieczka, H .; Moran, W. C. (2000). „Kaprolaktam“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a05_031. ISBN 3527306730.
- ^ McMurry, J. (1988). Organická chemie (2. vyd.). Brooks / Cole. ISBN 0-534-07968-7.
- ^ Blakemore, P. R.; Burge, M. S. (2007). "Iterativní stereospecifická reagensem kontrolovaná homologace pinakol boronátů enantioenriched-chloralkyllithium reagenty". J. Am. Chem. Soc. 129 (11): 3068–3069. doi:10.1021 / ja068808s. PMID 17326640.
- ^ Elschenbroich, C. „Organometallics“ (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Hartwig, J. F. Organotransition Metal Chemistry, od Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ^ A b C Jones, J. H. (2000). „Proces Cativa pro výrobu kyseliny octové“ (PDF). Platinové kovy Rev. 44 (3): 94–105.
- ^ Sunley, G. J .; Watson, D. J. (2000). „Vysoce produktivní karbonylační methanolová katalýza pomocí iridia - proces Cativa pro výrobu kyseliny octové“. Katalýza dnes. 58 (4): 293–307. doi:10.1016 / S0920-5861 (00) 00263-7.
- ^ Crabtree, R. H. (2009). Organokovová chemie přechodných kovů. John Wiley and Sons. str. 19–25. ISBN 978-0-470-25762-3.
- ^ Kissin, Y. V. (2008). „Syntéza, chemické složení a struktura přechodných kovových komponent a kokatalyzátorů v katalytických systémech pro polymeraci alkenů“. Alkenové polymerační reakce s katalyzátory na bázi přechodných kovů. Amsterdam: Elsevier. 207–290. ISBN 978-0-444-53215-2.