Krční tělo - Carotid body
| Krční tělo | |
|---|---|
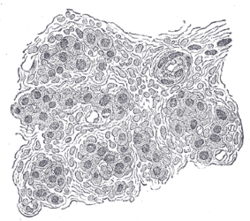 Sekce části lidského krčního těla. Vysoce zvětšené. V řezech mezi buňkami je vidět mnoho krevních cév. | |
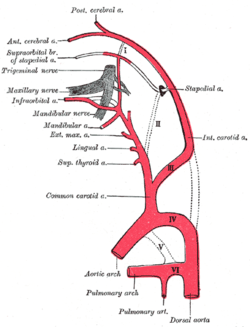 Schéma ukazující původ hlavních větví krčních tepen. | |
| Detaily | |
| Nerv | větev glossofaryngeálního nervu do karotického sinu |
| Identifikátory | |
| latinský | glomus caroticum |
| Pletivo | D002344 |
| TA98 | A12.2.04.007 |
| TA2 | 3886 |
| FMA | 50095 |
| Anatomická terminologie | |
The krční tělo je malá skupina chemoreceptorové buňky a podpůrné sustentakulární buňky. Karotické tělo je umístěno v adventitia, v rozdvojení (vidlice) společná krční tepna, který vede po obou stranách krk.[1][2]
Karotické tělo detekuje změny ve složení arteriální krev protéká jím, hlavně parciální tlak arteriálního kyslíku, ale také z oxid uhličitý. Je také citlivý na změny v pH krve, a teplota.
Struktura
Karotické tělo je tvořeno dvěma typy buněk, tzv buňky glomusu: buňky glomus typu I jsou periferní chemoreceptory a buňky glomus typu II jsou přísný podpůrné buňky.
- Buňky typu Glomus typu I jsou odvozeny z neurální lišta.[3] Vydávají různé neurotransmitery, počítaje v to acetylcholin, ATP, a dopamin ten spoušť EPSP v synapsovaných neuronech vedoucích k dýchací centrum. Jsou inervovány axony glossofaryngeálního nervu, které se souhrnně nazývají karotický sinusový nerv.
- Buňky typu Glomus typu II se podobají gliové buňky, vyjádřit gliovou značku S100 a působí jako podpůrné buňky.
Funkce
Tato sekce potřebuje víc lékařské odkazy pro ověření nebo se příliš spoléhá na primární zdroje. (Říjen 2019) |
Karotické tělo funguje jako senzor: reaguje na podnět, primárně O2 parciální tlak, který je detekován buňkami typu I (glomus), a spouští an akční potenciál skrz aferentní vlákna z glossofaryngeální nerv, který přenáší informace do centrálního nervového systému.
Podnět
Karotické tělo periferní chemoreceptory jsou primárně citlivé na poklesy parciálního tlaku kyslíku (PÓ2). To je na rozdíl od centrální chemoreceptory v medulla oblongata které jsou primárně citlivé na změny pH a PCO2 (pokles pH a zvýšení PCO2). Chemoreceptory těla karotidy jsou také citlivé na pH a PCO2, ale pouze sekundárně. Přesněji řečeno, citlivost chemoreceptorů karotického těla na sníženou PÓ2 je větší, když je pH sníženo a PCO2 se zvyšuje.
Rychlost impulsu pro krční těla je zvláště citlivá na změny arteriálního PO2 v rozmezí 60 až 30 mm Hg, což je rozmezí, ve kterém saturace hemoglobinu kyslíkem rychle klesá.[2]
Produkce karotických tělísek je při kyslíku nízká částečný tlak nad přibližně 100 mmHg (13,3 kPa ) (při normálním fyziologickém pH), ale pod 60 mmHg se aktivita buněk typu I (glomus) rychle zvyšuje v důsledku snížení saturace hemoglobinem kyslíkem pod 90%.
Detekce
Mechanismus pro detekci snížení PÓ2 dosud nebylo identifikováno, může existovat více mechanismů a může se u jednotlivých druhů lišit.[4] Hypoxie Bylo prokázáno, že detekce závisí na zvýšení sirovodík generace produkovaná cystathionin gama-lyáza protože detekce hypoxie je snížena u myší, u kterých je tento enzym vyřazen nebo farmakologicky inhibován. Proces detekce zahrnuje interakci cystathionin gama-lyázy s hemeoxygenáza-2 a výroba kysličník uhelnatý.[5] Některé studie přesto ukazují, že fyziologická koncentrace sirovodíku nemusí být dostatečně silná, aby takové reakce vyvolala.
Jiné teorie naznačují, že to může zahrnovat mitochondriální kyslíkové senzory a hem obsahující cytochromy, které procházejí reverzibilní redukcí jednoho elektronu během oxidačně-fosforylace. Hem reverzibilně váže O2 s afinitou podobnou afinitě karotického těla, což naznačuje, že proteiny obsahující hem mohou mít roli v O2, potenciálně by to mohl být jeden z komplexů zapojených do oxidačně-fosforylace. To vede ke zvýšení reaktivních forem kyslíku a ke zvýšení intracelulárního Ca2+. Není však známo, zda hypoxie vede ke zvýšení nebo snížení reaktivních forem kyslíku. Úloha reaktivních forem kyslíku při snímání hypoxie je rovněž zpochybňována.[6]
Jako senzor hypoxie byl také navržen enzym hem-oxidáza závislá na kyslíku. Při normoxii generuje hem-oxygenáza oxid uhelnatý (CO), CO aktivuje vápníkem aktivovaný draslíkový kanál s velkou vodivostí, BK. Poklesy CO, ke kterým dochází v důsledku hypoxie, by vedly k uzavření tohoto draslíkového kanálu, což by vedlo k depolarizaci membrány a následné aktivaci karotického těla.[7] Při snímání hypoxie byla také navržena role „energetického senzoru“ AMP-aktivované protein kinázy (AMPK). Tento enzym se aktivuje v době využití čisté energie a metabolického stresu, včetně hypoxie. AMPK má řadu cílů a zdá se, že v karotickém těle, když je AMPK aktivován hypoxií, vede k uzavření draslíkového kanálu O2- vysílací kanály podobné úkolům a BK[8]
Zvýšený PCO2 je detekován, protože CO2 šíří do buňky, kde zvyšuje koncentraci kyselina uhličitá a tudíž protony. Přesný mechanismus CO2 snímání není známo, nicméně bylo prokázáno, že CO2 a nízké pH inhibuje vodivost draslíku podobnou TASK, čímž snižuje proud draslíku. To vede k depolarizaci buněčné membrány, která vede k Ca2+ vstup, excitace buněk glomu a následné uvolnění neurotransmiteru.[9]
Arteriální acidóza (buď metabolické nebo ze změněných PCO2 ) inhibuje acidobazické transportéry (např. Na+-H+) které zvyšují intracelulární pH a aktivuje transportéry (např. Cl−-HCO3−), které ji snižují. Změny v koncentraci protonů způsobené acidózou (nebo opačně od alkalóza ) uvnitř buňky stimuluje stejné dráhy zapojené do PCO2 snímání.
Další mechanismus je prostřednictvím na kyslík citlivých draslíkových kanálů. Pokles rozpuštěného kyslíku vede k uzavření těchto kanálů, což má za následek depolarizaci. To vede k uvolňování neurotransmiteru dopaminu v glossofaryngeální a vagové aferenci do vazomotorické oblasti.
Akční potenciál
Buňky typu I (glomus) v karotidách (a aortálních tělech) jsou odvozeny z neuroektodermu a jsou tedy elektricky excitovatelné. To vše může způsobit pokles parciálního tlaku kyslíku, zvýšení parciálního tlaku oxidu uhličitého a snížení arteriálního pH depolarizace z buněčná membrána, a ovlivňují to blokováním draslík proudy. Toto snížení membránový potenciál otevře se napěťově řízené vápník kanálů, což způsobuje zvýšení intracelulární koncentrace vápníku. To způsobuje exocytóza z vezikuly obsahující různé neurotransmitery, počítaje v to acetylcholin, noradrenalin, dopamin, adenosin, ATP, látka P, a met-enkefalin. Tito jednají receptory na aferentní nervová vlákna, která leží v apozici k buňce glomus a způsobují akční potenciál.
Relé
Zpětná vazba z těla krční tepny je odeslána do kardiorespiračních center v medulla oblongata prostřednictvím aferentních poboček glossofaryngeální nerv. Eferentní vlákna aortální tělo chemoreceptory jsou přenášeny bludný nerv. Tato centra zase regulují dýchání a krevní tlak, přičemž hypoxie způsobuje zvýšení ventilace.
Klinický význam

Paraganglioma
A paraganglioma je nádor, který může postihovat karotické tělo a obvykle je benigní. Zřídka maligní neuroblastom mohou pocházet z karotického těla.
Reference
- ^ "Karotické tělo a karotický sinus - obecné informace". Protokoly hlavy a krku v Iowě. Medicine.uiowa.edu. Citováno 23. října 2019.
- ^ A b Hall, John Edward. Guyton a Hall učebnice lékařské fyziologie (13. vydání). Philadelphia, PA. ISBN 978-1-4557-7005-2. OCLC 900869748.
- ^ Gonzalez C, Almaraz L, Obeso A, Rigual R (1994). "Karotidové tělní chemoreceptory: od přírodních stimulů po senzorické výboje". Physiol. Rev. 74 (4): 829–98. doi:10.1152 / fyzrev.1994.74.4.829. PMID 7938227.
- ^ Ward JP (2008). "Senzory kyslíku v kontextu". Biochim Biophys Acta. 1777 (1): 1–14. doi:10.1016 / j.bbabio.2007.10.010. PMID 18036551.
- ^ Peng Y-J, Nanduri J, Raghuraman G, Souvannakitti D, Gadalla M.M, Kumar GK, Snyder SH, Prabhakar NR. (2010). H2S zprostředkovává snímání O2 v karotickém těle PNAS 107 (23) 10719-10724. doi:10.1073 / pnas.1005866107
- ^ Gonzalez C, Sanz-Alfayate G, Agapito MT, Gomez-Niño A, Rocher A, Obeso A (2002). „Senzory kyslíku v kontextu“. Respir Physiol Neurobiol. 132 (1): 17–41. doi:10.1016 / S1569-9048 (02) 00047-2. PMID 12126693. S2CID 25674998.
- ^ Williams SE, Wootton P, Mason HS, Bould J, Iles DE, Riccardi D, Peers C, Kemp PJ (2004). „Hemoxygenáza-2 je kyslíkový senzor pro draslíkový kanál citlivý na vápník“. Věda. 306 (5704): 2093–7. doi:10.1126 / science.1105010. PMID 15528406. S2CID 41811182.
- ^ Wyatt CN, Mustard KJ, Pearson SA, Dallas ML, Atkinson L, Kumar P, Peers C, Hardie DG, Evans AM (2007). „Proteinkináza aktivovaná AMP zprostředkovává vzrušení krční tkáně hypoxií“. J Biol Chem. 282 (11): 8092–8. doi:10,1074 / jbc.M608742200. PMC 1832262. PMID 17179156.
- ^ Buckler KJ, Williams BA, Honore E (2000). „Kyslíkový, kyselý a anestetický citlivý draslíkový kanál podobný TASK v krysích arteriálních chemoreceptorových buňkách“. J. Physiol. 525 (1): 135–142. doi:10.1111 / j.1469-7793.2000.00135.x. PMC 2269923. PMID 10811732.
