Protocadherin - Protocadherin
| Protocadherin, cytoplazmatický | |||||||||
|---|---|---|---|---|---|---|---|---|---|
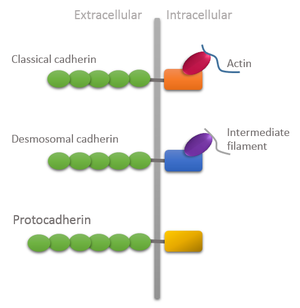 Organizace domény různých typů kadherinů vykazující jedinečné vlastnosti protocadherinů: Extracelulární doména je delší a intracelulární doméně chybí vazba na cytoskelet. | |||||||||
| Identifikátory | |||||||||
| Symbol | PDCH | ||||||||
| Pfam | PF08374 | ||||||||
| InterPro | IPR013585 | ||||||||
| Membranome | 114 | ||||||||
| |||||||||
Protocadherins (Pcdhs) jsou největší podskupinou savců v kadherin nadčeleď homofilních proteinů buněčné adheze.[1] Objevila je skupina Shintaro Suzuki, když pomocí PCR našli nové členy rodiny kadherinů. Fragmenty PCR, které odpovídaly protocadherinům, byly nalezeny u druhů obratlovců a bezobratlých.[2] Tato prevalence u široké škály druhů naznačovala, že fragmenty byly součástí starověku kadherin a byly proto označovány jako „protocadheriny“ jako „první kadheriny“. Z přibližně 70 genů Pcdh identifikovaných v savčích genomech je více než 50 lokalizováno v těsně spojených genových shlucích na stejném chromozomu.[3] Až donedávna se předpokládalo, že tento druh organizace lze nalézt pouze u obratlovců,[3] ale Octopus bimaculoides má 168 genů, z nichž téměř tři čtvrtiny se nacházejí v tandemových shlucích, přičemž dva největší shluky ohrožují 31, respektive 17 genů.[4]
Klasifikace
U savců byly definovány dva typy genů Pcdh: neuskupené Pcdh, které jsou rozptýleny po celém genomu; a seskupené Pcdhs organizované ve třech genových shlucích označených a, p, y, které v genomu myší obsahují 14, 22 a 22, respektive velké variabilní exony uspořádané do tandemu. Každý exon je přepsán z jeho vlastnického promotoru a kóduje: celou extracelulární doménu, transmembránovou doménu a krátkou a variabilní intracelulární doménu odpovídajícího proteinu Pcdh, která se liší od intracelulární domény kadherinu kvůli nedostatečné vazbě na cytoskelet přes kateniny.[5]
Kromě toho jsou tyto seskupené geny Pcdh převážně exprimovány ve vyvíjejícím se nervovém systému[2] a protože různé podskupiny genů Pcdh jsou odlišně exprimovány v jednotlivých neuronech, může z této kombinatorické exprese vzniknout obrovská rozmanitost buněčného povrchu.[5] To vedlo ke spekulacím a dále k návrhu, že Pcdhs může poskytnout kód synaptické adresy pro neuronovou konektivitu nebo jednobuněčný čárový kód pro sebepoznávání / vyhýbání se podobné tomu, který je připisován DSCAM bílkoviny bezobratlých. Ačkoli DSCAM obratlovců postrádají rozmanitost svých protějšků bezobratlých, lze selektivní transkripce jednotlivých izoforem Pcdh dosáhnout výběrem promotoru následovaným alternativní cis-sestřihem pre-mRNA, čímž se zvýší počet možných kombinací.
Funkce
Homofilní interakce a intracelulární signalizace
Klastrované proteiny Pcdhs jsou detekovány v celém neuronálním soma, dendritech a axonech a jsou pozorovány v synapsích a růstových kuželech.[6][7][8][9][10] Stejně jako u klasických kadherinů bylo prokázáno, že členové rodiny Pcdhs také zprostředkovávají adhezi mezi buňkami v testech založených na buňkách[11][12][13] a většina z nich prokázala zapojení do homofilních trans-interakcí.[14] Schreiner a Weiner [14] ukázaly, že proteiny Pcdhα a y mohou tvořit multimerní komplexy. Pokud by se všechny tři třídy Pcdh mohly zapojit do multimerizace stochasticky exprimovaných izoforem Pcdhs, pak by neurony mohly produkovat velké množství odlišných homofilních interakčních jednotek, což by významně zesilovalo rozmanitost buněčného povrchu více, než jakou poskytuje samotná exprese stochastického genu.
Pokud jde o cytoplazmatickou doménu, všechny tři třídy seskupených proteinů Pcdhs jsou odlišné, i když jsou přísně konzervovány ve vývoji obratlovců, což naznačuje konzervovanou buněčnou funkci.[5] To je potvrzeno velkým množstvím dalších interagujících proteinů, včetně fosfatáz, kináz, adhezních molekul a synaptických proteinů[15] Cytoplazmatická doména také zprostředkovává intracelulární retenci, vlastnost, která odlišuje shlukované protocadheriny od souvisejících klasických kadherinů.[16] Dále se ukázalo, že Pcdhs jsou proteolyticky zpracovány y-sekretáza komplex,[17][18] který uvolňuje rozpustné intracelulární fragmenty do cytoplazmy, které mohou mít širokou škálu funkcí lokálně působících v cytoplazmě a / nebo dokonce regulovat genovou expresi podobně jako jiné proteiny na povrchu buněk, jako jsou Zářez a N-kadherin. Protože jsou tyto molekuly zapojeny do tolika vývojových procesů, jako je vedení axonů a dendritická arborizace mohou hrát roli mutace v genech Pcdhs a jejich exprese Dolů, Rett stejně jako Syndrom křehkého X,[19] schizofrenie,[20] a neurodegenerativní nemoci[21]
Cytoplazmatickou doménu Pcdh-alfa lze rozdělit na dva specifické typy. Oba zvyšují homofilní interakce. Sdružují se s neurofilament M a fascinující resp.[22]
Lidské geny
- PCDH1
- PCDH7
- PCDH8
- PCDH9
- PCDH10
- PCDH11X /11R
- PCDH12
- PCDH15
- PCDH17
- PCDH18
- PCDH19
- PCDH20
- PCDHA1
- PCDHA2
- PCDHA3
- PCDHA4
- PCDHA5
- PCDHA6
- PCDHA7
- PCDHA8
- PCDHA9
- PCDHA10
- PCDHA11
- PCDHA12
- PCDHA13
- PCDHAC1
- PCDHAC2
- PCDHB1
- PCDHB2
- PCDHB3
- PCDHB4
- PCDHB5
- PCDHB6
- PCDHB7
- PCDHB8
- PCDHB9
- PCDHB10
- PCDHB11
- PCDHB12
- PCDHB13
- PCDHB14
- PCDHB15
- PCDHB16
- PCDHB17
- PCDHB18
- PCDHGA1
- PCDHGA2
- PCDHGA3
- PCDHGA4
- PCDHGA5
- PCDHGA6
- PCDHGA7
- PCDHGA8
- PCDHGA9
- PCDHGA10
- PCDHGA11
- PCDHGA12
- PCDHGB1
- PCDHGB2
- PCDHGB3
- PCDHGB4
- PCDHGB5
- PCDHGB6
- PCDHGB7
- PCDHGC3
- PCDHGC4
- PCDHGC5
- TLUSTÝ
- FAT2
- FAT4
Viz také
- Cadherin
- PCDH11X
- Neuronální vyhýbání se sobě samému
- Epileptická encefalopatie, raně dětská, 9 způsobené mutací v genu kódujícím protocadherin-19
Reference
- ^ Hulpiau P, van Roy F (únor 2009). "Molekulární vývoj nadrodiny kadherinů". International Journal of Biochemistry & Cell Biology. 41 (2): 349–69. doi:10.1016 / j.biocel.2008.09.027. PMID 18848899.
- ^ A b Sano K, Tanihara H, Heimark RL, Obata S, Davidson M, St John T, Taketani S, Suzuki S (červen 1993). „Protocadheriny: velká rodina molekul souvisejících s kadherinem v centrální nervové soustavě“. Časopis EMBO. 12 (6): 2249–56. doi:10.1002 / j.1460-2075.1993.tb05878.x. PMC 413453. PMID 8508762.
- ^ A b Chen WV, Alvarez FJ, Lefebvre JL, Friedman B, Nwakeze C, Geiman E, Smith C, Thu CA, Tapia JC, Tasic B, Sanes JR, Maniatis T (srpen 2012). „Funkční význam diverzifikace izoforem v klastru genu genu protocadherinu“. Neuron. 75 (3): 402–9. doi:10.1016 / j.neuron.2012.06.039. PMC 3426296. PMID 22884324.
- ^ Albertin, Caroline B .; Simakov, Oleg; Mitros, Therese; Wang, Z. Yan; Pungor, Judit R .; Edsinger-Gonzales, Eric; Brenner, Sydney; Ragsdale, Clifton W .; Rokhsar, Daniel S. (srpen 2015). „Genom chobotnice a vývoj nervových a morfologických novinek hlavonožců“. Příroda. 524 (7564): 220–224. Bibcode:2015 Natur.524..220A. doi:10.1038 / příroda14668. ISSN 0028-0836. PMC 4795812. PMID 26268193.
- ^ A b C Chen WV, Maniatis T (srpen 2013). "Klastrované protocadheriny". Rozvoj. 140 (16): 3297–302. doi:10.1242 / dev.090621. PMC 3737714. PMID 23900538.
- ^ Kohmura N, Senzaki K, Hamada S, Kai N, Yasuda R, Watanabe M, Ishii H, Yasuda M, Mishina M, Yagi T (červen 1998). „Rozmanitost odhalena novou rodinou kadherinů exprimovaných v neuronech v synaptickém komplexu“. Neuron. 20 (6): 1137–51. doi:10.1016 / s0896-6273 (00) 80495-x. PMID 9655502.
- ^ Wang X, Weiner JA, Levi S, Craig AM, Bradley A, Sanes JR (prosinec 2002). „K přežití spinálních interneuronů jsou vyžadovány gama protocadheriny.“ Neuron. 36 (5): 843–54. doi:10.1016 / s0896-6273 (02) 01090-5. PMID 12467588.
- ^ Kallenbach S, Khantane S, Carroll P, Gayet O, Alonso S, Henderson CE, Dudley K (červen 2003). "Změny v subcelulární distribuci protocadherinových gama proteinů doprovázejí zrání spinálních neuronů". Journal of Neuroscience Research. 72 (5): 549–56. doi:10.1002 / jnr.10618. PMID 12749019.
- ^ Phillips GR, Tanaka H, Frank M, Elste A, Fidler L, Benson DL, Colman DR (červen 2003). „Gama-protocadheriny jsou zaměřeny na podmnožiny synapsí a intracelulárních organel v neuronech“. The Journal of Neuroscience. 23 (12): 5096–104. doi:10.1523 / JNEUROSCI.23-12-05096.2003. PMID 12832533.
- ^ Junghans D, Heidenreich M, Hack I, Taylor V, Frotscher M, Kemler R (únor 2008). "Postsynaptická a diferenciální lokalizace neuronálních podtypů protocadherinu beta16 v savčím centrálním nervovém systému". Evropský žurnál neurovědy. 27 (3): 559–71. doi:10.1111 / j.1460-9568.2008.06052.x. PMID 18279309.
- ^ Obata S, Sago H, Mori N, Rochelle JM, Seldin MF, Davidson M, St John T, Taketani S, Suzuki ST (prosinec 1995). "Protocadherin Pcdh2 vykazuje vlastnosti podobné, ale odlišné od vlastností klasických kadherinů". Journal of Cell Science. 108 (Pt 12): 3765–73. PMID 8719883.
- ^ Frank M, Ebert M, Shan W, Phillips GR, Arndt K, Colman DR, Kemler R (srpen 2005). "Diferenciální exprese jednotlivých gama-protocadherinů během vývoje mozkového mozku". Molekulární a buněčné neurovědy. 29 (4): 603–16. doi:10.1016 / j.mcn.2005.05.001. PMID 15964765.
- ^ Reiss K, Maretzky T, Haas IG, Schulte M, Ludwig A, Frank M, Saftig P (srpen 2006). „Regulované vylučování ektodomény závislé na ADAM10 gamma-protocadherinu C3 moduluje adhezi mezi buňkami“. The Journal of Biological Chemistry. 281 (31): 21735–44. doi:10,1074 / jbc.M602663200. PMID 16751190.
- ^ A b Schreiner D, Weiner JA (srpen 2010). „Kombinatorická homofilní interakce mezi multimery gama-protocadherinu výrazně rozšiřuje molekulární rozmanitost buněčné adheze“. Sborník Národní akademie věd Spojených států amerických. 107 (33): 14893–8. doi:10.1073 / pnas.1004526107. PMC 2930437. PMID 20679223.
- ^ Schalm SS, Ballif BA, Buchanan SM, Phillips GR, Maniatis T (srpen 2010). "Fosforylace protocadherinových proteinů receptorem tyrosinkinázy Ret". Sborník Národní akademie věd Spojených států amerických. 107 (31): 13894–9. doi:10.1073 / pnas.1007182107. PMC 2922223. PMID 20616001.
- ^ Fernández-Monreal M, Kang S, Phillips GR (březen 2009). „Homofilní interakce gama-protocadherin a intracelulární přenos jsou řízeny cytoplazmatickou doménou v neuronech“. Molekulární a buněčné neurovědy. 40 (3): 344–53. doi:10.1016 / j.mcn.2008.12.002. PMC 2646808. PMID 19136062.
- ^ Bonn S, Seeburg PH, Schwarz MK (červen 2007). „Kombinatorická exprese alfa- a gama-protocadherinů mění jejich zpracování závislé na presenilinu“. Molekulární a buněčná biologie. 27 (11): 4121–32. doi:10.1128 / MCB.01708-06. PMC 1900011. PMID 17403907.
- ^ Buchanan SM, Schalm SS, Maniatis T (říjen 2010). „Proteolytické zpracování protocadherinových proteinů vyžaduje endocytózu“. Sborník Národní akademie věd Spojených států amerických. 107 (41): 17774–9. Bibcode:2010PNAS..10717774B. doi:10.1073 / pnas.1013105107. PMC 2955128. PMID 20876099.
- ^ Kaufmann WE, Moser HW (říjen 2000). "Dendritické anomálie v poruchách spojených s mentální retardací". Mozková kůra. 10 (10): 981–91. doi:10.1093 / cercor / 10.10.981. PMID 11007549.
- ^ Kalmady SV, Venkatasubramanian G (březen 2009). "Důkazy pro pozitivní selekci na Protocadherin Y gen u Homo sapiens: důsledky pro schizofrenii". Výzkum schizofrenie. 108 (1–3): 299–300. doi:10.1016 / j.schres.2008.09.015. PMID 18938061.
- ^ Anderton BH, Callahan L, Coleman P, Davies P, Flood D, Jicha GA, Ohm T, Weaver C (srpen 1998). „Dendritické změny Alzheimerovy choroby a faktory, které mohou být základem těchto změn“. Pokrok v neurobiologii. 55 (6): 595–609. doi:10.1016 / s0301-0082 (98) 00022-7. PMID 9670220.
- ^ Triana-Baltzer GB, Blank M (březen 2006). „Cytoplazmatická doména protocadherinu-alfa zvyšuje homofilní interakce a rozpoznává cytoskeletální prvky“. Journal of Neurobiology. 66 (4): 393–407. doi:10.1002 / neu.20228. PMID 16408303.
Další čtení
- Han MH, Lin C, Meng S, Wang X (leden 2010). „Proteomická analýza odhaluje překrývající se funkce klastrovaných protocadherinů“. Molekulární a buněčná proteomika. 9 (1): 71–83. doi:10,1074 / mcp.M900343-MCP200. PMC 2808268. PMID 19843561.
- Sotomayor M, Gaudet R, Corey DP (září 2014). „Třídění promiskuitní nadčeleď: směrem k kadherinové konektomice“. Trendy v buněčné biologii. 24 (9): 524–36. doi:10.1016 / j.tcb.2014.03.007. PMC 4294768. PMID 24794279.
